Mines Physique et Chimie PCSI 2008
| Thème de l'épreuve | Énergies renouvelables chimiques. Saturne, ses anneaux, son satellite Titan. |
| Principaux outils utilisés | solutions aqueuses, thermochimie, cinétique, chimie organique, oxydoréduction, optique géométrique, életrocinétique, mécanique du point, thermodynamique |
| Mots clefs | énergies renouvelables, fermentation, biogaz, bioalcool, bioéthanol, tampon, chiralité, méthane, méhanol, essence, additif, température de flamme, cinétique enzymatique, inversion du saccharose, pile à combustible, saccharose, glucose, limite de Roche, atmosphère isotherme, lunette afocale, comparateur, amplificateur opérationnel, diode, point de fonctionnement, référentiel non galiléen, marée, loi des aires, composition des vitesses, loi de Laplace, Titan, Saturne, lunette de Galilée, Cassini-Huygens |
Corrigé
:- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Énoncé obtenu par reconnaissance optique des caractères
CONCOURS COMMUN 2008
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie
(filière PCSI - option PC)
Mardi 20 mai 2008 de 8h00 à 12h00
Barème indicatif : Physique 1/2 - Chimie 1/2
Instructions générales :
Les candidats doivent vérifier que le sujet comprend 16 pages numérotées 1/16,
2/16, ...16/16
La dernière page est à découper et à rendre avec la copie, sans oublier d'y
avoir indiqué le
code candidat
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou
mal présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres correspondant à l'épreuve spécifique de Physique-Chimie.
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
L'emploi d'une calculatrice est interdit
Remarque importante :
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en
expliquant les raisons des initiatives qu'il
a été amené à prendre.
Sujet de chimie
Énergies renouvelables chimiques
En l'absence de calculatrice, les résultats seront donnés avec deux chiffres
significatifs, des arrondis
seront suggérés par l'énoncé, les constantes d'équilibre pourront être données
sous la forme de
puissances de 10, même décimales.
Toutes les données numériques sont regroupées à la fin de l'énoncé de chimie.
Partie A : Étude du biogaz de décharge
Le biogaz est le gaz produit par la fermentation de matières organiques
animales ou végétales en
l'absence de dioxygène. C'est un mélange composé essentiellement de méthane CH4
et de dioxyde
de carbone CO2, avec des quantités variables d'eau H2O et de sulfure de
dihydrogène H2S.
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 1/16
Nous étudierons les traitements et utilisations possibles d'un biogaz issu de
la digestion de déchets
organiques.
A.I. Étude de la réaction de méthanation du glucose
Les glucides étant des molécules basées sur le glucose de formule brute
C6H12O6, nous étudierons
ici sa décomposition.
Q1. Écrire l'équation de la transformation de glucose en méthane et dioxyde de
carbone.
Q2. Proposer une représentation de Lewis pour les molécules de méthane et de
dioxyde de
carbone.
Q3. Proposer une structure spatiale pour chacune de ces deux molécules
(indiquer les valeurs des angles de liaison).
A.II. L'épuration du biogaz
Hormis quelques applications pour lesquelles le biogaz peut être utilisé
directement, il est généralement purifié. L'épuration consiste à éliminer les
éléments trace (H2S, H2O) mais également le
dioxyde de carbone afin d'enrichir le biogaz en méthane. L'épuration se fait
généralement à des
pressions de quelques dizaines de bars, nous prendrons ici une pression P = 10
bar.
La composition molaire du biogaz considéré est :
CH4 : 60 %, CO2 : 39 %, H2S : 0,10 % et H2O : 0,90 %
A.II.1. Intérêt de l'élimination de l'eau
L'eau liquide peut dissoudre le dioxyde de carbone. Elle est en général
éliminée par condensation
ou par passage dans un dessicateur.
La dissolution du dioxyde de carbone est telle que la concentration en CO2(d)
dissous est proporP
tionnelle à la pression partielle en CO2(g) suivant la loi : [CO2(d ) ] K CO2
CO2 cq (on rappelle que
Pq
c° = 1,00 mol.L-1 et P° = 1,00 bar). Au cours du trajet du biogaz et compte
tenu de variations de
température éventuelles, l'eau peut se condenser en gouttelettes.
On donne la valeur numérique de la constante à 300 K : K CO2 = 2,5.10-2. Pour
l'étude qui suit, la
pression et la température sont constantes et valent : P = 10 bar et T = 300 K.
Q4. Exprimer puis calculer la concentration en CO2(d) des gouttelettes d'eau en
contact avec
le dioxyde de carbone. Afin de simplifier les calculs numériques, vous pourrez
arrondir
le pourcentage à 40 %.
Q5. En déduire le pH de cette solution. On négligera les propriétés
acido-basiques des constituants chimiques autres que le dioxyde de carbone.
Q6. Conclure sur la nécessité d'éliminer l'eau du biogaz.
A.II.2. Élimination du sulfure de dihydrogène
Afin d'éliminer également le sulfure de dihydrogène, on peut laver le gaz avec
une solution contenant des amines. On utilise ici une solution de concentration
c = 0,10 mol.L-1 en diéthanolamine
(DEA) de formule HN(CH2CH2OH)2.
La dissolution du sulfure de dihydrogène est similaire à celle du dioxyde de
carbone. La constante
vaut K H 2 S = 1,0.10-1.
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 2/16
Q7. À l'aide de la constante K H 2 S , calculer la concentration en H2S(d)
lorsque la solution est
en équilibre avec le biogaz (H2S à 0,10 %, pression totale P = 10 bar). La
pression partielle en H2S est constante par apport continu de biogaz.
Q8. Écrire l'équation de la réaction entre le sulfure de dihydrogène et la DEA.
Calculer sa
constante K°.
Q9. Déduire de la question précédente en quoi cette réaction permet d'éliminer
H2S du biogaz.
A.II.3. La combustion du biogaz
L'élimination du dioxyde de carbone se fait par pression alternante sur tamis
moléculaire par exemple, l'absorption du dioxyde de carbone étant meilleure que
celle du méthane. Cette méthode permet
également d'éliminer les traces restantes de sulfure de dihydrogène et des
traces éventuelles
d'ammoniac NH3. On obtient un gaz composé de 95 % de méthane et de 5,0 % de CO2
(composition molaire) qui peut être injecté dans le réseau de gaz naturel.
On cherche maintenant à déterminer la température de flamme obtenue à partir
d'un tel gaz lors de
sa combustion dans l'air. On rappelle que l'air est constitué de 80% de diazote
et 20% de dioxygène
en quantité de matière.
On suppose que la combustion dans l'air est totale et suffisamment rapide pour
être adiabatique, que
le méthane et le dioxygène sont en proportions stoechiométriques et que les gaz
entrent à la température de To = 300 K.
Q10. Écrire l'équation de la réaction de combustion du méthane et calculer son
enthalpie
standard de réaction à To = 300 K. On considèrera que l'eau est sous forme gaz.
Q11. Pour une quantité no de biogaz, dresser un bilan des quantités de matière
avant la combustion et après.
Q12. En déduire l'expression littérale de la température finale atteinte Tf.
Q13. En donner une valeur numérique à deux chiffres significatifs.
Partie B : Production de bioéthanol à partir de disaccharides
Il s'agit de la manière la plus simple d'obtenir des biocarburants. Le jus
sucré (issu de betteraves ou
de cannes à sucre) est mis à fermenter dans une cuve puis distillé afin d'en
réduire la teneur en eau.
On s'intéresse à l'exemple du saccharose. La production se fait en deux étapes.
Hydrolyse ou inversion du saccharose (enzyme : invertase)
C12H22O11 + H2O = glucose + fructose.
Fermentation du glucose : en l'absence de dioxygène
C6H12O6 = 2 C2H5OH + 2 CO2.
On se propose d'étudier la molécule de glucose puis la cinétique de sa
fermentation en relevant les
quantités d'éthanol gazeux dégagé. On utilise ici de la levure de boulanger
qu'on met en suspension
dans un tampon phosphate de pH égal à 6,2.
B.I. La molécule de glucose
Le E-D-glucose dont la strcture est donnée ci-dessous est la forme hémiacétal
cyclique d'un des
diastéréoisomères du pentahydroxy-2,3,4,5,6-hexanal :
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 3/16
H
CH2OH
5
4
HO
H
HO
3
H
O
OH
2
OH
H
1
H
E-D-glucose
B.I.1 Étude de la forme linéaire du glucose
Dans l'étude qui suit, les structures des molécules pourront être données soit
par des formules semidéveloppées soit par des représentations topologiques.
Q14. Donner la structure du pentahydroxy-2,3,4,5,6-hexanal. Repérer ses atomes
de carbone
asymétriques par une *.
Q15. En déduire le nombre de stéréoisomères de configuration de la molécule.
Qu'appelle-ton des « diastéréoisomères » ?
B.I.2 Étude d'un des deux stéréoisomères cycliques du glucose
La forme linéaire du glucose est en équilibre avec sa forme cyclique. Cet
équilibre chimique est basé sur la réaction dite d'acétalisation de l'aldéhyde.
La forme générale de cette réaction pour un aldéhyde et un alcool primaire est :
R'
R
+
O
R
O
R'
OH
OH
Q16. Déterminer les configurations absolues des atomes de carbone asymétriques
du E Dglucose dont la structure a été donnée précédemment.
Q17. On s'intéresse au E-D-glucose. Dessiner l'autre conformère de cette
molécule (cycle en
conformation chaise). Indiquer, en justifiant, lequel des deux conformères est
le plus
stable.
B.I.3 Étude de la réaction d'inversion
Le saccharose est constitué d'une molécule de glucose et d'une molécule de
fructose reliées entre
elles. En présence d'eau et d'acide, la liaison se rompt. L'équation de la
réaction est schématisée ciaprès :
C12H22O11 (saccharose) + H2O = glucose (C6H12O6) + fructose (C6H12O6).
Les pouvoirs rotatoires spécifiques sont notés [D ]G , [D ]F et [D ]S ,
respectivement pour le glucose, le
fructose et le saccharose, d'unités °.dm-1.g-1.L.
Le volume de la solution est constant.
On rappelle la loi de Biot : D ¦[D ]i ACi . Les concentrations Ci sont données
en g.L-1, la longueur
i
de la cuve en dm et l'angle D en degré.
Q18. Établir l'expression du pouvoir rotatoire total de la solution de
saccharose noté D en
fonction des pouvoirs rotatoires spécifiques des espèces mises en jeu dans
cette réaction, de leurs concentrations et de la longueur de la cuve notée A .
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 4/16
Q19. On suppose que la réaction admet un ordre 1 par rapport au saccharose. On
appelle x
l'avancement volumique de la réaction exprimé en mol.L-1, co la concentration
initiale
en saccharose exprimée en mol.L-1 et k la constante cinétique. Établir une
équation différentielle en x.
Q20. On appelle MS la masse molaire du saccharose et MFG la masse molaire du
fructose ou
du glucose (elles sont égales). Donner les relations entre les concentrations
ci exprimées
en mol.L-1 et les Ci en g.L-1.
Q21. On appelle : D o le pouvoir rotatoire initial de la solution, D t , sa
valeur à l'instant t et
D f , au bout d'un temps infini en considérant la réaction comme totale.
Monter que la résolution de l'équation différentielle précédente permet
d'obtenir la relation suivante : ln
Df Do
Df D
kt
B.II. Étude de la fermentation du glucose
B.II.1 Préparation du tampon phosphate
On désire préparer une solution tampon de pH égal à 6,2 et de concentration
totale en phosphore
égale à c = 0,10 mol.L-1. Pour cela, on utilise du dihydrogénophosphate de
sodium hydraté
NaH2PO4, 12 H2O (masse molaire M1 = 336 g.mol-1). Dans une fiole jaugée de
volume V = 1,0 L,
on verse de l'eau distillée puis on introduit une masse m1 de
dihydrogénophosphate de sodium hydraté, on mélange. On ajoute une masse m2
d'hydroxyde de sodium NaOH (masse molaire M2 = 40
g.mol-1) et l'on complète au trait de jauge avec de l'eau distillée.
Q22. Calculer la quantité m1 à introduire pour obtenir une solution de
concentration totale en
phosphore égale à c = 0,10 mol.L-1.
Q23. Quelles sont les espèces de H3PO4 présentes dans la solution tampon à ce
pH ? Justifier.
Q24. Écrire l'équation de la réaction qui se produit lorsqu'on ajoute
l'hydroxyde de sodium.
Calculer sa constante et conclure.
Q25. Exprimer les concentrations en H2PO4- et HPO42- en fonction des quantités
de matière n1
et n2 en H2PO4 et NaOH respectivement introduites et du volume V.
Q26. Exprimer le pH de la solution en fonction de n1, n2 et de la (des)
constante(s) d'acidité
concernée(s).
Q27. En déduire les valeurs de n2 puis de m2 à ajouter pour obtenir un pH égal
à 6,2.
B.II.2 Étude théorique de la catalyse enzymatique
Le mécanisme de réaction avec l'action de la levure peut être modélisé par la
catalyse enzymatique.
On considère la réaction S (substrat) = P (produit) catalysée par l'enzyme E et
on admet que le mécanisme est le suivant :
k1
(1)
S+E
ES
k-1
k2
(2)
ES
P+E
L'espèce notée ES est appelé complexe enzyme substrat.
Q28. D'après le mécanisme proposé ci-dessus, exprimer v, la vitesse de
formation du produit
P.
Q29. En notant [E]o la valeur initiale de la concentration en enzyme, écrire
l'équation traduisant la conservation totale de l'enzyme au cours de la
réaction.
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 5/16
Q30. Appliquer l'approximation des états quasi-stationnaires au complexe
enzyme-substrat.
En utilisant la question précédente, en déduire une expression de la
concentration en
complexe enzyme substrat en fonction de [E]o, [S] et des constantes.
k 1 k2
Q31. On appelle constante de Michaelis et on note KM, l'expression K M
. Exprimer
k1
alors v en fonction de [E]o, KM, k2 et [S].
Q32. On appelle vmax k2 [ E ]o . Expliquer pourquoi il s'agit d'une vitesse
maximale.
L'expression de la vitesse obtenue à la question Q31 permet de construire deux
modèles. Ces modèles permettent de tracer des courbes qui deviennent des
droites lorsqu'ils sont validés.
1
1
1
et montrer qu'en traçant en fonction de
, on peut valider le modèle.
v
v
[S]
Q34. Monter que l'expression obtenue à la question Q31 peut se mettre sous la
forme :
v
KMv
. Montrer alors qu'en traçant v en fonction de
, on peut également vav vmax
[S]
[S]
lider le modèle.
Q33. Exprimer
B.II.3 Étude expérimentale
La méthode utilisée consiste à étudier différents systèmes en faisant varier la
quantité initiale de
substrat (ici le glucose) et en déterminant les vitesses initiales d'apparition
du produit (ici l'éthanol
gazeux).
Q35. Comment détermine-t-on pratiquement, la vitesse initiale de la réaction
étudiée ici ?
On a réalisé la conversion du glucose à 39 °C et obtenu les résultats suivants :
vo (mmol.L-1.s-1)
co (glucose) (mmol.L-1)
1/vo (mol-1.L.s)
1/co (glucose) (mol-1.L)
vo/co (s-1)
1,80
10,0
556
100
0,18
2,50
20,0
400
50,0
0,125
3,20
30,0
313
33,3
0,107
4,00
60,0
250
16,7
0,0667
4,50
90,0
222
11,1
0,05
5,00
150
200
6,67
0,033
Les deux courbes obtenues sont données ci-dessous.
Première méthode
1/vo
600
y = 3,83x + 185
500
400
300
1/co
200
0
20
40
60
80
100
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 6/16
vo
Deuxième méthode
5,00
4,00
y = -22,1x + 5,57
3,00
2,00
vo/co
1,00
0
0,05
0,1
0,15
0,2
Q36. À partir de la première méthode, déterminer les valeurs de KM et vmax à 39
°C pour cette
réaction.
Q37. À partir de la deuxième méthode, déterminer les valeurs de KM et vmax à 39
°C. Les résultats sont-ils compatibles avec ceux de la question précédente ?
Partie C : utilisation des bioalcools
C.I. Synthèse de composés oxygénés de l'essence
On peut utiliser les bioalcools soit comme carburant pur moyennant une
transformation du moteur,
soit comme additifs à l'essence. Dans ce dernier cas, on peut les additionner
tels quels jusqu'à 10%
ou les transformer en éthers.
Le MTBE et l'ETBE sont les composés oxygénés les plus utilisés à ce jour. Le
MTBE (méthyltertiobutyléther) peut être synthétisé à partir de
2-méthylpropan-2-olate de sodium et d'iodure de méthyle.
Q38. Écrire les formules semi-développées des deux réactifs dans la synthèse du
MTBE.
Écrire l'équation de la réaction qui se produit et en déduire la formule du
MTBE.
Q39. Nommer cette réaction et proposer un mécanisme pour cette réaction.
Justifier.
Q40. Proposer une méthode de synthèse de l'alcoolate. Quel type de solvant
doit-on utiliser
pour la réaction de la question Q38. et pourquoi ?
Dans l'industrie, la réaction se fait à partir d'isobutylène
(2-méthylprop-1-ène) et de méthanol avec
un catalyseur fixé sur une résine acide.
Q41. Écrire l'équation de la réaction.
Q42. Proposer un mécanisme pour la synthèse du MTBE commençant par l'action de
l'ion
H+ sur l'isobutylène. Expliquer en quoi l'ion H+ est considéré ici comme un
catalyseur.
Q43. Proposer une raison pour laquelle la réaction précédente (question Q38.)
n'est pas utilisée dans l'industrie.
C.II. Piles à combustible à méthanol direct
Des piles à combustible sont développées actuellement à partir de méthanol,
nous étudierons celle à
méthanol direct dans laquelle le méthanol est utilisé tel quel en tant que
réducteur, l'oxydant étant
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 7/16
du dioxygène. Ces piles ne sont pas très puissantes mais elles ont de grandes
autonomies et peuvent
être utilisées dans des appareils portables (microordinateurs, téléphones ou
autres). Elles fonctionnent à des températures relativement basses autour de 70
°C. Le biométhanol est obtenu à partir de
la biomasse lignocellulosique en deux étapes : conversion en gaz de synthèse
(mélange de CO et
H2) puis recombinaison en méthanol CH3OH. Les électrodes sont en graphite,
métal ou en matériaux composites. La membrane séparant les deux compartiments
est une membrane échangeuse
d'ions.
RT
ln10 à la température de fonctionnement de la pile.
On note eq
F
Q44. Écrire la demi-équation électronique correspondant à la demi-pile
contenant le méthanol
et en déduire l'expression du potentiel de Nernst E1 correspondant.
Remarque : l'eau et le méthanol étant en quantités proches, leurs activités
sont égales à leurs
fractions molaires.
Q45. Écrire la demi-équation électronique correspondant à la demi-pile
contenant le dioxygène et en déduire l'expression du potentiel de Nernst E2
correspondant.
Remarque : l'eau étant ici le seul liquide, son activité est prise égale à 1.
Q46. Le courant circule dans le circuit, à l'extérieur de la pile, en partant
de la demi-pile 2
vers la demi-pile 1. En déduire les polarités attendues de la pile et exprimer
sa force
électromotrice.
Q47. Indiquer en justifiant, quelle électrode est la cathode et laquelle est
l'anode. En déduire
la réaction qui se produit lorsque la pile débite.
Q48. Si on admet que le rendement d'une pile est de 80 %, exprimer la quantité
d'électricité
formée à partir de 10 mL de méthanol.
Q49. Pendant combien de temps pourrait fonctionner la pile, en admettant
toujours un rendement de 80 %, lorsqu'elle délivre un courant d'intensité
supposée constante de 10 A ?
Conclure.
Données relatives à la partie de chimie :
Constantes d'acidité à 298 K :
CO2(d)/HCO3- : pKa1 = 6,4 et HCO3-/CO32- : pKa2 = 10,3.
DEAH+/DEA : pKa = 9,0
H2S/HS- : pK'a1 = 7,0 HS-/S2- : pK'a2 = 13,0
H3PO4/H2PO4- : pK1 = 2,1 ; H2PO4-/HPO42- : pK2 = 7,2 ; HPO42-/PO43- : pK3 =
12,4.
Enthalpies standard de formation à 300 K :
Composé (gaz)
H2O
-1
¨fH° (kJ.mol )
- 240
CO2
- 390
CH4
- 110
Capacités thermiques molaires à pression constante à 300 K considérées comme
constantes dans
l'intervalle de température étudié :
CO2
composé
CH4, N2, O2, H2O
Cp° (J.K-1.mol-1)
30
45
Potentiels standard des couples (à 298 K)
E 2o (O2/H2O) = 1,23 V.
E1o (CO2/CH3OH) = 0, 02 V ;
F(le Faraday) § 105 C.mol-1
Densité du méthanol : d = 0,80
Masse volumique de l'eau : Ue = 1,0 g.cm-3.
Masse molaire moléculaire du méthanol : Mmét = 32 g.mol-1 (qu'on pourra
arrondir à 30 pour simplifier les calculs numériques).
FIN DU SUJET DE CHIMIE
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 8/16
Sujet de physique
Saturne, ses anneaux, son satellite Titan
Ce problème propose l'étude de quelques aspects de la physique, de
l'observation et de
l'exploration de Saturne. Les trois parties (1, 2, 3) et les sous-sections qui
les constituent (1.1, 1.2,
2.1, 2.2 et 3) sont indépendantes. Les questions peuvent être traitées dans
l'ordre choisi par le candidat, mais celui-ci est instamment prié d'écrire
lisiblement le numéro de la question. Les figures
utiles à la compréhension du problème sont incluses dans le corps du texte, les
figures à compléter
sont regroupées sur une même page (paginée 8/8) à détacher et à rendre avec la
copie. Les quelques calculs numériques d'ordre de grandeur proposés sont
faisables sans machine.
1. Première partie : observation des anneaux de Saturne
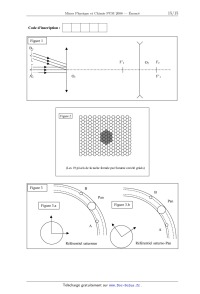
1. Observation de Saturne avec une lunette afocale.
Un astronome pointe sa lunette vers Saturne dans le ciel nocturne dégagé : on
assimile cette planète
à une source de lumière très éloignée, notée Af , et une portion de l'anneau le
plus brillant à une
autre source notée Bf (cf. figure 1). Ces deux sources sont séparées par une
zone sombre. La lunette reçoit de chacune de ces deux sources des faisceaux de
rayons parallèles, l'axe de la lunette
étant parallèle à ceux venant de Af . Le rayon de l'anneau est de l'ordre de RA
= 108 m, la distance
entre la Terre et Saturne est de l'ordre de D 1 5 ~1012 m . On note D l'angle
entre les deux directions. La lunette forme un système afocal, c'est-à-dire
qu'il ne possède pas de foyer : deux rayons
incidents parallèles émergent parallèlement du système optique. Elle est
constituée de deux lentilles
minces : la première, l'objectif, a pour centre O1 et pour vergence V1 = 1/f'1
= +1,0 / ; la seconde,
l'oculaire, a pour centre O2 et pour vergence V2 = 1/f'2 = -5,0 / ; elles sont
écartées de
O1O2
0,80 m. La figure 1, complétée, sera rendue avec la copie : l'échelle sur l'axe
est 1 10 et
l'angle D est volontairement exagéré. Les conditions de Gauss sont supposées
vérifiées.
Q1. Calculer numériquement l'angle D .
Q2. Construire l'image A1 B1 de Af Bf par l'objectif. Est-ce une image réelle
ou virtuelle ?
Sera-t-elle considérée comme un objet réel ou virtuel pour l'oculaire ?
Q3. Tracer des rayons émergents issus de A1 et B1 après traversée de
l'oculaire. Expliquer
pourquoi cette lunette est bien afocale.
Q4. On note D c l'angle entre la direction des faisceaux de rayons émergents
issus de Af et
celle des rayons émergents issus de Bf . On appelle grossissement le rapport G
D '/ D . Exprimer
la valeur absolue de G en fonction de f c1 et f c2 et la calculer numériquement.
Q5. L'oeil, sans instrument d'optique, ne peut distinguer deux rayons que si
l'angle qui les
sépare est supérieur ou égal à D 0 1, 0 ~10 4 rad (c'est le pouvoir séparateur
de l'oeil). Vérifier que
l'utilisation de la lunette est indispensable pour distinguer les anneaux de
Saturne.
Q6. Une caméra numérique remplace l'oeil derrière l'oculaire : elle est
constituée par une
lentille convergente de vergence V3=+50 / (remplaçant le cristallin) et une
plaque tapissée de cellules photosensibles en nid d'abeille distantes de 1 µm
(remplaçant les cellules de la rétine) placée
dans le plan focal de la lentille. Sur la figure 2, on a noirci les cellules
recevant de la lumière venant
de la planète Saturne elle-même (où il apparaît qu'elle n'est pas réellement
ponctuelle car son
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 9/16
image occupe plusieurs pixels) ; noircir les cellules qui recevront de la
lumière venant de l'anneau
(on suppose qu'il est vu de face et de faible largeur). En déduire pourquoi on
peut effectivement reconnaître la forme d'un anneau.
2. Etude des cellules de l'appareil de prises de vue numérique
Les cellules de l'appareil de prises de vue numérique convertissent une
impulsion lumineuse
reçue au moment de la prise de vue en une impulsion électrique :
· si la cellule reçoit de la lumière au-dessus d'un certain seuil, la tension
de sortie, notée Ue cidessous, décrit un créneau, formé d'un échelon descendant
de tension suivi d'un échelon remontant
de tension : 0 o E o 0 ;
Ue
t
0
-E
· si la lumière reçue par la cellule reste en-dessous du seuil (ce qui
correspond à l'obscurité), la tension de sortie reste à la valeur 0.
L'électronique de traitement de l'information, intégrée dans l'appareil, a
alors plusieurs rôles, dont nous tirons deux étapes essentielles :
· l'amplification du signal électrique lorsque la cellule a reçu de la lumière
au-dessus du seuil ;
· la mise en mémoire de l'information : on souhaite conserver durablement,
après la prise de vue,
une tension dont la valeur soit représentative de l'état de la cellule lors de
la prise de vue : 0 V correspond à une cellule ayant reçu moins de lumière que
le seuil « obscurité », 15 V correspond à
une cellule ayant reçu une impulsion lumineuse au-dessus du seuil « lumière ».
Ces deux fonctions sont réalisées par le montage suivant qui comprend trois
étages.
étage 1
étage 2
E+
Ue
S
'
E-
diode
EU'e
E+
S
'
E+
R
R
R0
étage 3
EU2
S
'
Us
U3
R
U1
R
Tous les amplificateurs opérationnels sont idéaux, de gain infini, de tension
de saturation
15 V. Les résistors notés R ont une résistance R 50 k . La diode est idéale :
la tension à
VSAT
ses bornes est nulle lorsqu'elle est passante, le courant qui la traverse est
nul lorsqu'elle est bloquée,
lorsque le potentiel à son entrée est strictement inférieur à celui à sa sortie
; sa caractéristique est
rappelée ci-après.
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 10/16
i
u
u
i
Q7. Les étages 1 et 2 diffèrent par l'entrée sur laquelle est branchée la
boucle de contreréaction : sur l'entrée inverseuse E dans le 1 et sur l'entrée
non inverseuse E dans le 2 ; quelle
est la conséquence fondamentale de cette différence dans le régime de
fonctionnement des deux
amplificateurs opérationnels ?
Étude de l'étage 1.
Q8. Etablir l'expression de la tension U 'e en fonction de la tension U e et
des résistances R
et R0.
Q9. En déduire le nom de la fonction réalisée par cet étage.
Q10. La tension d'entrée U e ne peut prendre que les valeurs 0 V et
E
50 mV. On veut
que la tension U 'e puisse prendre les valeurs 0 V et 10 V. En déduire la
valeur de R0 .
Étude de l'étage 2.
Q11. Exprimer la tension U1 en fonction de la tension U 2 .
Q12. On isole cet étage du reste du circuit et on suppose que l'on fait varier
continûment
U 'e de la valeur 10 V à la valeur 10 V puis de la valeur 10 V à la valeur 10
V. Déterminer, en
justifiant brièvement, les variations de U 2 lors de ce cycle. Tracer l'allure
de la courbe dans un diagramme où U 'e figure en abscisse et U 2 en ordonnée.
Q13. En déduire le nom de la fonction réalisée par cet étage.
VSAT
15 V grâce à un dispositif
Q14. Avant la prise de vue, U e 0 V et on impose U 2
non représenté sur le schéma (la fonction RESET). Montrer que
· si la cellule reçoit moins de lumière que le seuil, U 2 restera bloquée à 15
V après la prise de vue,
· si la cellule reçoit une impulsion lumineuse au-dessus du seuil, U 2 restera
bloquée à 15 V après
la prise de vue.
On pourra utiliser la courbe tracée à la question 12.
Étude de l'étage 3.
Q15. Comment s'appelle la partie du montage ne comportant que l'amplificateur
opérationnel et les fils qui l'entourent ?
15 V, alors U s 0 V, et que si U 2
15 V, alors U s
15 V.
Q16. Montrer que si U 2
Le montage réalise donc bien la fonction voulue (amplification et mise en
mémoire) : l'étape
suivante, non détaillée ici, est la lecture des états des tensions de sortie de
chaque cellule, et sa
transcription sous forme d'image découpée en pixels (abréviation de « picture
element »).
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 11/16
2. Deuxième partie : étude dynamique des anneaux de Saturne
La planète Saturne est assimilée à un corps à répartition sphérique de masses,
de centre OS ,
de masse mS
6 ~1026 kg, de rayon RS . On suppose que le référentiel saturnien, de point
fixe OS et
en translation circulaire par rapport au référentiel héliocentrique, est
galiléen. On note
tante de gravitation.
la cons-
1. Les anneaux de Saturne ne sont pas des solides
Supposons qu'un anneau soit un agglomérat solide de corps (rochers, cailloux,
blocs de
glace), en rotation uniforme à la vitesse angulaire Z autour de Saturne. On
isole deux de ces corps
formant un doublet G {M 1 M 2 } , de faible taille à l'échelle astronomique, de
centre d'inertie G, de
même masse m , à la distance 2a l'un de l'autre ; on suppose, en outre, que :
· OS , M 1 et M 2 restent alignés en permanence ;
JJG JJG JJG
OS G
, OS G r u r , T Z ~ t , et on définit le repère cylindrique (ur , uT , u z ) ;
OS G
JJJJJJG
JJG
JJJJJJG
JJG
· il vient OS M 1 (r a )ur et OS M 2 (r a )ur ;
·a
r ;
JJG JJG JJG
· le référentiel Sd (OS ur uT u z ) est appelé référentiel saturno-doublet :
c'est un référentiel
non galiléen en rotation uniforme par rapport au référentiel saturnien, à la
vitesse angulaire Z et
dans lequel OS , G , M 1 et M 2 sont immobiles.
· on pose u r
M2
M1
G
a
a
r
u
ur
OS
uz
On néglige l'influence de tous les autres corps de l'anneau sur le système G .
Q17. En écrivant le théorème de la résultante cinétique sur le doublet G ,
établir l'identité
mS
r2
Z 2r .
Q18. Faire l'inventaire de toutes les forces subies par M 1 dans Sd et montrer
que leur
JG
JJG
somme vectorielle peut s'écrire 6 f f (a r )ur : on donnera l'expression de f
(a r ) comme une
fonction des variables a et r et des paramètres , m et mS .
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC)
Page 12/16
' r - - , . a
On admet pour la su1te que par un developpement hm1te au prem1er ordre en -- << 1, cette r ÿm2 _ 3 ÿmsma 4a2 r3 l'anneau si la résultante des forces a tendance à éloigner M 2 de M1 , donc si f (a,r) < 0 . fonction a pour valeur approchée : f (a, r) = . Il y aura dislocation progressive de Q19. Montrer que cette condition se traduit par l'existence d'une valeur minimale r() de r (on l'appelle limite de Roche) ne dépendant que de ms et de ,a = %. On donne u = 720 kg-m". Déduire de ce qui précède un ordre de grandeur de ro . Conclure en considérant que les anneaux ont un rayon de l'ordre de 108 m. Dans ce qui suit, on assimile tous les corps autour de Saturne a des petits et moyens blocs solides indépendants en orbite circulaire et on néglige toutes les forces d'interaction entre eux de-- vant l'attraction gravitationnelle de la planète. 2. Divisions des anneaux Les anneaux sont divisés : la première division fut observée par Cassini qui détecta le pre-- mier une bande circulaire vide de blocs, et découpant ainsi « l'anneau » en deux anneaux distincts (cette division est encore appelée division Cassini). On en a détecté un très grand nombre depuis. On s'intéresse ici à la division observée sur le rayon orbital d'un petit satellite sphérique, Pan, de centre OP , de rayon RP , et de rayon orbital r,, = OSO}, . division Pan Le référentiel saturno-Pan 9îSP est en rotation uniforme autour du référentiel saturnien, sui- veur du mouvement de Pan, dans lequel OS et OP restent fixes. On considère deux petits rochers A et B encore présents dans cette bande et tournant dans le même sens (cf. figure 3). A est en orbite circulaire de rayon rA légèrement inférieur à r,... B est en orbite circulaire de rayon r,, légèrement supérieur à rl,. Q20. Montrer que plus le rayon de l'orbite circulaire d'un corps satellisé autour de Saturne est grand, plus sa vitesse le long de son orbite est faible. Q21. Tracer, sur la figure 3.a, dans le référentiel saturnien, l'allure des vecteurs vitesses des centres des trois corps {l'échelle est arbitraire). Q22. En déduire, dans le référentiel ÊRSP, l'allure des vecteurs vitesses de A et de B et les tracer sur la figure 3.b. Q23. En déduire pourquoi A et B ne pourront rester sur leur orbite, et pourquoi on dit que Pan « nettoie » la bande décrite par sa trajectoire en dessinant une division dans les anneaux. ÇONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Epreuve Spécifique de Physique-Chimie (filière PCSI - option PC) Page 13/16 3. Troisième partie : l'atmosphère de Titan Saturne possède un satellite remarquable, Titan, sur lequel la sonde Huygens, véhiculée par la capsule spatiale Cassini, s'est posée avec succès le 14 janvier 2005. Les capteurs embarqués ont permis d'enregistrer les variations de la pression et de la température en fonction de l'altitude. La figure suivante donne sur l'axe de gauche la pression de l'atmosphère en pascals, en échelle logarithmique, sur l'axe de droite l'altitude correspondante en km, en échelle non régulière, et sur l'axe horizontal la température en Kelvin en échelle linéaire. La courbe tracée permet donc de suivre l'évolution de la température en fonction de l'altitude ou de la pression. On admettra que dans l'atmosphère, l'accélération de la pesanteur de Titan garde une valeur constante gT = 1,6 m·s-2. On note R = 8,3 J·K-1·mol-1 la constante des gaz parfaits. On note P ( z ) la masse volumique du gaz et P( z ) sa pression à l'altitude z. Q24. On assimile la mésosphère et la thermosphère à un gaz parfait en évolution isotherme de masse molaire M. En écrivant l'équation d'état des gaz parfaits et la loi de la statique des fluides, établir l'équation différentielle vérifiée par P (z). Q25. Résoudre cette équation sans chercher à déterminer la constante d'intégration et en déduire si le modèle adopté est conforme avec les données de la figure. Q26. Dans la troposphère, on admet que le principal constituant est le diazote N2, de masse molaire M = 28 g·mol-1, assimilé à un gaz parfait de rapport des capacités calorifiques = 1,4, et que les évolutions sont adiabatiques et réversibles. On note P0 et µ0 les valeurs de la pression et de la masse volumique au niveau du sol. Etablir l'expression de la pression P en fonction P0, µ0, , gT et z. Déterminer une valeur approchée de l'altitude à laquelle P s'annule et en déduire si le modèle adopté est conforme avec les données de la figure. FIN DU SUJET DE PHYSIQUE CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC) Page 14/16 Code d'inscription : Figure 1 B' F'2 A' O2 O1 F2 F'1 Figure 2 (Les 19 pixels de la tache formée par Saturne ont été grisés) Figure 3 B B Pan Pan Figure 3.b Figure 3.a A A Référentiel saturnien Référentiel saturno-Pan CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve Spécifique de Physique-Chimie (filière PCSI - option PC) Page 16/16
