Mines Physique et Chimie PCSI 2002
| Thème de l'épreuve | Mise en orbite d'un satellite. Compteur électronique d'impulsions. Étude d'un climatiseur. Étude de dérivés organostanniques. |
| Principaux outils utilisés | point matériel dans un champ de force newtonien, A.O. en régime saturé, filtres, diagramme de Bode, changements d'etat, machines thermiques, diagramme entropique, cinétique, réactions radicalaires, chimie organique |
| Mots clefs | compteur d'impulsions |
Corrigé
:- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Énoncé obtenu par reconnaissance optique des caractères
CONCOURS COMMUN 2002
DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve de Physique et Chimie
(filière PCSI, option PC)
Mercredi 22 mai 2002 de 8h00 à 12h00
Instructions générales:
Les candidats doivent vérifier que le sujet comprend 15 pages numérotées
l/15,2/15,. . . 15/15.
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou mal
présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres
correspondante.
Les pages 7, 8 et 9 sont à rendre avec la copie.
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
Les parties de Physique et de Chimie seront rédigées sur les mêmes feuilles de
composition et rendues en
commun à la fin de l'épreuve.
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 1/15
PROBLEME DE PHYSIQUE
Le sujet de physique comporte 3 parties totalement indépendantes :
0 Mécanique : balade martienne.
. Electronique : compteur d'impulsions.
. Thermodynamique : étude d'un climatiseur.
De nombreuses questions sont indépendantes à l'intérieur de chacune de ces 3
parties.
Les 3 parties sont sensiblement équivalentes pour le barème.
L'usage de la calculatrice est autorisé.
Mécanique : balade martienne.
On se propose de faire l'étude très simplifiée de la mise en orbite d'un
satellite d'observation autour de la planète
Mars. Toute l'étude sera faite dans le référentiel lié au centre de masse O de
la planète (l'équivalent, pour Mars du
référentiel géocentrique) considéré comme galiléen ; l'action du Soleil ne sera
donc jamais prise en compte.
Le satellite sera assimilé à une masse ponctuelle P ; on notera r % OP.
Données numériques :
0 Masse de la planète Mars : M = 6,4.1023 kg.
. Constante de gravitation universelle : G = 6,7.10'11 USI.
. On prendra comme convention pour la force gravitationnelle : Ep(oo) = 0 quand
r--> oo.
1. Etude de l'orbite circulaire :
Le but de l'opération est de mettre le satellite de masse m sur une orbite
circulaire de rayon ro autour de Mars.
l-l- Exprimer la vitesse V0 (en fonction de M , G et fo) qu'aura le satellite
sur cette orbite en négligeant toute
autre action que la gravitation martienne. En déduire l'énergie cinétique
correspondante du satellite.
l--2-- Rappeler l'expression de l'énergie potentielle de gravitation (en
fonction de m, M , G et r). Exprimer
l'énergie cinétique EO du satellite sur l'orbite circulaire, en fonction de m,
M , G et rg. Exprimer son énergie
mécanique totale E... en fonction de E0.
l--3-- AN : , Calculer V0 pour ro = 3500 km (soit une altitude de 100 km
environ).
Calculer EO si m = 100 kg.
2. Approche de la planète :
Avant la mise sur orbite, la phase d'approche de la planète Mars se fait avec
la seule force gravitationnelle
martienne. Le vaisseau comporte alors le satellite de masse m et une réserve de
gaz de masse t.m (1: étant une
constante sans dimension).
On considère que le vaisseau arrive de l'infini (la Terre se trouve à plus de
78.106 km de Mars...) : la trajectoire
d'approche est quasi parabolique (c'est la plus économique du point de vue
énergétique).
2-l- Quelle est l'énergie mécanique totale Em du vaisseau sur cette trajectoire
(justifier la réponse sans calcul) '?
2-2-- La trajectoire strictement parabolique est--elle vraiment souhaitable
(quelle serait la vitesse du vaisseau
« loin » de la planète Mars) ?
On admettra néanmoins le caractère parabolique de la trajectoire pour la suite
du problème.
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 2/15
3. Mise en orbite du satellite :
Le sommet S de la parabole d'approche se trouve sur la trajectoire circulaire
sur laquelle on désire mettre le
satellite en orbite (OS = ro). On néglige toujours toute autre action
extérieure que la gravitation martienne.
3--1- Montrer qu'en arrivant en S, la vitesse du satellite vaut VS = «/5 .V0 .
Afin de passer de la trajectoire parabolique à la trajectoire circulaire en S,
le vaisseau doit actionner son
réacteur pour faire passer la vitesse de VS à VO. Le réacteur éjecte la masse
de gaz r.m (m étant la masse du satellite
après la mise sur orbite circulaire) à la vitesse u = 3000 m.s'1 (relativement
au satellite) . *
L'éjection peut être considérée comme instantanée au point S.
3--2-- Pourquoi peut--on dire que le système « satellite + gaz » est isolé
pendant cette opération ?
Quelle loi de conservation peut--on en tirer '?
3--3-- Dans quelle direction et dans quel sens l'éjection doit-elle être faite
pour que la mise en orbite soit réussie
(l'orbite circulaire restant dans le plan de la parabole) ?
3--4-- Exprimer r en fonction de on = u/VO. Faire l'application numérique.
Discuter le résultat.
3--5-- Exprimer le travail W fourni par le réacteur lors de sa poussée en
fonction de a = u/VO et E0. Calculer W.
Orbite circulaire ---------->î_ O
Electronique : Compteur d'impulsions
On se propose de concevoir un compteur d'impulsions analogique.
L'amplificateur opérationnel utilisé est idéal ; il est alimenté par une
alimentation symétrique (--E, O, +E) qui limite
la tension de sortie: -- E S Vs S +E . (E = 6,0 V)
On réalise le montage suivant, dans lequel V0 = 1,0 V.
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 3 /15
Figure 1
Æ:
1- L'amplificateur opérationnel fonctionne-t-il en régime linéaire ? Pourquoi ?
2-- Montrer que lorsque le régime permanent V(, = cte = 0 V est établi depuis
longtemps, la tension de sortie vaut
Vs= "E.
3- Rappeler la pr0priété de continuité (d'une grandeur électrique qu'on
précisera) relative à un condensateur.
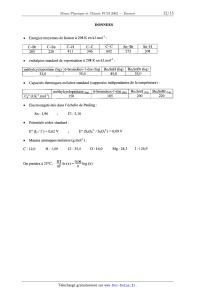
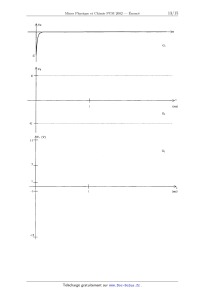
A t = 0, on envoie une impulsion à l'entrée du montage (voir graphe G1 joint) :
pendant une très courte durée,
Ve prend la valeur ----U (U > Vo), puis revient à 0. Montrer que l'impulsion
fait basculer la sortie à +E (on
admettra que toute bascule est instantanée) . Que vaut V+ (potentiel de
l'entrée non inverseuse) juste après ce
basculement '? Le retour de V, à 0 engendre-t-il un nouveau basculement de la
sortie ?
4-- En l'absence de nouveau signal d'entrée (V, = O), le système revient à
l'état décrit au 1-- : à quelle date to la
sortie bascule--t--elle à ----E ? Calculer la capacité C du condensateur pour
que to =l,O ms (R = 1,0 kQ). Décrire
l'évolution de V+ (avant et après to) ; compléter les graphes 62 et G,.
Justifier le nom de « Monostable » pour
un tel montage.
5 - On envoie maintenant périodiquement des impulsions (la période T des
impulsions est assez grande pour qu'on
puisse considérer que le système est revenu en régime permanent avant l'arrivée
d'une nouvelle impulsion).
Compléter le graphe GS. Exprimer le tension de sortie moyenne (V...) en
fonction de E, to et f (fréquence des
impulsions).
6-- Pour mesurer V..., on filtre la tension VS par un circuit R,C1 :
V1 C; V2 Figure 2
23
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSl option PC) page 4 /15
Calculer la fonction de transfert _H(joe)=Yj_V_1 en régime harmonique de
pulsation ce, en fonction de R, C; et 0).
Etudier et tracer l'allure du graphe GdB(oe) où GdB représente le gain en
décibels de ce filtre (on utilisera
l'échelle logarithmique pour les impulsions). Comment appelle--t--on un tel
filtre ?
7- On branche maintenant le filtre du 5- à la sortie du monostable : VS = V1
(voir figure 3). Comment doit--on
choisir R1 et C; pour que V2 % cte : Vm lorsqu'on envoie les impulsions
décrites au 4-- '? Dans ce cas, on
branche un voltmètre (de résistance considérée comme infinie) entre le point S
et la borne ------E de l'alimentation
symétrique. Montrer que la tension lue (VL) est proportionnelle à la fréquence
f des impulsions.
--------- .................
l...
Monostable
Ë--l
n
u
Figure 3
8- AN : Le compteur ainsi obtenu sert de compte--tours à un moteur
d'automobile. Un moteur à 4 cylindres doit
recevoir 2 impulsions par tour pour alimenter les bougies. Quel sera le domaine
des tensions VL mesurées,
sachant que le moteur tourne à des régimes pouvant aller de 100 à 8000 tr/min ?
Comment doit-on choisir C1 si
R1=1,0MQ?
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 5 / 15
Thermodynamique : étude d'un climatiseur
On s'intéresse au fonctionnement d'un appareil de climatisation, dont le but
est de maintenir une
température constante (To = 20°C) dans un local été comme hiver. Le climatiseur
fonctionne donc en
pompe à chaleur l'hiver, en machine frigorifique l'été. Les transferts
thermiques du climatiseur se font
avec 2 sources :
. L'intérieur de la pièce (à TO).
. L'atmosphère extérieure (on prendra T] = 0°C en hiver; T2 = 40°C en été afin
de prévoir des conditions
« extrêmes »). . ,
Le fluide caloporteur qui effectue des cycles dans l'appareil est l'ammoniac.
Ses caractéristiques
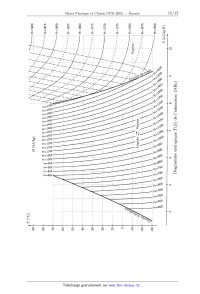
thermodynamiques sont résumées dans le diagramme entropique T(S) où sont
représentées : '
o les isenthalpiques (H est donné en kJ/kg) ;
0 les isobares (représentées par " """"""""""""" dans le domaine « vapeur
sèche»).
On donne, par ailleurs, les pressions de vapeur saturante Ps(T) aux trois
températures d'étude :
P,(0°C) = 4,3 bars P,(20°C) = 8,2 bars P,(40°C) = 15 bars
On se limitera à l'étude du climatiseur en régime permanent. Par un jeu de
vannes adéquat, le fluide peut circuler
dans un sens pour chauffer la pièce (A, B, C, D, A) ; dans l'autre sens pour la
rafraîchir (B, A, D, C, B).
...--___A._B__----p
Rafraîchissement Chauffage
------------------------------------------------------------- compresseur
; EUR? : a
:-- %"
5° Ez El E'...
E :=»
détendeur O
.............................................................. D C
Le circuit comporte 2 parties isobares :
. L'une à la pression de vapeur saturante de l'ammoniac à 20°C (côté local) ;
. L'autre à la pression de vapeur saturante de l'ammoniac à T... (côté
atmosphère extérieure).
Par ailleurs, on rappelle qu'à la traversée d'une partie active
(compresseur, détendeur ou échangeur) l'énergie reçue par le fluide
circulant en régime permanent vérifie :
Ah=h,--h,=w+q
si hEUR et hs sont les enthalpies massiques du fluide à l'entrée et à la
sortie ; w et q étant le travail et la chaleur utiles reçus (c'est-à-dire
échangés avec l'extérieur du circuit, excluant le travail des forces de
pression) par kilogramme de fluide traversant la partie active. {
Le fluide subit des échanges de chaleur isobares (sans recevoir de travail
utile) dans les échangeurs E1 et E2 avec les
2 sources de chaleur (local et atmosphère extérieure). Un système de
ventilation permet d'améliorer les échanges
thermiques : la température du fluide est celle de la source d'échange à la
sortie de chacun d'entre eux.
Le compresseur comprime de manière adiabatique le fluide à l'état gazeux de la
plus faible à la plus forte pression.
L'unité de masse de fluide traité y reçoit le travail utile w.
Le fluide subit une détente adiabatique, sans échange de travail utile, dans le
détendeur (la détente est donc
isenthalpique).
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) - page 6/15
1. Généralités :
l-l-- Comment réalise-t-on un détendeur (détente isenthalpique d'un fluide)?
Quel autre nom porte une telle
détente ?
1--2- Le premier principe de thermodynamique est bien vérifié dans une partie
active ; c'est pourtant Ah (et non
Au) qui est égal à (w + q)... Expliquer qualitativement (sans entrer dans le
détail d'une démonstration)
cette différence.
1--3- En supposant que l'ammoniac, à l'état gazeux dans le compresseur, est
assimilable à un gaz parfait de
coefficient adiabatique y constant, exprimer le rapport T,/T, (des températures
absolues de sortie et d'entrée
dans le compresseur) en fonction de y et P,/Pe (rapport des pressions de sortie
et d'entrée du compresseur).
1-4- Par lecture du graphe, déduire les enthalpies massiques de vaporisation de
l'ammoniac à 0°C, 20°C et
40°C.
2. Fonctionnement hivernal du climatiseur (chauffage) :
Dans ce cas :
. l'échangeur E est un condenseur : l'ammoniac y entre en B sous forme de
vapeur sèche ; il en ressort sous
forme de liquide saturant en C, à la température To du local ;
. l'échangeur E2 est un évaporateur: le mélange liquide vapeur qui entre en D
se vaporise totalement pour
ressortir sous forme de vapeur saturante en A à la température de l'atmosphère
extérieure T1 = O°C.
2-1- Tracer le cycle (en l'orientant) de l'ammonÿiac sur le diagramme
entropique. Trouver graphiquement sa
température TB à la sortie du compresseur.
2--2- Déterminer (graphiquement), pour 1kg d'ammoniac traité (on rappelle que
E1, E2 et le compresseur sont
des parties actives) :
o Le travail w fourni par le compresseur au fluide ;
o La chaleur qc reçue par le fluide (de la part du local) lors du passage dans
l'échangeur El ;
o La chaleur qf reçue par le fluide (de la part de l'extérieur) lors de son
passage dans EZ.
Faire un bilan énergétique du cycle.
2--3-- Définir et calculer le coefficient de performance 11 du climatiseur.
Quel intérêt présente une telle
installation par rapport à un chauffage par chaudière '? Quel serait le
coefficient si le fluide effectuait des
cycles de Carnot en effectuant les échanges thermiques avec les mêmes sources
de chaleur '? En quoi le
cycle effectué diffère--t--il d'un cycle de Carnot '?
2--4-- Quelle est la fraction massique de vapeur XD à la sortie du détendeur '?
2--5- En utilisant le résultat de la question 1--3-, évaluer l'indice
adiabatique 7 du gaz ammoniac.
3. Fonctionnement estival du climatiseur (rafraîchissement) :
Les rôles des 2 échangeurs sont inversés : E est un évaporateur ; E; un
condenseur.
3-1-- Tracer le cycle (orienté) de l'ammoniac sur le diagramme entropique (on
affectera les points de l'indice ').
En déduire sa température T' A à la sortie du compresseur.
3--2- Déterminer (graphiquement), pour 1 kg d'ammoniac traité (même remarque
qu'en 2--2-) :
o Le travail w' fourni par le compresseur ;
o La chaleur q'1 reçue (de la part de la pièce) lors du passage dans
l'échangeur E; ;
o La chaleur q' 2 reçue (de la part de l'extérieur) lors du passage dans E2.
3-3- Définir et calculer le nouveau coefficient de performance 11 ' du
climatiseur.
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 10/15
PROBLEME DE CHIMIE
Etude de quelques dérivés organostanniques
L'hydrure de tributylétain (Bu3SnH) est un composé très utilisé pour effectuer
des réactions de cyclisation
conduisant en une seule étape à des composés relativement élaborés possédant
une stéréochimie bien
déterminée, comme dans le cas de la synthèse de l'hirsutène :
I
Hirsutène
Problème | . Etude de la cyclisation du 6-bromohex-1-ène
-- A . Etude cinétique
Le 6--bromohex-l-ène (que l'on notera RBr) peut réagir en présence de Bu3SnH et
d'un amorceur
radicalaire tel que l'azobisisobutyronitrile (AIBN) selon le schéma suivant :
AIBN --k1---> 2 (CH3)2C'--CN (l)
(CHÿ;C'--CN + BmSnH L> Bugsn°+ (CHg);CH-CN (2)
BU3SIÏ + RBI' -----l{--ê----> CH2=CH--CH2--CHz--CHz--CH2. + BU3SHBI' (3)
(Hex)
CH2=CH-CHz-CHz-CHÏCHZ. + 13113an --Ëi---> CH2=CH--CHz-CHz-CHz-CH3 + BU3SI'f (4)
(Hex)
CHfCH-CHz-CHz--CHZ--CHZ _, (5)
(MCP)
. k6 .
+ B113SHH ""'--"_" + Bu3Sn (6)
(MCP)
. k7
2Bu3Sn ----> BUÔSÏIZ (7)
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 11 / 15
1) Combien l'hirsutène possède--t-il de stéréoisomères de configuration ?
Est--il optiquement actif ?
2) Le mécanisme de cyclisation du 6-bromohex-l-ène correspond--il à un
mécanisme en chaîne ou bien à
un mécanisme par stades ? Justifier.
3) Définir puis exprimer la vitesse de formation du méthylcyclopentane (que
l'on notera MCP). Mêmes
questions pour l'hex-- 1 -ène (que l'on notera Hex). Justifier l'expression
donnée.
4) A quelle condition peut-on appliquer l'approximation des états quasi
stationnaires (AEQS) à un
composé ? Déterminer les équations obtenues en appliquant l'AEQS aux
intermédiaires réactionnels
MCP' et Hex'.
5) a) En déduire l'expression de [MCP'] en fonction des concentrations [Hex'],
et [BmSnH].
b) En supposant que la concentration en Bu38nH reste constante au cours de la
réaction et que la
solution initiale ne contient aucun des produits de la réaction, établir une
relation entre [MCP],
[Hex] et [Bu38nH].
c) Comment, en pratique, réaliser la condition : « concentration en Bu3SnH
constante » ?
6) On a mesuré à 60°C les valeurs des constantes de vitesse k; et k5: k4 =
4,43.106 mol'l.L.s'1 et
k5 = 8,34.105 s".
Comment expliquer la différence entre les unités de ces deux constantes de
vitesse ?
Déterminer la valeur limite de la concentration en Bu3SnH, supposée constante,
qui doit exister dans
la solution pour obtenir plus de 95 % de produit cyclique et moins de 5 %
d'hex--l-ène à 60°C en fin
de réaction.
7) On s'intéresse maintenant à la cyclisation du l-allyloxy--2-bromobenzène,
représenté ci--dessous, en
présence de Bu3SnH et d'AIBN :
. . 0
a) Par analogie avec ce qui a été dit précédemment, représenter les. deux
produits attendus lors de
cette réaction.
b) Les mesures des constantes de vitesse donnent à 60°C : k; = 3,9.106
mol'l.L.s'l- et
k5 = 5,5.107 s']. Déterminer la valeur limite de la concentration en Bu3SnH,
supposée
constante, qui doit exister dans la solution pour obtenir plus de 95 % de
produit cyclique à
60°C en fin de réaction que l'on supposera quantitative. Conclusion '?
B . Etude thermodynamique
On considère la réaction:
...BI' + BU3SI'IH -------------------> ' + BU3SHBI'
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) ' page 12 / 15
1)
2)
3)
4)
Faire un bilan des liaisons formées et rompues au cours de cette
transformation. On considérera que la
double liaison est formée de deux liaisons C--C de même énergie : E = EÊ_C .
Représenter un cycle thermodynamique permettant de calculer l'enthalpie
standard de la réaction à
25°C. Exprimer puis calculer cette grandeur.
En déduire l'enthalpie standard de la réaction à 60°C, température à laquelle
tous les composés sont
encore liquides.
La réaction est-elle endothermique ou exotherrnique dans le sens de la
formation du
méthy1cyclopentane '? Etablir l'expression puis calculer la quantité de chaleur
échangée avec le milieu
extérieur lors de la transformation, supposée totale, de deux moles de
6-bromohex--l-ène, à 60°C, sous
P = 1 bar.
Problème Il : Synthèse de dérivés organostanniques vinyliques
On se propose dans cette partie, de synthétiser deux dérivés organostanniques
possédant une double
liaison, dans le but d'être polymérisé ensuite. '
A.
Première synthèse :
Le composé de départ de cette synthèse est le 4-chlorométhylstyrène : A
1)
2)
\ Cl
On appelle B l'organomagnésien issu du composé A. Ecrire l'équation-bilan de la
réaction ainsi que
la formule semi--développée du composé B et donner les conditions opératoires à
vérifier pour pouvoir
réaliser cette transformation avec un bon rendement.
Pour déterminer le rendement de cette transformation dans le cas où l'on part
de 15,2 g de composé A
(réactif en défaut) pour un volume total de la solution de 500 mL (supposé
constant tout au long de la
réaction), on prélève rapidement, en fin de réaction, 5,00 mL de la solution
contenant le composé B et
on rajoute à ces 5,00 mL, 25,0 mL d'une solution de diiode à 5,00.10'2 mol.L°1
dans le toluène
(méthy1benzène). Il faut alors 10,0 mL de s2032' à 1,00.10'1 mol.L" pour doser
le diiode restant dans
ce mélange.
a) Ecrire toutes les équations-bilan mises en jeu et préciser à quel type de
réaction appartient
chacune d'elles.
b) Pourquoi faut-il prélever la solution rapidement? Quelle verrerie
utiliseriez-vous pour
prélever les différents volumes ? Justifier.
c) Donner l'expression de la constante d'équilibre de la réaction de dosage,
notée K°, et calculer
sa valeur à 25°C. Conclusion '?
(1) Quel est le rendement de la synthèse ? (on supposera toutes les réactions
quantitatives).
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) ' page 13 /15
3) On rajoute lentement la solution précédente contenant le composé B sur du
1,2-dichloroéthane, ce qui
conduit ainsi au composé C, de formule brute C...H13Cl, dont on précisera la
structure. De quel type
de réaction s'agit-il ? Représenter le mécanisme le plus probable. Faire un
schéma annoté d'un
montage permettant l'ajout goutte à goutte du l,2-dichloroéthane sur la
solution contenant B.
4) La solution obtenue contenant le composé C est ensuite versée goutte à
goutte sur des copeaux de
' magnésium de façon à obtenir le composé D. Enfin, l'addition de chlorure de
tributylétain (Bu3SnCl)
sur le composé D fournit le composé E selon une réaction analogue à celle
décrite en 3). Indiquer la
polarité de la liaison Sn-Cl et en déduire la formule semi-développée du
composé E.
5) Pourquoi le composé E est--il polymérisable '? Ecrire la formule générale du
polymère obtenu.
B . Deuxième synthèse
On peut également obtenir un dérivé organostannique polymérisable, H, par
condensation entre le
composé A et l'alcool F en présence d'une base forte telle que NaH (pKa du
couple H2 / H" de l'ordre de
35) dans le diméthy1formamide (DMP) comme solvant, selon le bilan :
\
NaH
O + Ho/\/\Snph3 H + HC]
A F
Cl
où Ph représente le groupement phényle (C6H5).
1) Cette condensation peut se décomposer en deux étapes (non équilibrées) : F +
NaH ----> G puis
G + A ---> H. Donner la structure des composés G et H. De quels types de
réactions s'agit--il ?
2) Pourquoi ne pas utiliser (une base d'usage courant telle que la soude ou la
potasse ? On précise que le
pKa du couple ROH/RO' vaut environ 18 pour l'alcool F.
3) La transformation G --> H serait--elle plus rapide en remplaçant le DMP
(moment dipolaire : r...... =
3,81 D ; constante diélectrique 8r = 38,2) par de l'éther (umo = 1,26 D ; ar =
4,3) '? Justifier la réponse
en vous appuyant sur un diagramme représentant l'énergie potentielle du système
en fonction de la
coordonnée de réaction. (On précise que cette réaction est d'ordre 2).
4) Le composé F a été obtenu par une réaction d'addition de l'hydrure de
triphénylétain (Ph3SnH) sur
l'alcool allylique :
ROOR, hv
HO
\/\ + Ph3SnH "__--"'" - HO/V\SnPh3
Sachant que cette addition est une réaction radicalaire analogue à celle de
l'addition radicalaire des
halogénures d'hydrogène sur un alcène, proposer un mécanisme réactionnel
permettant de justifier la
régiosélectivité observée.
CONCOURS COMMUN 2002 DE"SECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI Option PC) , -- page 14
/ 15
DONNEES
. Energies moyennes de liaison à 298 K en kJ.mol'1 :
C--H
. enthalpies standard de vaporisation à 298 K en kJ.mol" :
méthylcyclopentane (liq) 6--bromohex-l-ène (liq) Bu3SnH (liq)
. Capacités thermiques molaires standard (supposées indépendantes de la
température) :
_ méthylcyclopentane ]i.6'bf0ffl0hEURX'1'èflEUR 1i.Bugan ".
C°(lK' mol")
. Electronégativités dans l'échelle de Pauling :
Bu3SnBr (liq)
Sn : 1,96 ; Cl : 3,16
. Potentiels rédox standard :
E' (12 /1") = 0,62 v ; E° (s4062' /'52032') = 0,09 v
. Masses atomiques molaires (g.mol'l) :
C: 12,0 H: 1,00 Cl : 35,5 0 : 16,0 Mg : 24,3 1 : 126,9
On prendra à 25°C, --Î--Ë- ln (x) = --0----'£-Ê log (X)
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 15 / 15
/ \ Ve
\i-
,.
GI
-U
/\ Vs
E
1 \ t
I /
1 (ms)
G2
-E
/\V+ (V)
_I 1 ""
G3
5 -------
1 _--
l \
I /t
-1---- 1 (ms)
4%...
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 7/15
Ve
"U
E,
...............................................................................................................................................................................................................................................................................................................................
-E
...............................................................................................................................................................................................................................................................................................................................
CONCOURS COMMUN 2002 DES ECOLES DES MINES D'ALBI, ALES, DOUAI, NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC) page 8/15
(m5)
(m5)
8 10
6
Diagramme entropique T(S ) de l'ammoniac (NH3)
CONCOURS COMMUN 2002 DES ECOLES DES MINES D' ALBI, ALES, .,DOUAI NANTES
Epreuve spécifique de Physique et Chimie (filière PCSI option PC)
page 9/15
