Centrale Physique et Chimie PSI 2012
| Thème de l'épreuve | Traitement de surfaces |
| Principaux outils utilisés | ondes électromagnétiques, diffusion thermique, diagramme d'Ellingham, diagramme E-pH, courbes intensité-potentiel, oxydoréduction, cristallographie, cinétique, thermochimie |
| Mots clefs | conductivité, modèle de Drüde, absorption, réflexion, transmission, métal, diffusivité thermique, trempe, laser, corrosion, passivation, rutile |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)






Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
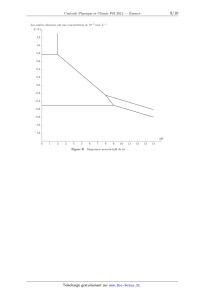
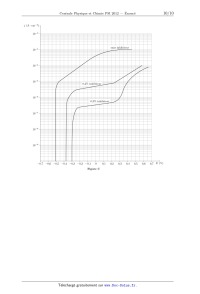
PSI 4 heures Calculatrices autorisées 2012 PhysiqueChimie Ce sujet est accompagné d'un document réponse à remettre avec la copie. Ce sujet aborde diverses méthodes, physiques et chimiques, de traitement de surface. Il est composé de deux problèmes indépendants. La partie I s'intéresse au traitement de surface par faisceau laser. Les parties II, III et IV présentent quelques propriétés de revêtements chimiques de surface. Les données sont regroupées en fin d'énoncé. Les résultats numériques seront donnés avec un nombre de chiffres significatifs compatible avec celui utilisé pour les données. I Traitement de surfaces par faisceau laser Le traitement de surfaces par faisceau laser s'est considérablement développé ces dernières décennies et les applications de cette technique sont nombreuses et variées. On peut citer par exemple le traitement de surface des métaux, le décapage de peintures, de pierres, les applications liées au domaine médical (ophtalmologie, dermatologie). . . Le sujet propose d'abord une modélisation simplifiée des phénomènes physiques mis en jeu, puis une illustration par l'exemple de la trempe en surface d'un acier. I.A Interaction laser-matière On considère un milieu métallique conducteur linéaire isotrope homogène, non magnétique. La conduction est assurée par des électrons, de masse m et de charge -e. On note n la densité particulaire des électrons. I.A.1) Conductivité complexe du milieu métallique a) Modèle de Drüde þ B) þ issu du laser ainsi qu'à Les électrons mobiles, de vitesse þv sont soumis au champ électromagnétique (E, une force d'amortissement visqueux fþv = -(m/c )þv traduisant l'interaction des électrons avec le milieu. c correspond à la durée moyenne entre deux collisions de porteurs de charge. Appliquer la relation fondamentale de la dynamique à un électron dont on négligera le poids. b) Simplifier, en le justifiant, cette relation dans le cas d'électrons non relativistes. On fera l'hypothèse que la norme maximale du champ magnétique dans le métal est peu différente de celle dans le vide. þ s'écrit = 0 /(1 + ic ) où c) En déduire que la conductivité complexe du conducteur vérifiant þ = E représente la pulsation du champ électromagnétique et où þ est le vecteur complexe densité volumique de courant. Exprimer 0 en fonction de n, e, m et c . d) Dans le cas du laser CO2 utilisé, montrer que l'on ne peut pas assimiler la conductivité complexe du conducteur à sa conductivité statique 0 . Écrire sous la forme = - i et exprimer et en fonction de 0 , et c . I.A.2) Neutralité du conducteur a) Déterminer l'équation différentielle complexe vérifiée par la densité volumique de charge . b) Intégrer l'équation en prenant comme condition initiale = 0 à t = 0 et montrer que la solution réelle se met sous la forme = 0 e-t/d cos(d t). Exprimer d et d en fonction de 0 , c , et 0 . c) Calculer d et en déduire que l'on peut considérer le conducteur comme neutre électriquement dans le cas du laser CO2 utilisé. I.A.3) Relation de dispersion a) Donner les équations de Maxwell en tenant compte de l'approximation précédente. b) Montrer, à l'aide d'un calcul numérique, qu'un terme peut être négligé dans l'équation de Maxwell-Ampère. þ c) Déterminer l'équation de propagation satisfaite par le champ électrique E. þ sous la forme E þ = E þ ei(t-kz) = E0 ei(t-kz+0 ) þux où k est a priori complexe d) On recherche le champ E 0 et où þux est un vecteur unitaire dans une base cartésienne. Établir la relation de dispersion en fonction de notamment. e) On note k = k - ik . Donner, en fonction de k et k , l'expression du champ électrique réel. f) Quelle inégalité doit vérifier le produit k k pour que le milieu soit absorbant ? Montrer, en s'aidant de la relation de dispersion, que cette condition est satisfaite. 3 avril 2012 11:31 Page 1/7 La résolution des équations de Maxwell donne le champ électromagnétique suivant : þ = E0 e-k z cos(t - k z + 0 )þux E þ = E0 e-k z (k cos(t - k z + 0 ) + k sin(t - k z + 0 )) þuy B On note par la suite n = n - in l'indice complexe du milieu vérifiant k = k0 n = (/c)n, avec n l'indice de réfraction du milieu et n l'indice d'extinction. I.A.4) Coefficient d'absorption en intensité dans le milieu þ t où é·êt désigne l'opérateur valeur moyenne temporelle et þ le a) Déterminer l'expression de l'intensité éëëê vecteur de Poynting. On notera I0 l'intensité en z = 0. b) En déduire que l'on peut faire intervenir une longueur caractéristique d'absorption en intensité La dont on donnera l'expression en fonction de , c et n . c) En faisant un bilan de puissance sur une tranche de conducteur comprise entre z et z +dz, établir en fonction de La , I0 et z, l'expression Pv (z) de la puissance volumique absorbée par le conducteur. I.A.5) Réflexion et transmission de l'onde incidente normale sur le métal þ E x milieu 1 milieu 2 þk z y z=0 Figure 1 On étudie le comportement de l'onde électromagnétique émise par le laser à l'interface air / milieu représenté figure 1. On note 1 le milieu « air » dont l'indice optique est assimilé à celui du vide : n1 = 1. Le milieu conducteur, noté 2, a pour indice complexe n2 = n2 - in2 . On se limite au cas d'une onde incidente plane þ = progressive monochromatique se propageant normalement à la surface de discontinuité de milieu z = 0 : E i E0 ei(t-k0 z) þux . a) Rappeler les lois de Descartes pour la réflexion et la transmission en précisant sur un schéma les notations utilisées. On tracera les rayons dans le cas d'un milieu 2 plus réfringent que le milieu 1. b) En déduire, dans le cas d'une incidence normale, une conséquence simple sur les directions de polarisation des ondes réfléchies et transmises. On montre alors que le coefficient de réflexion en intensité þ r (z = 0, t)ëêt éë R= þ i (z = 0, t)ëêt éë þ i (z, t) et þ r (z, t) sont respectivement les vecteurs de Poynting des ondes incidente et réfléchie vaut où R= (1 - n2 )2 + n2 2 (1 + n2 )2 + n2 2 c) En déduire l'expression Pv (z) de la puissance volumique absorbée par le conducteur, en fonction de La , R, z et I0 intensité du laser. d) La figure 2 donne, pour l'acier, les variations de n2 et n2 en fonction de la longueur d'onde du champ électromagnétique. En déduire la valeur de R pour le laser à CO2 . Commenter la valeur obtenue. I.B Étude thermique On note µ la masse volumique du milieu, c sa capacité thermique massique à pression constante et K sa conductivité thermique. Ces grandeurs seront, en première approximation, supposées constantes. On se place dans le cadre d'un phénomène unidimensionnel, la température dans le milieu T (z, t) n'étant fonction que de z et t. Lors d'une phase de chauffage, les échanges thermiques par convection, diffusion et rayonnement en z = 0 étant négligeables devant la puissance délivrée par le laser, ils ne sont pas pris en compte par la suite. De même, on néglige le transfert thermique prélevé par le matériau pour tout changement de phase solide (passage d'une variété allotropique à une autre). On considère la section S du matériau éclairée par le laser lorsque celui-ci est en fonctionnement. I.B.1) Établir l'équation aux dérivées partielles, notée (1), satisfaite par T (z, t) pour z > 0 lorsque le laser n'est pas en fonctionnement. On introduira la diffusivité thermique D = K/(µc) du matériau et on donnera son unité. 3 avril 2012 11:31 Page 2/7 4,3 n2 15,0 n2 4,2 14,5 4,1 14,0 4,0 13,5 3,9 13,0 3,8 0 5 10 15 20 25 30 35 40 12,5 0 5 10 (µm) 15 20 25 30 35 40 (µm) Figure 2 I.B.2) Le laser émet maintenant une impulsion d'intensité I0 et de durée . Établir, en fonction notamment de Pv (z) (défini à la question I.A.5c), la nouvelle équation aux dérivées partielles, notée (2), satisfaite par T (z, t) pour t 6 et z > 0. I.B.3) À l'aide d'une analyse dimensionnelle, définir la longueur de diffusion thermique LD , fonction de D et de . Les deux longueurs caractéristiques LD et La permettent de définir deux régimes de chauffage : - le chauffage surfacique pour lequel La LD , l'absorption se fait alors sur de faibles profondeurs et le profil de température dépend essentiellement des propriétés thermiques du milieu ; - le chauffage volumique pour lequel La LD et où le profil de température dépend essentiellement des propriétés optiques du milieu. I.B.4) Traduire par deux relations les conditions aux limites satisfaites par T (z, t) en z = 0 et en z = +, sachant qu'à l'instant t = 0, le milieu est à l'équilibre thermique, à la température T0 . Avec les conditions initiale et limites précédentes, la résolution de l'équation (2) donne les solutions analytiques approchées suivantes : 2I Dt - T (z = 0, t) = T0 + 0 pour la température de surface du matériau dans le cas d'un chauffage surfacique ; K I t - T (z, t) = T0 + 0 e-z dans le cas d'un chauffage volumique. La µc I.B.5) On considère l'acier dont les caractéristiques physiques sont données en fin d'énoncé. Pour = 10,6 µm, la longueur caractéristique d'absorption de l'acier vaut La = 1,8 × 10-12 m. a) On relève, à l'aide d'un pyromètre infrarouge la température de surface de l'acier au niveau de la surface éclairée par le laser. On note au cours du temps les valeurs suivantes : t (s) 0 10-5 T ( C) 20 73,2 5 × 10-5 138,9 2 × 10-4 257,9 6 × 10-4 432,1 10-3 552,0 3 × 10-3 941,3 5 × 10-3 8,2 × 10-3 1209,4 1543,2 En expliquant votre démarche, déterminer la nature, surfacique ou volumique, du chauffage. b) À l'aide d'une régression linéaire, évaluer numériquement I0 . En déduire R. Comparer à la valeur trouvée à la question I.A.5d. c) On souhaite réaliser une trempe superficielle de l'acier afin d'obtenir une dureté très élevée en surface. Pour cela, on chauffe l'acier de façon à passer de la variété allotropique de l'acier à la variété allotropique (acier martensitique) sans toutefois dépasser la température de fusion Tf de l'acier. Calculer les valeurs numériques minimale min et maximale max du temps de chauffe permettant de respecter cette double contrainte. d) Conclure quant à la validité de l'hypothèse d'un chauffage surfacique ou d'un chauffage volumique. e) La figure 3 donne le profil de température dans l'acier après un temps de chauffe de 8,2 ms. Déterminer, dans le cas où la surface est en limite de fusion, la profondeur sur laquelle s'effectue réellement la trempe de l'acier. 3 avril 2012 11:31 Page 3/7 1600 1400 1200 T ( C) 1000 800 600 400 0 50 100 150 200 250 300 350 400 450 500 z (µm) Figure 3 f) Un dispositif, non étudié, permet d'obtenir une section S du faisceau laser carrée en z = 0, de côtés selon þux et þuy . Le laser est fixe et émet en continu. La pièce à traiter est translatée selon þux à vitesse constante. Déterminer la vitesse de translation v1 de l'acier pour obtenir une profondeur de trempe maximale. Conclusion ? II Inhibiteurs de corrosion On appelle inhibiteur de corrosion un composé chimique qui, ajouté à faible concentration au milieu corrosif, permet de ralentir voire de stopper la corrosion d'un métal placé au contact de ce milieu. On s'intéressera en particulier dans cette partie aux inhibiteurs de corrosion du fer que sont le minium de plomb, les amines et les carboxylates. II.A Le minium de plomb Pb 3O 4 Le minium de plomb a longtemps été utilisé dans les sous-couches primaires des peintures anti-corrosion appliquées sur le fer pour le protéger. C'est le minium de plomb qui confère à ces sous-couches leur couleur orange. II.A.1) Sur le diagramme d'Ellingham fourni figure A du document réponse, attribuer les domaines d'existence à chacune des espèces prises en compte dans le tracé du diagramme : Fe, Fe3 O4 , FeO. On justifiera la réponse en s'appuyant sur les nombres d'oxydation des espèces concernés. II.A.2) Déterminer l'équation de la droite d'Ellingham du couple Pb3 O4(s) /PbO(s) . On notera r G04 l'enthalpie libre standard de réaction de ce couple. Ajouter cette droite sur le diagramme de la figure A du document réponse. II.A.3) Le minium de plomb réagit avec le fer pour donner comme produits PbO et FeO. Justifier que cette réaction peut avoir lieu. Comment nomme-t-on le type de protection réalisée ? FeO(s) n'étant pas une espèce stable du fer sur le plan thermodynamique aux températures extérieures rencontrées, comment peut-on la qualifier ? II.B Autres inhibiteurs Pour des raisons de toxicité, on essaie de remplacer le minium de plomb par d'autres inhibiteurs. Il existe de nombreux composés organiques inhibiteurs de la corrosion. On peut distinguer les inhibiteurs anodiques, cathodiques ou mixtes. L'inhibiteur de corrosion forme une couche barrière à la surface du métal permettant le blocage des sites anodiques, ou cathodiques, ou les deux dans le cas de l'inhibiteur mixte. II.B.1) Sur le diagramme potentiel-pH fourni figure B du document réponse, indiquer les domaines de stabilité des espèces suivantes du fer : Fe(s) , Fe2 O3(s) , Fe3 O4(s) , Fe2+ et Fe3+ . Indiquer également où se situent les domaines d'immunité, de corrosion et de passivation. II.B.2) Tracer sur le diagramme potentiel-pH fourni figure B du document réponse, la droite H+ /H2 . En milieu acide désaéré, écrire l'équation d'oxydation du fer. II.B.3) Qu'appelle-t-on « site anodique » ? Justifier de façon détaillée à l'aide d'un schéma sur l'exemple du fer (toujours en milieu acide désaéré). II.B.4) Dans le cas où on utilise un inhibiteur anodique, expliquer pourquoi l'altération locale du film peut entraîner une corrosion en profondeur. 3 avril 2012 11:31 Page 4/7 II.C Amines et carboxylates Les molécules les plus couramment utilisées dans le cas de la protection de l'acier par inhibiteur sont les amines ou les carboxylates RCOO- (sels d'acides carboxyliques). II.C.1) Les amines, de formule R NH2 , participent au couple acide-base RNH+ 3 /RNH2 . Présente dans l'inhibiteur, on dit que la fonction amine a une action neutralisante. Justifier le rôle protecteur de la fonction amine. II.C.2) Une étude expérimentale est effectuée sur des échantillons d'acier trempés dans une solution contenant un inhibiteur qui possède à la fois les fonctions amine et carboxylate. L'idée est la suivante : l'échantillon se couvre d'un film d'inhibiteur et on cherche à évaluer la protection ainsi obtenue. On met en oeuvre un montage à trois électrodes : une électrode de travail (qui est recouverte d'une couche d'acier dont on étudie la corrosion), une électrode de référence et une contre-électrode. On trace (cf figure C du document réponse) les courbes intensité-potentiel relatives à l'électrode de travail pour différentes concentrations d'inhibiteur (le potentiel en abscisse étant fourni par rapport à l'électrode au calomel saturée ou ECS, qui sert de référence). L'échelle verticale est logarithmique. a) Quels sont les deux effets dus à la présence d'inhibiteur ? En quoi ces deux effets permettent-ils d'expliquer l'action inhibitrice de la solution ? b) Pour 0,3% d'inhibiteur et un potentiel de 0,40 V (par rapport à l'ECS), donner les valeurs des densités du courant anodique, du courant traversant l'ECS et du courant à la contre-électrode. Pourquoi utilise-t-on une contre-électrode ? c) Déterminer graphiquement les densités de courant de corrosion sans inhibiteur, avec 0,2% d'inhibiteur et avec 0,3% d'inhibiteur. Pour cela, on trace la tangente au plateau anodique et on détermine le point d'intersection avec le potentiel de corrosion. d) Évaluer le pouvoir protecteur (ou pourcentage de protection défini ci-dessous) pour les solutions à 0,2 et 0,3% en inhibiteur. inh jcorr - jcorr Pouvoir protecteur P = 100 où jcorr est la densité de courant de corrosion en absence d'inhibiteur jcorr inh et jcorr est la densité de courant en présence d'inhibiteur. III Les huiles siccatives La peinture à l'huile utilise une huile dite siccative, en général l'huile de lin. La siccativité de l'huile est une propriété relative au durcissement : celui-ci se fait par auto-oxydation, l'oxygène de l'air casse les doubles liaisons carbone-carbone et il se crée des liaisons entre les molécules d'huile. C'est donc une polymérisation qui se produit. Un indicateur lié à cette propriété est la mesure de l'indice d'iode : on considère qu'une huile est siccative lorsque son indice d'iode est supérieur à 150. On peut mentionner que la peinture utilisée pour le recouvrement de la Tour Eiffel est très riche en huile siccative. III.A Comment appelle-t-on la formation d'un polymère en trois dimensions (comme celui qui se forme lors du séchage de l'huile) ? On appelle indice d'iode la masse de dihalogène, exprimée en grammes de diiode qui pourrait se fixer sur 100 grammes de la substance étudiée. Il caractérise le degré d'insaturation d'une huile ou d'une graisse. Les halogènes sont fixés sur les doubles liaisons à partir d'une solution de monochlorure d'iode ICl à 0,100 mol · L-1 dans l'acide acétique (cette solution est appelée réactif de Wijs). C C + ICl ---- C C I Cl On fait réagir l'excès de ICl avec I- pour donner I2 et Cl- selon : ICl + I- = I2 + Cl- . Le diiode formé est dosé par le thiosulfate de sodium. On pèse m = 0,100 g d'huile de lin, que l'on verse dans vw = 10 mL de réactif de Wijs. On ajoute vh = 10,0 mL d'iodure de potassium à 10%, puis on dose par du thiosulfate de sodium à ct = 1,00 × 10-1 mol · L-1 . L'équivalence est repérée pour un volume ve = 6,20 mL de thiosulfate de sodium ajouté. III.B Par rapport au réactif de Wijs, l'huile utilisée doit-elle être en excès ou en défaut ? III.C Écrire l'équation-bilan de la réaction de dosage ; déterminer la constante d'équilibre Keq de cette réaction à 25 C. III.D Déterminer la quantité de matière n1 d'iodure de potassium qui a été consommé ; en déduire la quantité de matière n2 de monochlorure d'iode qui a réagi avec l'huile dosée. III.E Calculer l'indice d'iode, noté Ii , de l'huile de lin dosée. 3 avril 2012 11:31 Page 5/7 IV Les peintures dépolluantes TiO2 se comporte comme un photocatalyseur. Cette propriété peut être mise à profit pour détruire des polluants présents dans l'atmosphère. TiO2 existe essentiellement sous deux formes allotropiques : rutile et anatase. IV.A Étude de la structure du rutile On s'intéresse dans un premier temps à la structure du rutile, dont la maille élémentaire est représentée figure 4 (elle s'inscrit dans un parallélépipède). Les ions Ti4+ sont situés aux coins et au centre du parallélépipède et représentés en gris clair. a = b = 459,4 pm c = 295,9 pm c b a Figure 4 IV.A.1) Indiquer les coordinences Ti4+ /O2- et O2- /Ti4+ . IV.A.2) Déterminer la masse volumique du rutile, notée µrutile . IV.A.3) On prend comme hypothèse de travail qu'il y a contact entre les ions O2- des plans horizontaux. En considérant les ions O2- des plans supérieur et inférieur entourant l'ion Ti4+ central, déterminer le rayon des sites (occupés par Ti4+ ), puis justifier la stabilité de l'empilement. IV.B Étude de l'équilibre d'adsorption du polluant Une expérience est menée en solution aqueuse ; il s'agit de l'adsorption sur TiO2(s) d'un colorant, l'hélianthine, notée H, de masse molaire 305 g · mol-1 . Symboliquement, le site d'adsorption entre deux atomes est noté M M et M - H - M est la molécule chimisorbée. L'équilibre considéré est alors : (IV.1) M M + H(aq) = M - H - M À 298 K, on trouve une constante de réaction K3 égale à 18940. À 308 K, on trouve qu'elle vaut 25080. IV.B.1) Exprimer K3 , la constante de l'équilibre IV.1, en fonction des activités des espèces mentionnées. IV.B.2) Déterminer l'enthalpie standard de la réaction IV.1 ; cette donnée ainsi que l'entropie standard de réaction, est supposée indépendante de la température et on l'exprimera en kJ · mol-1 . IV.C Étude expérimentale de la cinétique de dégradation du polluant Toujours avec l'hélianthine, on effectue une série de mesures de concentration en fonction du temps ; l'hélianthine est initialement à la concentration de 12,0 mg · L-1 , l'expérience est effectuée à 298 K. Temps d'irradiation (h) Concentration (mg · L -1 1 ) 8,89 2 3 4 6 8 6,59 4,64 3,44 1,79 0,985 IV.C.1) Montrer que la réaction est d'ordre 1 par rapport à l'hélianthine. On détaillera le raisonnement et les calculs éventuels effectués (ou le graphe utilisé). IV.C.2) Déterminer la constante de vitesse de la réaction à 298 K. 3 avril 2012 11:31 Page 6/7 Données On note i l'imaginaire pur tel que i2 = -1. Caractéristiques du laser à CO2 Longueur d'onde = 1,06 × 10-5 m Intensité I0 = 1,00 × 109 W · m-2 Section du faisceau laser S = 10,0 mm2 Caractéristiques de l'acier étudié Temps moyen entre deux collisions de porteurs de charge c = 8,00 × 10-15 s Conductivité électrique statique 0 = 2,00 × 106 S · m-1 Conductivité thermique K = 30,0 W · m-1 · K-1 Diffusivité thermique D = 2,00 × 10-5 u.S.I. Point de transformation allotropique Ta = 1029,2 C Point de fusion Tf = 1543,2 C Quelques constantes Vitesse de la lumière dans le vide Charge d'un électron c = 3,00 × 108 m · s-1 1 0 = F · m-1 36109 -e = -1,60 × 10-19 C Constante d'Avogadro NA = 6,023 × 1023 mol-1 Constante des gaz parfaits R = 8,314 J · mol-1 · K-1 Constante de Faraday F = 96 485 C · mol-1 Permittivité du vide Données diverses Densité à 25 C d'une solution d'iodure de potassium à 10% 1,076 Rayon ionique du titane 74 pm Rayon ionique de O2- 126 pm Données thermochimiques considérées comme indépendantes de la température Composé Pb3 O4(s) PbO(s) O2(g) f H 0 (kJ · mol-1 ) -718,7 -219,1 S 0 (J · mol-1 · K-1 ) 211,4 66,50 Masses molaires (en g · mol-1 ) I2 K Ti O 47,9 16,0 253,9 39,1 Potentiels standard à 25 C Fe2+ /Fe I2 /I- 205,0 -0, 44 V 0,54 V 2- S4 O2- 6 /S2 O3 0,09 V Formulaire - - þ -- þE þ - þ rot rot E = grad div E · · · FIN · · · 3 avril 2012 11:31 Page 7/7 Concours Centrale-Supélec 2012 NOM : Signature : PRÉNOMS : Composition de PhysiqueChimie Filière PSI Ne rien porter sur cette feuille avant d'avoir rempli complètement cet en-tête NUMÉRO DE PLACE Équations des droites données pour 1 mole de dioxygène échangée (en J · mol-1 ) - couple FeO(s) /Fe(s) r G01 = -518700 + 125,1 T - couple Fe3 O4(s) /Fe(s) r G02 = -545100 + 156,4 T - couple Fe3 O4(s) /FeO(s) r G03 = -624300 + 250,3 T r G0 (kJ · mol-1 ) 100 0 300 400 500 600 700 800 900 1000 1100 -100 -200 -300 -400 -500 Figure A Diagramme d'Ellingham des espèces du fer T (K) 30 avril 2012 09:53 dans la partie barrée Ne rien écrire 2011-009-DR Les espèces dissoutes ont une concentration de 10-6 mol · L-1 . E (V) 1,2 1,0 0,8 0,6 0,4 0,2 0,0 -0,2 -0,4 -0,6 -0,8 -1,0 -1,2 pH 0 1 2 3 4 5 6 7 8 9 10 Figure B Diagramme potentiel-pH du fer 11 12 13 14 30 avril 2012 09:53 dans la partie barrée Ne rien écrire 2011-009-DR j (A · cm-2 ) 10-2 sans inhibiteur 10-3 10-4 10-5 0,2% inhibiteur 10-6 0,3% inhibiteur 10-7 10-8 10-9 -0,7 -0,6 -0,5 -0,4 -0,3 -0,2 -0,1 0 Figure C 0,1 0,2 0,3 0,4 0,5 0,6 0,7 E (V)
