CCINP Physique 2 PSI 2010
| Thème de l'épreuve | La production massive de dihydrogène. Autour d'un véhicule électrique. |
| Principaux outils utilisés | thermochimie, diagrammes E-pH, solutions aqueuses, cristallographie, atomistique, électronique, couplage électromécanique, thermodynamique, électromagnétisme, mécanique |
| Mots clefs | hydrogène, cycle iode-soufre, décomposition de l'eau, réaction de Bunsen, moteur à courant continu, hacheur, climatiseur, plasma, GPS |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
' SESSION 2010 PSIP208
A
CONCOURS (OMMUNS POI.YIECHNIOUES
EPREUVE SPECIFIQÜE - FILIERE PSI
PHYSIQUE 2
Durée : 4 heures
Les calculatrices sont autorisées.
* * * * *
Le candidat atta chera la plus grande importance à la clarté, à la précision et
a la concision de la
rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d 'e'noncé, ille
signalera sur sa c0pie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre.
L'épreuve comporte un problème de chimie et un problème de physique. Les
candidats traiteront les
deux problèmes dans l'ordre de leur choix et les rédigeront de façon. séparée.
Le sujet comporte 16 pages
Durées approximatives : Chimie : 2 heures
Physique : 2 heures
PROBLEME DE CHIMIE
Toutes les données nécessaires àla résolution de ce problème apparaissent au 5
III en fin d'énoncé.
LA PRODUCTION MASSIVE DE DIHYDROGÈNE
Le dihydrogène est considéré comme le carburant du futur, utilisable aussi bien
dans les moteurs
thermiques que dans les piles à combustible. Sa production devra rapidement
s'intensifier et les
experts mettent l'accent sur des procédés thermochimiques ou électrochimiques
qui se résument à
un bilan simple : la décomposition de l'eau. Un des procédés thermochimiques,
le « cycle iode--
soufre » est discuté, de façon simplifiée, dans ce problème.
' SESSION 2010 PSIP208
A
CONCOURS (OMMUNS POI.YIECHNIOUES
EPREUVE SPECIFIQÜE - FILIERE PSI
PHYSIQUE 2
Durée : 4 heures
Les calculatrices sont autorisées.
* * * * *
Le candidat atta chera la plus grande importance à la clarté, à la précision et
a la concision de la
rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d 'e'noncé, ille
signalera sur sa c0pie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu 'il a été amené à prendre.
L'épreuve comporte un problème de chimie et un problème de physique. Les
candidats traiteront les
deux problèmes dans l'ordre de leur choix et les rédigeront de façon. séparée.
Le sujet comporte 16 pages
Durées approximatives : Chimie : 2 heures
Physique : 2 heures
PROBLEME DE CHIMIE
Toutes les données nécessaires àla résolution de ce problème apparaissent au 5
III en fin d'énoncé.
LA PRODUCTION MASSIVE DE DIHYDROGÈNE
Le dihydrogène est considéré comme le carburant du futur, utilisable aussi bien
dans les moteurs
thermiques que dans les piles à combustible. Sa production devra rapidement
s'intensifier et les
experts mettent l'accent sur des procédés thermochimiques ou électrochimiques
qui se résument à
un bilan simple : la décomposition de l'eau. Un des procédés thermochimiques,
le « cycle iode--
soufre » est discuté, de façon simplifiée, dans ce problème.
I. La décomposition thermochimique de l'eau
1.1. On se propose, dans un premier temps, d'étudier la décomposition de la
vapeur d'eau par la
chaleur, au voisinage de 1 800 K, pour obtenir le dihydrogène et le dioxygène.
Cette réaction est--
elle ex.othermique ou endothermique ? Préciser, à l'aide de la loi de
Vant'Hoff, pourquoi elle est
favorisée par une élévation de température.
1.2. Calculer la constante d'équilibre correspondante à 1 800 K.
1.3. On porte à 1 800 K un réacteur ne contenant que de la vapeur d'eau pure
sous la pression de
100 bars. Quelle pression. partielle de dihydro gène obtient--on à l'équilibre
? Quel est le rendement ?
Conclure sur l'intérêt économique de ce procédé.
II. Le cycle iode-soufre
II. 1 . Bilan
Afin d'obtenir un rendement satisfaisant sans se placer à des températures
rédhibitoires pour les
installations industrielles, on envisage d'utiliser le cycle thermochimique
ci--dessous qui se décline
selon les trois réactions suivantes :
12 + 802 + 2 1120 ---> 112804 + 2 HI (T = 400 K) Réaction (l)
HZSO4 ---> 802 + l/2 02 + 1120 (T = 1 100 K) Réaction (2)
2 HI ----> 12 + 112 (T = 700 K) Réaction (3)
Quel est le bilan de l'ensemble de ces opérations ?
II. 2. L 'iode
11.2.1. Observer la structure électronique de l'élément iode ; en déduire son
numéro atomique.
11.2.2. Quelle est la formule de Lewis de la molécule diatomique 12 '?
11.23. Le diiode solide cristallise dans le système cristallin orthorhombique ;
dans ce système, la
maille élémentaire est un cuboïde dont les trois dimensions sont différentes
(parallélépipède
rectangle). La figure 1 (page 5) présente la projection des atomes d'iode sur
une des faces
rectangulaires de ce cuboïde, avec leurs coordonnées associées. Combien cette
maille contient--elle
d'atomes d'iode '?
11.2.4. Calculer la distance l-----l pour les atomes CA, CD, CE, CF. En déduire
le nombre de plus
proches voisins d'un atome d'iode, confirmer la structure moléculaire du diiode
solide et préciser la
nature des liaisons C--A, C--D, C--E, C--F.
[1.2.5 . Le diiode solide se transforme en diiode gazeux par élévation de la
température. Comment
appelle--t--on cette transformation '? Calculer la pression de 12 @ au-dessus
de 12 (S) à la température
ordinaire (298 K).
II. 3. Le dioxyde de soufre
11.3. 1. Ecrire la formule de Lewis de la molécule 802. En déduire sa structure
géométrique.
11.32. Le dioxyde de soufre, gazeux à température et pression ordinaires, est
très fortement soluble
dans l'eau à laquelle il confère un caractère acide marqué. Quel nom la
nomenclature systématique
donne--telle à l'anion hydrogénosulfite, HSOg", base conjuguée de cet acide ?
II.3.3. Déterminer le pH à 298 K d'une solution dans laquelle on a dissous l
mol.L """ ' de dioxyde de
soufre.
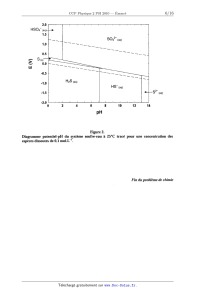
Il.3.4. Le diagramme potentiel--pH du système soufre-eau est représenté sur la
figure 2 (page 6).
Quel type de réaction subit le soufre solide au--dessus de pH = 7,5 ? Ecrire le
bilan de cette réaction.
Pourquoi ce diagramme ne fait--il pas apparaître les espèces 802 et HSOg'" '?
II. 4. La réaction de Bunsen
Le diiode et le dioxyde de soufre réagissent ensemble en présence d'eau selon
la réaction (1), dite
« Réaction de Bunsen », qu'on étudie de façon simplifiée en considérant les
constituants dans l'état
physique qu'ils ont à 400 K :
12 (EUR) + SO}, @) + 2 H7_O (g) ---> 2 HI (g) + HzSO4 (EUR) Réaction (4)
114.1. Préciser quel(s) est (sont) l' (les) élément(s) réduit(s), oxydé(s), ou
qui ne change(nt) pas de
nombre d'oxydation pendant l'évolution selon la réaction (4).
11.42. Montrer, en calculant sa constante d'équilibre à 400 K, que cette
réaction n'est pas
thermodynamiquement favorable dans les conditions retenues ici. Proposer une
méthode permettant
d'augmenter son rendement.
II. 5. La décomposition de l'acide sulfurique (Réaction (5)}
Cette réaction permet de recycler le dioxyde de soufre et de récupérer le
dioxygène ; elle s'écrit :
HQSO4 (g) ---> 802 (g) + l/2 03 (@ + HzO (g) RéflC-ti0fi (5)
11.5. 1. Ecrire la formule de Lewis de la molécule H2804 et en déduire sa
géométrie.
On considère parfois, de façon simplifiée, que l'acide sulfurique se déshydrate
rapidement puis que
son anhydride 803 se réduit en SO; selon :
803 (g) ---> 802 (3) + "2 02 @) Réaction (6)
La constante d'équilibre à 1 100 K de cette réaction est égale à 0,5. Un
réacteur fermé contient
initialement, à cette température, du trioxyde de soufre pur sous la pression
de 1 bar. La température
dans le réacteur est maintenue à 1 100 K.
11.5.2. Calculer les pressions partielles des trois constituants à l'équilibre
thermodynamique.
1153. Quelle est alors la pression dans le réacteur en supposant que tous les
gaz sont parfaits ?
III. Données numériques et figures
Numéros atomiques :
H:1;0:8;S:16
Structure électronique :
[I] = [Kr] 5s2 4d'° 5p5
Constante des gaz parfaits : R = 8,314 J.K""1 .mol"l
Température de fusion de 12 : Tf = 386,8 K
Enthalpie standard de réaction à 298 K (kJ.mol'l)
12 (Si) : 12 (EUR) [X,--HO : 62,421
Entropies standards a 298 K (J.mol"l)
12 ($) S° ... = 116,142
I2 @) S° (g) : 260,685
Enthalpie et enthalpie libre standards de formation à 1 800 K (kJ.mol") :
H20 (@ Af ° =----- 251,139 A ° =------ 147,330
Enthalpies libres standards de formation à 400 K (kJ.mol'l) :
802 @) AfG° = ---- 300,942
H30 @) AfGO = ------- 223,951
HI (@ At ° = ---- 6,428
112804 (EUR) AfG° == ----- 647,930
12 (EUR) AfG° = 0
Constante d'acidité :
SOZ(aQ)+2 H20 0) : HSO3" (aq) + H30+ (aq) Ka : 10"l'8
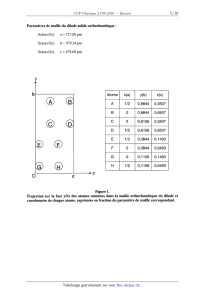
Paramètres de maille du diiode solide orthorhombique :
Selon- (OX) & == 727,00 pm
Selon (Oy) b = 979,34 pm
Selon (02) 0 = 479,00 pm
0,8... 0,507
un
06156 0,350?
.m--
__
03844 0,1493
0,3844 0, 6493
0,1 156 O, 1493
0,1 156 O, 6493
"2
Figure ].
Projection sur la face y0z des atomes contenus dans la maille orthorhombique du
diiode et
coordonnées de chaque atome, exprimées en fraction du paramètre de maille
correspondant.
2.0
HSO4" (aq>---->
1.5 --
Figure 2.
Diagramme potentiel--pH du système soufre-eau à 25°C tracé pour une
concentration des
espèces dissoutes de 0,1 mol.L"l.
Fin du problème de chimie
PROBLEME DE PHYSI UE
AUTOUR D'UN VEHICULE ELECTRIQUE
Cette étude aborde différents thèmes liés à l'automobile. Les différentes
parties sont indépendantes.
Un formulaire global se trouve en fin d'énoncé.
PARTIE I : étude de la motorisation
I] A) Principe de fonctionnement et modélisation.
Le principe de la conversion d'énergie électrique en énergie mécanique repose
sur une interaction
champ magnétique - courant électrique.
L'espace sera repéré par les bases habituelles (êx,êy,êz) ou (ër,ë9,êz) suivant
qu'on travaille en
coordonnées cartésiennes ou cylindriques. L'axe principal de la machine est
colinéaire à ëz .
Dans la machine à courant continu que nous étudions ici, le stator aussi appelé
inducteur est
alimenté par un courant continu, appelé courant d'excitation et noté : l'....
Il crée à l'intérieur de la
_,
machine un champ magnétique radial, porté par ër :B : Brër avec B, : Br(i EUR)
= K (6)i qui est
exc ' exc
proportionnel au courant d'excitation i... et qui dépend de (9.
On a K(9)=k pour ÛE]%;î--[ et K(Û)=--k pour 95}--fl;%[U]--Ë;fl[ où k est une
constante positive.
Pour un courant d'excitation iexc positif donné, Br(i
exc '
EUR) est alors la fonction de 0 constante par
morceau, représentée figure 1:
Br(iexoe 9)
k. l., C
..T[ 9
2 5
'k- iexc
Figure 1
Le rotor, aussi appelé induit se compose de N spires rectangulaires montées en
parallèle. Les spires
de rayon a et de longueur 11, ont pour axe principal z'z. Lorsque le rotor est
parcouru par un courant
continu ], chaque spire est parcourue par le courant : IS : 1 N . Ces spires
peuvent tourner autour de
l'axe de rotation z'z.
Un système bagues-balais permet d'inverser le courant dans les spires à chaque
demi-tour de sorte
qu'on se trouve toujours dans la configuration décrite par les figures 2 et 3.
B ...................... ..
-./vducteur aller
Traj ectoire d'un conducteur
.
.. o'
o .
'o ..
. n
o o
.. ..
'. ..
o o
'. ..
°°°°°°°
°°°°°°°
...........
Figure 2
Système
bagues-balais\
Figure 3
D'un point de vue électrique, chaque spire du rotor & une résistance i" et une
inductance propre 5.
D'un point de vue mécanique, le rotor tourne autour de l'axe z'z à la vitesse
angulaire Q = Q ê" , on
&
note J son moment d'inertie.
Modélisation :
1) Par induction électromagnétique, un circuit électrique peut être le siège
d'une tension induite.
Rappeler dans quelle(s) condition(s) ce phénomène apparaît, on distinguera le
cas de Neumann et le
cas de Lorentz.
2) Lorsque le rotor tourne, il apparaît le long des conducteurs aller (oc, B)
et retour (y, 6) deux
tensions induites 60113 et 675, de sorte qu'une spire peut être modélisée par
le schéma électrique de la
figure 4.
Figure 4
Déterminer les fem. (forces électromotrices) induites 60113 et 675 en fonction
de Q , a, 11, k et iexc. En
déduire la fem. totale induite espioe aux homes d'une spire.
3) On modélise le rotor par le circuit R, L, E alimenté par une source de
tension continue
Vreprésenté figure 5.
I
R L E
1
Figure 5
Donner les expressions de R, L et E en fonction de r, 6, a, h, Q , k, iexc et N.
4) Applications numériques :
On donne r = 12 @, EUR= 1,4 1--1, a = 25 cm, h = 1,1 m, N: 40 spires, i... =
0,5 A et k = 3,2 s.1...
Le moteur fonctionne en régime permanent à 3000 tours par minute. Il est
alimenté par une source
de tension V= 310 V.
Préciser les valeurs numériques de R, L et E.
Quelle est l'intensité du courant ] absorbé par le moteur '?
Etude mécanique :
Lorsque "le moteur est parcouru par un courant continu [, il est soumis à des
forces
électromagnétiques de moment (ou couple) F : I'ëz .
S) Exprimer F en fonction de I, a, 17, k et iexc.
Application numérique : Calculer le couple F pour un courant I = 113 A.
Etude énergétique :
On considère un fonctionnement moteur pour lequel Q = 3000 tr/min, V= 310 V et
l = 113 A.
On note :
- P...æ la puissance mécanique délivrée par le moteur,
-- P] les pertes Joule dissipées dans le moteur,
. Pa"... la puissance délivrée par l'alimentation.
6) Quelle relation existe--t-il entre ces trois puissances '? Calculer chacune
d'elles.
7) Définir le rendement du moteur et le calculer.
Compromis couple / vitesse :
On suppose ici que le moteur est fortement sollicité de sorte que
l'alimentation stabilisée en tension
délivre son. courant maximum dit courant de saturation. Vet ] sont alors fixés !
8) Comment varie la vitesse de rotation du moteur ainsi que le couple F si on
diminue
progressivement le courant d'excitation iexc '? Expliquer pourquoi un véhicule
tout électrique,
motorisé par une machine à courant continu peut s'affranchir d'une boite de
vitesse. On pourra, par
exemple, expliquer comment agir sur le courant d'excitation pour simuler un «
rétro gradage ».
I] B) Alimentation de la machine par un hacheur série :
Le véhicule, motorisé par la machine à courant continu (M.C.C.) modélisée
précédemment, est
alimenté par une source de tension constante U = 400 V, par l'intermédiaire
d'un hacheur série, de
rapport cyclique oc et de période de hachage T, représenté figure 6.
. > «ou f
IK L
Figure 6
La M.C.C. est considérée, dans cette partie, comme parfaite, on néglige sa
résistance R. Son modèle
se ramène ainsi à une inductance L en série avec la f.e.m. E. On supposera ici
que le courant
* d'excitation iexc ne varie pas. Il est fixé à 0,5 A. La f.e.m. E est donc
proportionnelle à la vitesse.
On a E = 276 V pour Q = 3000 tr/min.
La commande du transistor K est la suivante :
-- Sur l'intervalle [O, od], le transistor K est passant.
--- Sur l'intervalle [DJ, 7], le transistor K est bloqué.
Dans les mêmes conditions de frottement, on a relevé les deux chronogrammes de
la figure 7. L'un
des deux est obtenu lorsque le véhicule roule sur le plat, l'autre lorsqu'il
aborde une montée.
..................................................................................................................................................................................................................................................................................................
Courant
(A)
[max = 61 A [max ___--_
[min := 50 A 11771... :
0 5 ms t 0 5 ms t
Chrono gramme l Chrono gramme 2
Figure 7
9) Quel chronogramme correspond au fonctionnement en montée du véhicule ? Parmi
les courants
i;ç, ip et i, quel est celui relevé sur les chronogrammes '? Quelle est la
fréquence de hachage ? Que
vaut approximativement le rapport cyclique on ?
1.0) Ecrire l'équation différentielle reliant i, U et E sur l'intervalle de
temps [O, od]. En déduire
l'ondulation du courant Ai = [max ----- I...... en fonction de L, U, E, or et T.
ll.) Ecrire l'équation différentielle reliant 1' et E sur l'intervalle de temps
[OLT, 7]. En déduire une
autre expression de l'ondulation du courant Ai = L,... ---- ,... en fonction de
L, E, oc et T.
12) D'après les deux relations précédentes, déterminer la relation entre E, oc
et U. Quelle est
approximativement la vitesse de rotation de la M.C.C. au cours des deux essais
correspondant aux
chronogrammes précédents ? Quelle est la vitesse de rotation maximale du
dispositif étudié ici ?
13) Exprimer Ai en fonction de L, oc, T et U. Retrouver à l'aide des
chronogrammes précédents la
valeur de l'inductance L.
PARTIE II : étude des équipements de confort
II] A) Système de climatisation.
Pour un confort optimal, on se propose de maintenir l'air contenu dans le
véhicule à 20°C.
On rappelle que la pression à l'intérieur du véhicule est maintenue par
équilibre mécanique avec le
milieu extérieur à 1 bar ou 105 Pa.
Le volume d'air contenu dans le véhicule est V= 4 m3 . L'air sera assimilé à un
gaz parfait. La
température extérieure est Hg = 35°C.
Dimensionnement du système de climatisation :
Si on coupe toute ventilation et toute climatisation, on constate que la
température de l'air contenu
dans le véhicule passe de 20°C à 21,5°C en une minute.
14) Quelle est l'énergie thermique récupérée par l'air du véhicule en une
minute ?
15) En déduire la puissance du climatiseur nécessaire pour maintenir la
température de l'air à 20°C.
16) Dans la pratique, on installe un climatiseur de puissance bien plus
importante : P = 500 W.
Commenter ce choix.
Etude du système de climatisation en circuit fermé (figure 8) :
En mode non recyclable, l'air du véhicule est aspiré par le compresseur à la
température @; = 20°C
et àla pression. PA = 1 bar.
Il est alors comprimé adiabatiquement de façon réversible jusqu'à une pression
PB et une
température «93.
Il échange thermiquement de l'énergie, de façon isobare avec l'air extérieur de
température
92 = 35°C. La température de l'air comprimé diminue ainsi jusqu'à (95.
La turbine effectue alors une détente adiabatique et réversible jusqu'à la
température Hp = 5°C et à
la pression PD === PA = 1 bar.
Le compresseur, la turbine et le moteur sont montés sur le même arbre mécanique.
Air extérieur 62 = 35°C
Echangeur
Turbine Compresseur Moteur
Figure 8
17) Pour un système ouvert unidimensionnel en écoulement permanent pour lequel
il n'y a
quasiment pas de variations d'énergies cinétique et potentielle macroscopiq,ues
le bilan en
puissance s'écrit:
D mAh : Eh + 3
où lîh correspond à la puissance thermique récupérée par le système et la à la
puissance mécanique
récupérée par le système autre que celle des forces de pression amont et aval.
A quoi correspondent les grandeurs Dm et Ah ? On en précisera bien les unités
S.1..
18) Représenter l'allure du cycle des transformations subies par l'air dans un
diagramme (P, V), où P
est la pression du gaz et v son volume massique.
19) Quelle est la valeur minimale de la température qu'on peut espérer
atteindre en C ? Quelle
contrainte sur la géométrie de l'échangeur permet de s'approcher au mieux de
cette température '?
20) En admettant qu'on ait le refroidissement maximum dans l'échangeur, quelle
doit être la
pression minimale en sortie du compresseur pour rejeter de l'air à 5°C dans le
véhicule.
21.) Quel débit massique du climatiseur permet d'assurer la puissance de
climatisation
PCI,-... : - 120 W ?
22) Déterminer la puissance mécanique prélevée par le compresseur sur l'arbre
du moteur, ainsi que
celle fournie à cet arbre par la turbine. En déduire l'efficacité globale de ce
dispositif idéal.
23) Dans la pratique, on a plutôt une efficacité de l'ordre de 3 à 4. Expliquer
cette différence.
H] B) Etude du système de positionnement par satellite (G.P.S.) :
Les premières couches de l'atmosphère terrestre sont constituées de gaz
électriquement neutres et,
du point de vue électromagnétique, peuvent être assimilées au vide. Au
contraire, la dernière couche
appelée ionosphère, est un plasma, c'est--à--dire un gaz partiellement ionisé,
très dilué, localement
neutre et constitué d'électrons et d'ions atomiques monochargés. Le vide et le
plasma ont pour
permittivité électrique 80 et pour splitéabilité magnétique ,uO .
On notera m la masse de l'électron et --e sa charge électrique, M la masse d'un
ion et +6 sa charge
électrique. On remarquera que, quelle que soit la nature de l'ion, m est
négligeable devant M.
Il y a n ions et n électrons par unité de volume dans l'ionosphère. Ces
particules sont supposées non
relativistes, c'est--à--dire que leur vitesse est très inférieure àla célérité
c de la lumière.
Les signaux électromagnétiques envoyés depuis la surface de la terre vers un
satellite G.P.S. (situé à
très haute altitude) doivent traverser l'ionosphère. Il en est évidemment de
même pour les signaux
émis par le satellite vers la surface de la terre.
On envoie depuis la surface de la terre vers le satellite G.P.S. une onde
électromagnétique plane,
progressive, monochromatique, polarisée rectilignement, qui traverse d'abord
les premières couches
de l'atmosphère, puis l'ionosphère, pour atteindre le satellite.
Pour cette étude, on ne tient pas compte de la géométrie sphérique de la terre.
On considère le
problème comme localement plan. L'axe des 2 est l'axe vertical ascendant. On
utilise les notations
complexes habituelles, les champs électrique et magnétique associés à cette
onde ont pour
expression: _É== E0exp(i(a)t-- ](Z)) et B= & exp(i(æt-- kz)).
Etude du plasma :
24) Quelle est la relation entre les amplitudes iiË0ii du champ électrique,
Ë0" du champ magnétique
et la célérité (: dans le cas de la propagation dans les premières couches de
l'atmosphère '?
25) En supposant que cette relation reste valable dans l'ionosphère, justifier
que la force
magnétique est négligeable devant la force électrique qui s'exerce sur une
particule chargée de
l'ionosphère.
26) Montrer que les électrons de l'ionosphère tendent à vibrer par rapport à
une position moyenne
avec une vitesse complexe & qu'on exprimera en fonction de a), e, m et _E_ .
27) De même, exprimer la vitesse complexe ip de vibration des ions en fonction
de a), e, M et _E_--_ .
'?
Que peut on dire de Hifi)" par rapport à
{;
EUR
28) Justifier qu'il existe dans le plasma une densité de courant :; . A l'aide
d'une approximation,
exprimer Î en fonction de n, a), e, m et _E: . Montrer qu'on peut définir une
conductivité électrique
complexe ;! qu'on exprimera en fonction de n, e, a) et m.
29) Y a--t--il dissipation d'énergie au cours de la propagation de l'onde dans
le plasma '? Pourquoi ?
Etude des ondes électromagnétiques :
30) Ecrire les quatre équations de Maxwell dans le plasma.
31) En déduire l'équation aux dérivées partielles satisfaite par le champ _Ê_
dans le plasma.
32) En remarquant que A_Ë_ =----k2_É _. établir la relation de dispersion de
l'onde dans le plasma.
2 7
a) ------(0 "' _ _ _
On l'écr1ra sous la forme : k2 : ------------.,----3-- et on préc1sera
l'expressron de (()p en fonction de n, 6,
Ca'- ,
80 et m.
! a)}? r r . .
33) La frequence fp == 2 est appelee frequence de coupure du plasma. Justifier
son nom. Y a--t--1l
* ][
des précautions particulières à prendre sur le choix de l'onde
électromagnétique utilisée selon qu'on
souhaite communiquer avec un satellite situé au dessus de l'ionosphère (cas du
GPS.) ou qu'on
souhaite propager une émission radio en ondes courtes à très grande distance au
dessus de la terre '?
34) On suppose f > ]Ç,, exprimer en fonction de 0, f et [... la vitesse de
groupe vg d'un paquet d'ondes
très étroit centré sur la fréquence f.
Correction ionosphérique pour le système GPS. :
Un satellite S, supposé ponctuel, se trouve au dessus de l'ionosphère,
d'épaisseur H, à la verticale
d'un point P de la terre. On note D la distance SP (figure 9). On rappelle que
la partie de
l'atmosphère qui n'est pas l'ionosphère est assimilée à du vide.
ionosphère
Figure 9
35) Le satellite émet simultanément à t = 0 deux paquets d'ondes très étroits,
centrés autour des
deux fréquences f; et fg, avec J'] > fg >> 1}. Ils arrivent respectivement en P
aux dates t; et {Z.
Exprimer en fonction de H, (3, f... f; et fg le décalage temporel At = t. ----
1'! des temps de réception des
deux signaux à leur arrivée en P.
Simplifier cette expression en remarquant qu'au voisinage de 0 on a : (l ---
X)" z l-- [or.
36) Etablir l'expression du temps { mis par une onde de fréquence [ >> 1} pour
parvenir du satellite
jusqu'au point P en fonction de D, H, c, fet I}.
37) En déduire à l'aide des résultats précédents que D = ct --- d, où l'on
exprimera d en fonction de
0, At, £ f; et fg.
38) Le terme d est appelé correction ionosphérique, il est obtenu par mesure de
At en temps réel. Il
est de l'ordre du cm. Commenter cette valeur dans le cas d'une localisation
automobile.
Formulaire :
Capacité themique massique de l'air à pression. constante : c,, = 1,00 k].kg'l
.K"'.
Masse molaire de l'air : M... = 29 g.mol".
Constante des gaz parfaits : R = 8,31 J.KÎ'.mol"'.
Rapport des capacités thermiques à pression et volume constants pour l'air : y
: Cp/Cv = 1,4.
Permittivité électrique du vide : 80 = 8,85><1042 F.m°'. Perméabilité magnétique du vide : ,u0 = 47t><10"7 S.I. Célérité de la lumière dans le vide : c = 3><108 ms". Masse de l'électron : m = 9,1 ><10"27 kg. Charge électrique élémentaire e = l,6>< 10"19 C. On rappelle que rôt(rôt(â)) : gfad(div(ä)) ------ Aâ . Fin du problème de physique Fin de l'énoncé
