CCINP Physique 2 PSI 2003
| Thème de l'épreuve | Ondes sonores et ultrasonores. Chimie et lumière. |
| Principaux outils utilisés | ondes sonores, électrocinétique, diffraction, atomistique, cristallographie, thermochimie, solutions aqueuses, polymérisation anionique |
| Mots clefs | production d'ultrasons, diffraction d'ultrasons, détection d'ultrasons, acétylène, feux d'artifice |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
SESSION 2003
| ' PSIP209
CONCOURS (OMMUNS POl'YTECHNlOUES
EPREUVE SPECIFIQUË - FILIERE PSI
PHYSIQUE 2
Durée : 4 heures
Les calculatrices sont autorisées.
***
N. B. : Le candidat attachera la plus grande importance à la clarté, & la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d
'énoncé, il le signalera sur sa copie et devra
poursuivre sa composition en expliquant les raisons des initiatives qu'il a été
amené à prendre. '
***
L'épreuve comporte un problème de physique et un problème de chimie. Les
candidats traiteront les
deux problèmes dans l 'ordre de leur choix et les rédigeront de façon séparée.
Durées approximatives : __ physique - 2 heures"
chimie - 2 heures
PROBLEME DE PHYSIQUE
' ONDES SONORES ET ULTRASONORES
{PRODUCTION, PROPAGATION, DIF F RACTION ET FILTRAGE!
Le sujet. comporte cinq parties qui peuvent être traitées indépendamment. La
première et la
deuxième partie comportent des questions pouvant également être traitées
indépendamment.
PREMIERE PARTIE
GENERATEUR D'ULTRASONS : OSCILLATEUR
Pour générer des ultrasons, on utilise une plaquette de matériau
piézoélectrique dont deux faces
opposées sont métallisées. On applique une tension périodique
électrique,de'fréquence f, entre les
surfaces métallisées. Pour une certaine valeur de la fréquence fo, la plaquette
rentre en résonance
mécanique. Les vibrations de la plaquette (de même fréquence f0) sont ensuite
communiquées au
fluide qui l'entoure et génèrent des ondes ultrasonores.
. ' Rs Ls (:
On se propose d'étud1er d'abord le S
comportement électrique de la plaquette M N
' piézoélectrique, assimilable au dipôle MN de
la figure 1, puis de s'intéresser à la façon dont C0
on peut réaliser, à l'aide de la plaquette, un
oscillateur dans le domaine des fréquences
ultrasonores. figure 1
1.1. Etude simplifiée: on néglige d'abord les phénomènes dissipatifs
(dissipation de puissance)
représentés par la résistance R.,. Le schéma électrique équivalent de la
plaquette piézoélectrique
est alors celui de la figure 2. '
figure 2
1.1.1. L'impédance Z]! de la plaquette est de la forme ZE : jX. Montrer que X
peut se mettre
ü)2
1--__ -
2.
(DS
2
c.{1-%]
(DP
On précisera les valeurs des pulsations (Ds et (up et du coefficient C.
sous la forme : X = --
1.1.2. Pour la plaquette utilisée, les éléments du schéma électrique équivalent
sont les suivants :
Ls= IOOOH ; CS: 0,4pF ; Co: 60pF.
Donner les valeurs des pulsations ms et (DP et de l'écart relatif ((fis --
oep)/ oes .
1.1.3. Quels phénomènes physiques empêchent l'impédance de prendre des valeurs
nulle ou
infinie ?
1.2. On prend en compte maintenant les phénomènes dissipatifs : on considère le
montage de la
figure 1 avec Rs : 10 Q . '
Montrer que compte-tenu des valeurs R3 Ls
numériques, le schéma électrique équivalent
se réduit, pour des fréquences voisines de
1
f =-------- au schéma sim le de la
S 271"./L8Cs p
figure 3 (circuit RSLsCs série).
1.3. Oscillateur à résonance série. ' .
On souhaite réaliser un oscillateur délivrant une tension sinusoïdale de
fréquence f,. Le
montage de principe est celui de la figure 4. ZS est l'impédance du circuit
RsLSCs série. Le
« convertisseur » est un convertisseur courant--tension idéal (impédances
d'entrée et de sortie
nulles, fonction de transfert A : VS / _I_g'= A réelle).
convertisseur
courant--tension
figure 4 figure 5
1.3.1. Le montage de la figure 4 peut être. représenté par le système bouclé de
la figure 5 pour
lequel l'entrée _E_ est nulle Donner les expressions des fonctions de transfert
H (de la
chaîne directe) et K (de la chaîne de retour).
1.3.2. Quelle relation doivent vérifier H et _K pour que le système bouclé
fonctionne en
oscillateur (ie et vs sinusoïdales) "?
1.3.3. Quelle relation existe alors entre A et ZS ?
Déterminer la valeur correspondante A0 de A, ainsi que la fréquence
d'oscillation.
1.3.4. Que se passe-t--il si |A| > A0 ?
DEUXIEME PARTIE
GENERALITES SUR LES ONDES SONORES
On étudie la propagation des ondes sonores dans l'air, initialement au repos,
assimilé à un gaz
parfait subissant des transformations isentropiques.
On note P, p et v la pression, la masse volumique et le vecteur vitesse en un
point de l'air.
On rappelle la définition du coefficient de compressibilité isentropique de
l'air (que l'on supposera
constant):
___ âV __ ôp
"8 ' v(aîl %(âP)
On néglige les effets de la pesanteur. De plus, l'air, supposé parfait, est non
visqueux.
L'étude est menée dans le référentiel du laboratoire, supposé galiléen.
2.1. Soit une particule de fluide de volume d": : dx.dy.dz.
Montrer que la résultante des forces de pression exercées sur la particule par
le fluide situé à
l'extérieur de l'élément dt s'écrit : d_f= -- grad P.dr
, âv ---- , 1 -------- .
2. 2. L équation d' Euler s'écrit: Ît +(v.grad)v : -- ---- grad P (relation (1)
).
P
Que représente le premier membre de cette équati0n (on veillera à la précision
de la réponse) ?
2.3. p et v (masse volumique et vitesse) satisfont également la relation (2)
suivante :
ê_p
ôt
Que traduit cette relation '?
+ div( p V): O (relation (2) ).
2.4. En l'absence d'ondes sonores, ona: v : Ô , P : Po , P = Po
--0
En présence d'ondes sonores, on obtient: v # 0 , P : Po+p , p : po + 11
où p est la surpression acoustique et u la variation de masse volumique.
v , p et 11 ont en tout point du fluide une valeur moyenne nulle et sont
considérés comme des
infiniment petits ainsi que leurs dérivées spatiales et temporelles.
Dans toute la suite, on se place dans l'approximation acoustique. Cela signifie
que tous les
calculs seront menés à l'ordre 1 des infiniment petits, ce qui permettra
d'obtenir des équations
linéaires.
Que deviennent les deux équations (l) et (2) dans cette approximation ?
2.5. Justifier la relation: u : po. Zs-P (relation (3) ).
___--_
2.6. On rappelle que div ( grad f ) : Af , f désignant une fonction scalaire et
A l'opérateur laplacien.
2.6.1. Montrer que la surpression vérifiel' équation de propagation
(tridimensionnelle) de
d' Alembert.
2.6.2. Donner l'expression de la vitesse de propagation du son, notée c (
«célérité du son » ).
2.7. On étudie la propagation d'une onde sonore dans l'air qui remplit un long
cylindre d'axe Ox et
de section S constante. On considère que l'onde est plane, progressive,
sinuso'1'dale et qu'elle se
propage selon Ox dans le sens des x croissants (x > O).
On pose, en notation complexe :
p(x, t)= po exp ( j(wt --- kx) ) =& exp ( j(oet -- kx) ) pour la surpression
(complexe) instantanée,
v(x, t)= v(x, t)ü : vo exp(j(wt--kx kx--d))). ûx= fiexp(j(oet--kx)). fix
pourlavitesse '
(complexe) instantanée.
Dans ces expressions, k est supposé réel (et non pas complexe).-
2.7.1. Etablir la relation entre k et (0.
2.7.2. Exprimer p(x,t) en fonction de v(x,t), po et c ( c : célérité du son).
En déduire la
valeur de (1).
2.7.3. On définit l'impédance acoustique d'un milieu par la relation Z : Z :
p(x, t) / v(x,t).
Exprimer Z en fonction de po etc (on vérifiera que _Z_ est réelle).
2.7.4. Application numérique : on veut calculer la valeur de Z pour l'air à
20°C, à pression
usuelle PO : 105 Pa. L'air est assimilé à un gaz parfait diatomique (y = 7/5).
Données numériques :
- masse molaire de l'air : 29.10"'kg.mol'l
-- constante des gaz parfaits : R = 8,31 J.K".mol'1 .
a) Etablir la relation liant 765 à Po .
b) Calculer XS , c (célérité) et Z (on prendra le kg.m'2
.s'1 comme unité de Z).
2.7.5. Dans le cas d'une onde régressive (se propageant dansle sens des x
décroissants), que
deviennent :
a) les expressions de v(x,t) et p(x,t)
b) l'expression de l'impédance acoustique que l'on notera Zr : p(x, t) / v(x,
t) '?
TROISIEME PARTIE
INFLUENCE DE LA VISCOSITE DE L'AIR
En réalité, à cause de la viscosité de l'air, le son est absorbé au cours de sa
propagation. On suppose
que l'onde se propage suivant la direction Ox. On admet que la surpression
p(x,t) vérifie alors
l'équation de propagation suivante:
Ë_2p_ 02 82p
ôt2 âx2 ôx 2dt
dans laquelle c et B sont des constantes (avec [3 proportionnel àla viscosité
de l'air) .
--%+B-
On considère que l'émetteur émet une onde sinuso'1'dale de pulsation (» et que
B vérifie :
B.w << 02 . On cherche pour la surpression complexe une solution de la forme p(x, t) : po .exp @ (mt -- K.x) ) avec k complexe : k : k1 -- jk2 ( k1 et k2 réels positifs). 3.1. Exprimer k1 et kg en fonction de B, c et (1) en faisant les approximations qui s'imposent. 3.2. Donner l'expression réelle p(x,t) de la surpressiOn. 3.3. Donner l'expression de la vitesse de phase V
ol @
figure 6
On admettra que les raisonnements utilisés pour la diffraction des ondes
lumineuses s'appliquent à
celle des ondes sonores.
4.1. Quelle est la longueur d'onde À de l'onde ultrasonore ?
4.2. Enoncer le principe d'Huygens-Fresnel.
4.3. Pourquoi peut--on ne considérer le phénomène de diffraction que dans le
plan Oxy ?
4.4. Exprimer l'intensité acoustique I(9) dans la direction ü formant un angle
6 avec l'axe Ox en
fonction de lo, intensité acoustique pour 6 = 0 (on considérera ici que
l'intensité acoustique I(6)
est représentée par le carré de l'amplitude de l'onde diffractée dans la
direction 9 ).
4.5. Tracer l'allùre de la courbe I(6)/Ig en fonction de sin6 (on pourra tracer
l'allure sans avoir ...
répondu à la question 4.4.) . '
4.6. Soit 60 l'angle correspondant au premier minimum de la courbe. On
considère que la partie
« utile » du signal ultrasonore émis se situe dans l'intervalle [-60 , + 90].
Donner l'expression de 90 et calculer sa valeur.
Peut--on considérer que la source ultrasonore est directive '?
CINQUIEME PARTIE
FILTRAGE D' UN SIGNAL SONORE
On quitte le domaine des ultrasons. Pour analyser-les composantes
fréquentielles d'un signal sonore
(analyse des phonèmes du langage par exemple), on utilise un transducteur
(microphone) qui
convertit le signal en une tension ve puis un filtre passe-bande, qui extrait
les composantes
sinuso'1'dales de ve de fréquences voisines" d'une fréquence fo donnée.
On note vs la tension de sortie du filtre. Le filtre est un circuit linéaire
dont la fonction de transfert
s'écrit :
vS Fo
V =-----------------------------
__._ ...jQ{_w__æg]
030 0)
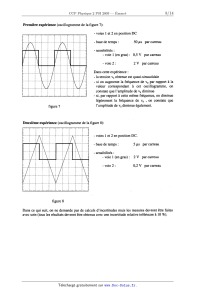
On se propose de déterminer les caractéristiques Fo, Q et 000 du filtre à
partir des oscillogrammes
obtenus en régime périodique pour une tension d'entrée ve rectangulaire pour
deux valeurs de
fréquences.
E(iw) =
On rappelle la décomposition en série de Fourier de ve(g dans le cas où ve(t)
est périodique de
période T avec:
- pour OSt> n'est plus utilisée aujourd'hui que par
les spé]éologues. Son
principe consiste à produire de l'éthyne gazeux C2H2 (encore couramment appelé
acétylène) par
réaction du carbure de calcium CaCz solide avec l'eau à température ordinaire.
L'acétylène produit
est alors enflammé à la sortie de la lampe et brûle dans l'air ; cette
combustion génère de la lumière
blanche. ' ' '
I.1 . Obtention de l'acétylêne
/
Question 1 (QI) : Ecrire et équilibrer le bilan de la réaction du carbure de
calcium avec l'eau (le
produit solide de cette réaction est le dihydroxyde de calcium Ca(OH)Z ou «
chaux éteinte >>).
Q2 : Quelle masse d'éthyne peut produire une charge de 200 g de carbure '? A
quel volume gazeux
cette masse correspond-elle dans des conditions habituelles de fonctionnement
en grotte (Pression
atmosphérique normale, T : 8°C) '?
Q3 : Quelle est la formule développée de l'éthyne ? La longueur de la liaison
carbone-carbone de
l'éthyne gazeux peut être évaluée en déterminant celle de l'anion dicarbure
C22" qui est la plus
courte distance carbone-carbone dans le carbure de calcium solide. Cet anion
est, en effet, le
précurseur direct de l'éthyne. \ '
La maille cristalline élémentaire du carbure de calcium est un prisme droit à
base carrée (système
cristallin quadratique). Observer sa représentation en projection orthogonale
selon Oy (Figure 1 et
Tableau 1) et calculer la masSe volumique du carbure de calcium.
Q4 : Déterminer à quel(s) atome(s) de carbone (A à F) correspond chacune des
positions atomiques
(C1 à C4). Quels sont les atomes de carbone les plus proches ? En déduire la
plus" courte distance
C-C.
QS: Les ouvrages de cristallographie présentent souvent une « pseudo--maille
presque cubique »
pour CaC2. Cette pseudo--maille, quadratique en fait, est construite sur la
diagonale de la face xOy
de la maille élémentaire. En utilisant une projection cotée sur le plan xOy,
représenter
l' arrangement des rons Ca2+ de cette pseudo-- --maille. Quel type
d'arrangement est mis en lumière '?
Q6: On connaît les longueurs des liaisons carbone--carbone de l'éthane et de
l'éthène. Justifiez
pourquoi elles sont plus élevées que celle de l'éthyne.
Q7 : Le dihydroxyde de calcium est une substance peu soluble dans l'eau et sa
formation, dans la '
lampe à carbure, génère une suspension blanche, fortement basique, appelée «
lait de chaux », dont
on souhaite calculer le pH. Dans un premier temps, on considérera que le
dihydroxyde de calcium
est une monobase forte et on calculera le pH du lait de chaux à 298 K dans
cette hypothèse.
QS : En fait, la libération partielle dudeuxième anion hydroxyde est
susceptible d'intervenir et le
pH de la suspension de lait de chaux doit être un peu plus élevé que celui
calculé en Q7. Déterminer
le pH du lait de chaux en prenant en compte cette seconde basicité de Ca(OH)Z
et conclure sur
l'intérêt de cette prise en compte (on supposera que la solubilité totale de la
chaux est inchangée).
Q9 : L'impureté principale du carbure de calcium industriel est le phosphure de
calcium Ca3Pz dont
la réaction avec l'eau génère un composé gazeux toxique, la phosphine PH3.
Quelle est la formule
de la phosphine selon Lewis ? Donner une représentation perspective de cette
molécule en vous
aidant de la théorie VSEPR. Préciser par une inéquation la valeur d'un angle
caractéristique.
1.2. Combustion de l'acétylênè
Q10 : La combustion complète de l'éthyne, utilisée pour générer la lumière,
produit du dioxyde de '
carbone et de l'eau. On souhaite montrer que cette transformation est totale en
calculant sa
' constante d'équilibre à la température de 1 500 K. On utilisera
l'approximation d'Ellingham dont
on rappellera le postulat et on 1' appliquera pour calculer successivement à
partir des données
fournies en fin d' énoncé: .
l' enthalpie de formation de l'eau gaz à 1 500 K,
la variation d'enthalpie associée àla combustion de l'éthyne à 1 500 K,
la variation d'entropie associée à l'ébullition de l'eau à 373 K,
l'entropie de l'eau gaz à 1 500 K, '
la variation d'enthalpîe libre associée àla combustion de l'éthyne à 1 500 K,
la constante d'équilibre recherchée. ' '
Conclure.
Q11: Quelle variation de température provoque une augmentation d'un facteur 10
de cette
constante d'équilibre ?
Il. Lesfeux d'artifice
La lumière émise par les feux d'artifice est générée par la température élevée
résultant du
dégagement de chaleur de réactions entre des solides. Ces réactions sont de
type redox, fortement
exothermiques. Un feu d'artifice contient au minimum un oxydant fort, le plus
souvent un anion
(nitrate, chlorate ou perchlorate) et un réducteur puissant, généralement un
corps pur élémentaire
(carbone, soufre, aluminium, zinc).
Q12: Quel est le nom du perchlorate de potassium KCIO4 en nomenclature chimique
systématique ? Quel est le nombre d'oxydation du chlore dans ce composé '?
Q13: Ecrire et équilibrer le bilan de la réaction explosive du perchlorate de
potassium avec
l'aluminium, qui fournit de l'oxyde d'aluminium A1203 et du chlorure de
potassium KC].
Q14 : Les feux d'artifice contiennent souvent du perchlorate d'ammonium
NH4CIO4, matière qui
explose spontanément par élévation de température car elle possède à la fois
l'oxydant (CIOI) et le
réducteur (NH4 ) d'une réaction très exothermique. Ecrire et équilibrer le
bilan de cette réaction de
décomposition spontanée qui fournit les produits suivants: HC], HClO4, N2 et
H20. Pour équilibrer,
on remarquera que le seul réactif est NH4CIO4 et on comparera l'évolution, au
cours de la réaction,
des nombres d'oxydation des éléments de ce composé qui subissent une oxydation
ou une
réduction.
Q15 : Les couleurs rouge et verte fréquemment employées dans les feux
d'artifices sont produites
par le retour à l'état fondamental d'atomes de strontium et de baryum excités
par la température
élevée de la combustion. On désignera par [Kr] la structure électronique de
l'atome de krypton, le
gaz inerte précédant le strontium. Expliciter cette structure électronique,
puis exprimer celle de
l'atome de strontium ainsi que celle de l'atome de baryum à partir de [Kr]. Que
constate--t-on ?
Pourqu0i l'atome qui suit le baryum dans la classification périodique des
éléments n'a-t--il pas la
même structure électronique que celui qui suit le strontium ?
Q16: La couleur bleue des feux d'artifices a été réalisée initialement en y
ajoutant du chlorure
cupreux CuCl. Ce composé se conservant difficilement, les artificiers lui
préfèrent aujourd'hui un
mélange de sulfate de cuivre et de polychlorure de vinyle (PVC) en poudre, ce
polymère apportant
le chlore nécessaire. Représenter une portion de la chaîne d'un PVC atactique.
Q17 : La polymérisation du chlorure de vinyle H2C=CHCI s'effectue plus
facilement par voie
anionique que par voie cationique. Ecrire les trois étapes d'une telle
polymérisation anionique, en
précisant le mécanisme (mouvements électroniques représentés par des flèches) :
1. Initiation, à partir de l'anion amidure NH2", créant l'anion monomère,
2. Propagation, conduisant à l'allongement de la chaîne carbonée,
3. Rupture (ou terminaison), réalisée par ajout de HCl, stoppant l'allongement
de la chaîne.
Q18 : Déduire de ce mécanisme la raison de la grande facilité de la
polymérisation anionique par
rapport à la polymérisation cationique. '
III. DONNEES :
Numéros atomiques :
H:l ; C:6 ; N:7 ; 0:8 ; P:15 ; Cl:17 ; K:l9 ; Ca:20 ; Kr:36 ; Sr:38 ; Ba:56.
Masses molaires atomiques (g.mol"') :
H: 1,0 ; C= 12,0 ; 0: 16,0 ; Ca=40,0.
Constante des gaz parfaits :
R = 8,314 J.K"'.mol"'
Nombre d'Avogadro :
' 17%: 6,023 x 1023 mol"1
Enthalpies standard de formation à 298 K (AçH°m en kJ.mol"l) :
C2H2 : + 227,40 ; C02 : -- 393,51 ; H20 : 4-- 285,83.
' Entropies standard à 298 K (8°... en J .K'I.mol'l) : .
Cng_ : 200,93 ; 02 : 205,15 ; C02 : 213,77 ; H20 : 69,95,
Enthalpie de vaporisation de l'eau à 373 K :
A,,,H°298 : 44,00 kJ.mol"'
Solubilité dans l'eau du dihydroxyde de calcium Ca(OH); à 298 K :
s = 1,6 g.L"1
' Constante d'équilibre à 228 K :
Ca0H* : Ca2++orr K,,=10'"3
c = 637,0 pm
a : 387,0 pm
Fig. 1 : Représentation de la maille du carbure de calcium en projection
orthogonale sur le plan sz.
La cote des ions calcium selon l'axe Oy perpendiculaire à la figure, exprimée
en fraction du
paramètre de maille a, est inscrite dans le cercle correspondant (par souci de
clarté, on n'a pas
indiqué la cote 1 dans les cercles des atomes se trouvant à cette cote). ,
Les atomes de carbone constituant les ions carbure C22" (notés A à F dans les
cercles gris) ont des
positions particulières dont les coordonnées sont foumies dans le Tableau 1.
Tableau 1 : Cordonnées (en fraction du paramètre de maille a selon Ox et Oy ou
c selon Oz) des
atomes de carbone C] à C4 de la maille du carbure de calcium.
Fin de l'énoncé
