Mines Chimie PSI 2006
| Thème de l'épreuve | Le zinc |
| Principaux outils utilisés | cristallographie, oxydoréduction, diagrammes potentiel-pH, courbes intensité-potentiel, diagrammes d'Ellingham |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- -
Énoncé complet
(télécharger le PDF)






Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
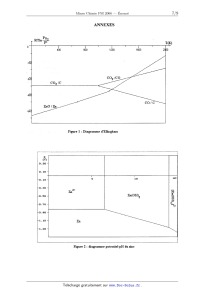
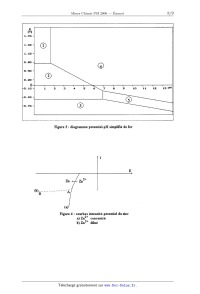
ECOLE NATIONALE DES PONTS ET CHAUSSEES. ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE, DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY, DES TELECOMMUNICATIONS DE BRETAGNE. ECOLE POLYTECHNIQUE ( Filière TSI ). CONCOURS D'ADMISSION 2006 EPREUVE DE CHIMIE Filière : PSI Durée de l'épreuve : 1 heure 30 minutes L'usage d'ordinateur ou de calculatrice est interdit Sujet mis à la disposition des concours : Cycle International, ENSTIM, TPE-EIVP. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE 2006- PSI Cet énoncé comporte 9 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. DEBUT DE L'ENONCE LE ZINC La consommation du zinc se situe en troisième position des métaux non--ferreux après l'aluminium et le cuivre. Nous allons nous intéresser dans ce sujet à la production de ce métal ainsi qu'à deux applications de celui-ci. DONNEES : Les figures sont données en annexe à la fin de l'énoncé. Le zinc : Numéro atomique : Z = 30 Température de fusion : 419°C Température d'ébullition : 907°C ZnO est solide sur tout l'intervalle de température considéré dans le problème. Données thermodynamiques : Enthalpies standard de formation AfH° à 25°C en kJ.mol'1 : ZDS(5)Z - 206 ZHO(S) : - 348 SOz(g) : - 296 Enthalpie libre standard dans le diagramme d'Ellingham (en kJ.mol'l) : 2 C(S) + 02(g) : 2 CÛ(g) ArG1°(T) : - 220 - 0,18 T C(S) + 02(g) = C02(g) ArG2°(T) : - 390 2 CO(g) + 02(g) : 2 C02(g) ArG3°(T) : --565 + 0,17 T ZZH(S) + 02(g) : 2 ZHÛ(S) ArG4°(T) : - 697 + 0,20 T 2Zn... + 02(g) : 2 Zn0(5) ArG5°(T) : - 710 + 0,22 T ZZn(g) + O2(g) : 2 ZHO(S) ArG6°(T) : - 940 + 0,42 T Potentiels standard E° à 298 K (à pH=O): E°(Zn2+/Zn) = -- 0,76 V E°(Fe2+/Fe) = - 0,44 V E°(Fe3+/Fe2+) = 0,77 V E°(H+/H2) = 0,00 V E°(Og/HZO) = 1,23 V Produit de solubilité à 25°C : Zn(OH)2(S) = Zn2+ + 2 Ho" pKS = 17 Constante de complexation à 25°C : Zn2+ + 4 Ho" = [Zn(OH)4] 2' log 34 = 15 I L'ELEMENT ZINC 1- Donner la structure électronique du zinc dans son état fondamental. On justifiera en ' énonçant les règles permettant de l'établir. Le zinc cristallise dans une structure hexagonale compacte. 2- Représenter une maille conventionnelle de ce métal. Quel est la coordinence des atomes '? Calculer la relation entre l'arête a et la hauteur c de la structure hexagonale compacte. 3-- Donner l'expression de sa masse volumique en fonction du nombre d'Avogadro NA, de la masse atomique du zinc Mg,1 et de a. Le zinc se trouve à l'état naturel sous forme de sulfure ZnS qui possède plusieurs formes allotropiques dont la structure blende. 4-- Représenter une maille conventionnelle de cette structure. Par souci de clarté on utilisera des couleurs différentes pour le zinc et le soufre . Sous quelles formes se trouvent le zinc et le soufre '? Donner la coordinence de chacune de ces espèces par rapport à l'autre. Il PRODUCTION DU ZINC PAR PYROMETALLURGIE La première étape de la production du zinc est la transformation du sulfure de zinc ZnS en oxyde de zinc ZnO selon la réaction : ZHS(S) + 3/2 O2(g) : znO(s) + SOZ(g) 5- Calculer l'enthalpie standard de la réaction. La réaction est--elle endo ou exothermique ? On effectue cette réaction vers 900°C. Après avoir amorcé la réaction, est--il nécessaire de poursuivre le chauffage ? Une fois l'oxyde-de zinc obtenu, il faut le réduire. La figure 1 donnée en annexe à la fin de l'énoncé représente le diagramme d'Ellingham du système C/CO/C02 et du couple ZnO/Zn. ' 6- En quoi consiste l'approximation d'Ellingham '? Quelle est la conséquence sur l'allure des courbes '? 7- On peut utiliser le carbone C pour réduire l'oxyde de zinc. Ecrire l'équation bilan de cette réaction. Selon la figure 1, à partir de quelle température la réaction sera-t-elle favorisée '? Calculer précisément cette valeur à partir des données. Pourquoi faut--il travailler en présence d'un excès de carbone ? Sous quel état se trouve le zinc obtenu '? 8- Peut-on utiliser le monoxyde de carbone comme réducteur ? Justifier votre réponse. Quels seraient les avantages ou inconvénients de ce choix. Le zinc obtenu par pyrométallurgie n'est pur qu'à 98,5 %. Les principales impuretés sont le fer, le cadmium, le plomb. Il faut donc le plus souvent le purifier. III PRODUCTION DU ZINC PAR HYDROMETALLURGIE III -- 1 Etude préliminaire La figure 2 (cf annexes) représente le diagramme potentiel-pH simplifié du zinc. Il a été tracé pour une concentration totale en élément zinc de 10"2 mol.L'l. 9- Quelle est l'équation bilan de la réaction relative au couple [Zn(OH)4]2'/Zn(OH)2 '? Calculer la constante d'équilibre. En déduire l'équation de la droite séparant les domaines de prédominance ou d'existence de ces deux espèces. La figure 3 représente le diagramme potentiel--pH simplifié du fer. Les espèces prises en compte sont : Fe, Fe2+, Fe3+, Fe(OH)2 et Fe(OH)3. 10- Affecter l'espèce correspondante à chaque domaine de prédominance ou d'existence numéroté de la figure 3. Justifier. 11- Ecrire les demi--équations d'oxydoréduction relatives aux couples de l'eau ainsi que les relations de Nemst correspondantes. On prendra comme convention les pressions partielles des gaz égales à 1. 12- Selon la concentration en zinc, la courbe intensité-potentiel relative au couple Zn2+/Zn peut avoir des allures différentes (figure 4). Comment s'appelle le segment AB ? Expliquer sa présence (vous pourrez vous aider d'un schéma). III ---- 2 Préparation d'une solution de sulfate de zinc acidifiée Après avoir transformé le sulfure de zinc ainsi que les impuretés métalliques (Fe, Co, Ni, Cu et Cd) en oxydes, on procède à une première étape de lixiviation acide pour mettre en solution les métaux contenus dans le minerai. 13-- Ecrire les équations de mises en solution de ZnO et FeO par l'acide sulfurique H2804. Sous quelles formes se trouvent alors le zinc et le fer ? Pour éliminer l'élément fer du mélange, on injecte du dioxygène à la solution. Puis on amène le pH de la solution autour de 5 . 14-- Ecrire l'équation bilan de la réaction qui a lieu entre l'élément fer sous la forme soluble précédente et le dioxygène. Justifier que l'on puisse facilement éliminer l'élément fer par ce procédé. Il existe d'autres impuretés que le fer. On ne prendra en compte que les espèces suivantes : Cd", Cu2+ et Ni". On procède alors à une étape de cémentation ; pour cela on introduit dans la solution du zinc en poudre. 15- A l'aide de la figure 5, justifier le procédé en écrivant les équations bilans des différentes réactions '? Sous quelles formes sont alors les impuretés ? Comment peut- on les éliminer ? III -- 3 Electrolyse de la solution de sulfate de zinc acidifiée On obtient une solution de sulfate de zinc à 2 mol.L'1 que l'on acidifie par de l'acide sulfurique à 1,5 mol.L". Le pH de la solution sera considéré égal à 0. Pour obtenir le zinc sous forme métallique, on procède à l'électrolyse de cette solution. Les électrodes utilisées sont : cathodes en aluminium et anodes en plomb inattaquables en milieu sulfate. Les cuves sont en ciment revêtues de polychlorure de vinyle (PVC). 16- Nous considérerons dans la suite que les ions sulfates ne participent à aucune réaction. D'un point de vue thermodynamique, quelles sont les réactions qui peuvent avoir lieu à la cathode ? à l'anode '? En déduire la réaction d'électrolyse attendue. Quelle différence de potentiel devrait-on appliquer '? 17- A l'aide la figure 6 donner l'équation d'électrolyse qui a réellement lieu. A uoi sont dus ces changements '? Si on impose une densité de courant de 500 A.m' , quelle devrait être la différence de potentiel appliquée aux homes des électrodes ? 18- La différence de potentiel est en réalité de 3,5 V. Expliquer la différence par rapport à la valeur estimée à la question précédente. IV UTILISATIONS DU ZINC A) On réalise les expériences suivantes : Un clou (assimilé à du fer) est plongé dans une solution aqueuse gélifiée contenant du chlorure de sodium, de la phénolphtaléine (indicateur incolore qui devient rose en présence d'ions HO-) et de l'hexacyanoferrate (III) de potassium (indicateur incolore qui devient bleu en présence d'ions F e2+). On observe une coloration bleue autour de la tête et la pointe et une coloration rose autour de la partie centrale du clou. On refait la même expérience en enroulant un ruban de zinc autour de la partie centrale du clou. Il n'y a pas de coloration bleue mais un voile blanchâtre autour du zinc. 19- Dans quels cas des zones différentes d'une même pièce métallique peuvent-elles avoir un comportement électrochimique différent ? 20-- Expliquer le phénomène observé dans la première expérience en écrivant les différentes réactions qui ont lieu dans la solution. 21- Que se passe-t--il dans la deuxième expérience ? En déduire une utilisation du zinc dans la vie courante. B) Le zinc est utilisé comme réducteur lors de l'ozonolyse réductrice. Soit le (Z)-3-méthy1pent--Z--ène, noté A 22- Donner en la justifiant la formule semi--développée de A. On effectue une ozonolyse de A en présence de zinc et d'acide éthanoïque. 23-- Quels sont les produits obtenus ? 24- Quels seraient les produits obtenus en l'absence de zinc '? On va utiliser cette réaction afin de déterminer la position d'une double liaison C=C dans un alcène, après identification des produits obtenus. L'ozonolyse suivie d'hydrolyse d'un alcène fi conduit à une cétone chirale Q de formule C6H120 et àla cétone Q représentée ci-dessous : \ CH-----C H C/ || 3 O 25- Représenter la formule semi-développée de __Ç. Représenter le stéréoisomère (R) en justifiant. 26- Représenter la formule semi-développée de _B. Est-elle totalement déterminée ? ANNEXES P ,\ RTln "? P° T(K) I l l l I l > 400 800 1200 1500 2000 -1Ë"Ü 3"2"0" -400 .040/ Figure 1 : Diagramme d'Elüngham ---O E (V) .30 - . 10 --1 _ 10 __ 15 Im "" .30 -- 2+ Zn E .50 -- Z"(ÜH)2 B 5 à .70 -- "'» .90 --4 \ ' 10 --1 Z" "Mb--\\ .30 ---- "\ \\ Figure 2 : diagramme potentiel--pH du zinc .40 --' .10-- .80 - .50 -- .20 --' .10-- .40 "* .70 - Figure 3 : diagramme potentiel--pH simplifié du fer \! Figure 4 : courbes intensité--potentiel du zinc &) Zn2+ concentré b) Zn2+ dilué WD 24»-- Zn Zn Nl Ni2+ Cu Cu2+ Cd cap Cd Cd2+ Cu Cu2+ ZH ZH2+ Nl N12+ Figure 5 : courbes intensité--potentiel pour différents métaux 'i(A-ni2) 500 H2C) 02 -0,90 -0,76 1,95 E -1 0 1 2 , H 2+ Z" -500 Figure 6 : courbes intensité--potentiel pour l'eau et les ions zinc FIN DE L'ENONCE
