Mines Chimie PSI 2001
| Thème de l'épreuve | Chimie du titane |
| Principaux outils utilisés | cristallographie, diagrammes d'Ellingham, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
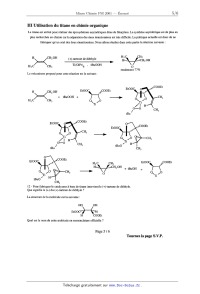
A 2001 Chimie PSI ECOLE NATIONALE DESPONT S ET CHAUSSEES. ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE, DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT --ET IENNE DES MINES DE NANCY, DES TELECOMMUNICATION S DE BRETAGNE. ECOLE POLYTECHNIQUE ( Filière TSI ) CONCOURS D'ADMISSION 2001 EPREUVE DE CHIMIE Î Filière : PSI (Durée de l'épreuve : 1 heure 30 minutes) (L'usage d'ordinateur ou de calculatrice est interdit) Sujet mis àla disposition des concours à ENSTIM,TPE--EIVP. Les candidats sont priés de mentionner de façon apparente sur'la première page de la copie : CHIMIE 2001--Filière PSI Cet énoncé comporte 6 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. DEBUT DE L'ENONCE LE T ITAN E Le sujet s'intéresse à la chimie du titane. Il possède trois parties totalement indépendantes. Toutes les données numériques ont été arrondies afin de faciliter les calculs. Il est demandé au candidat de fournir des expressions littérales et les valeurs numériques des résultats. L' élément titane est utilisé pour les propriétés physiques (mécaniques, optiques,... .) et chimiques de certains de ses composés, notamment: -- il est utilisé dans l'industrie de la peinture sous forme de dioxyde de titane (TiO;) qui est le meilleur pigment blanc, actuellement disponible. -- le métal est utilisé dans l'aéronautique. -- en chimie organique, la découverte de son utilisation couplée à l'aluminium sous forme de catalyseur de polymérisation, a valu un prix Nobel aux chimistes Ziegler et Nana. Nous verrons une autre application du titane dans ' une synthèse asymétrique. - I Etude structurale Données numériques : _ , Titane : Z = 22 Mn : 48 g.mol'l . Nombre d'Avogadro : NA : 6.1023 mol" , l --- Donner, sans la justifier, la configuration électronique du titane dans son état fondamental. A quelle famille appartient--il ? . Tournez la page S.V.P. 2 -- Quels degrés d'oxydation possède-t-il ? Quels sont les plus stables ? Justifier votre réponse. 3 -- Le titane cristallise sous deux formes allotropiques : Tic, et Tip. TiOL correspond à un empilement de type hexagonal compact. Par quelle technique expérimentale détermine-t-on la structure des cristaux ? Représenter une maille de Ti,. Connaissant le paramètre de maille a = 300 pm, calculer la valeur du paramètre c de la maille. On donne : \/:Ê: = 0,82 . Calculer aussi la masse volumique de Ti... Commenter ce dernier résultat et justifier l'utilisation du titane dans l'aéronautique par exemple. 4 -- Le titane [3 correspond à un mode d'empilement cubique centré de paramètre a = 330 pm. Calculer la compacité de cette structure ainsi que le rayon de l'atome de titane dans cette structure. On donne : Jî z 1,7 . Il Elaboration du titane Données numériques : __- .... ...... co5° 200 200 10 50 350 30 200 (J.K".mol") E°(Fe"/Fe") : 0,77 V ln x = 2,3 log x E°(Fe"/Fe) : - 0,44 V 2,3 RT/F : 0,06 V A Purification du minerai Il existe deux méthodes de purification des minerais d'oxyde de titane : le procédé sulfurique et le procédé au dichlore. En France, seul le procédé à l'acide sulfurique est utilisé à partir de minerais pauvres en dioxyde de titane (moins de 60 % en Ti02), comme l'Ilménite, approximativement FeTi03. Le minerai est broyé, puis attaqué par de l'acide sulfurique concentré ( 85 - 92 %) vers 200°C. Le titane se retrouve alors sous forme d'ions TiO", et les ions F e" et Fe" passent en solution. On transforme les ions Fe3+ en ions Fe" par ajout de fer. Les boues inattaquées sont séparées par filtration. La plus grande partie des ions F e2+ est éliminée de la solution lors du refroidissement par cristallisation de FeSO4, 7 HzÛ. On évite ainsi le rejet de sulfate ferreux à la mer comme cela se faisait autrefois ( ! 'oxydation des ions ferreux donne des ions ferriques et des boues rouges). La solution est alors concentrée et chauflée vers [10°C pendant plusieurs heures, ce qui provoque la précipitation d'un "gel" de formule approximative TiO( OH );. Le gel d 'hydroxyde ( TiO( OH );) est séparé par filtration et lavage puis calciné vers IOOO°C dans des fours tournants. On obtient alors TiÛz pur. La consommation de HzSO4 est comprise entre 2,2 et 4 tonnes par tonne de TlÛz produit. 5 --- Quels sont les degrés d'oxydation du titane dans FeTiOs (où le fer est au degré d'oxydation +II), TiOz, TiO2+ et TiO(OH)2 '? Conclure sur la présence ou non de réactions d'oxydoréduction pour le titane. 6 -- En considérant les potentiels standards, justifier le fait que rajouter du fer à la solution acide permet de réduire les ions Fe3+ en Fe" (Le raisonnement ne prendra en compte que les espèces du fer, on ne demande pas de justifier l'absence d'attaque du fer par H+ dans ces conditions). Le titane est en fait utilisé à 95 % sous forme de dioxyde de titane TÎ02. En effet, il est le meilleur des pigments blancs. De plus il est inerte chimiquement donc très stable et non toxique. Il est donc utilisé dans les peintures, le papier. .. Nous allons nous intéresser maintenant à l'élaboration du titane métal. Page2/6 B Passage au tétrachlorure de titane Pour obtenir le titane métal, il faut réduire le dioxyde de titane. Un réducteur très utilisé en sidérurgie est le carbone graphite (coke). ' 7 -- Tracer sur la copie le diagramme d'Ellingham pour les couples TlÛz(S)/T i et CO(g)/C...,...te entre 0 et 2500 K. Le coefficient stoechiométrique du dioxygène sera pris égal à l (en valeur absolue). L'échelle sera la suivante : abscisse : 1 cm = 200 K ordonnée : 1 cm = 50 kJ.mol'1 Ecrire la réaction de réduction de TiOz par le carbone graphite. Montrer que cette réaction n'est possible qu'à très haute température. En fait on ne fait pas comme cela car à ces températures il y a formation de carbures de titane qui empoisonnent le titane. On passe donc par un intermédiaire qui est le tétrachlorure de titane TiCL;, que l'on prépare par attaque du minerai. 8 -- Une méthode de passage de TlOz à TiCl.; consisterait en la chloration directe de Ti02 : TiOz(S) +2 Clz(g) = TiCl4(g) + Oz(g) (l) A l'aide des valeurs numériques, calculer A;G°1(T). Montrer qu'il est nécessaire d'opérer à plus de 1800 K pour obtenir une réaction totale (K°>10). On donne : R.ln(10) : 20 J .K".mol". En fait, cette réaction est utilisée dans le sens inverse pour régénérer l'oxyde à partir du chlorure dans le procédé d'obtention du dioxyde de titane au dichlore. 9 -- En pratique, l'oxyde est mélangé à du coke (environ 100 à 450 kg par tonne de minerai) vers 800 -- lOOO°C), selon le bilan : TiOz(S) + 2C (graphite) + 2 C12 (g) : TiCl4 (g) + 2 CO (g) (2) Puis TiCl4(g) est condensé sous forme liquide et purifié par distillation fractionnée. Calculer ArG°2(T). Montrer que dans l'intervalle de température considéré, la réaction est thermodynamiquement possible. C Obtention du titane 10 -- TiCL; est un liquide non conducteur, la réduction électrochimique est donc impossible. On envisage donc une réduction métallurgique par un métal dont l'affinité pour le dichlore est importante. On donne le diagramme de l'enthalpie libre standard de la réaction l/a M + Clg : l/a MCIza en fonction de la température (Diagramme d'Ellingham des chlorures) des couples suivants : TiCh/Ti, MgCh/Mg et NaCl/Na. F et E désignent respectivement les températures de fusion et d'ébullition des chlorures métalliques f et e désignent respectivement les températures de fusion et d'ébullitîon des métaux ' En transposant au cas des chlorures les connaissances acquises dans le cadre des diagrammes d'Ellingham des oxydes : . montrer que le magnésium et le sodium peuvent être utilisés pour la réduction du tétrachlorure de titane ; . écrire les réactions de formation des 3 chlorures. En déduire les réactions de réduction de TiCl4 soit par Mg (procédé Kroll), soit par Na (procédé Hunter).Ces deux procédés ont l'inconvénient de fonctionner en discontinu. Le procédé est le même dans les deux cas : Le réacteur est chargé de magnésium ou de sodium liquide sous atmosphère inerte vers 650 -- 700°C. On introduit alors lentement (réaction exothermique) le chlorure de titane. La température est maintenue aux alentours de 850 -- 900°C dans le cas du procédé au magnésium. Le réglage de la température doit être plus fin avec le procédé Hunter ; la température doit être comprise entre 801 et 883 °C. Le processus dure en moyenne 35 heures ; le réacteur est ensuite abandonné pendant 4 jours pour qu 'il se refroidisse et il faut une journée pour extraire les produits du réacteur. Page 3 / 6 _ Tournez la page S.V.P. On obtient alors des éponges de titane inexploitables en industrie. L'élaboration des lingots de titane s'effectue sous vide à haute température. Plusieurs procédés existent : le procédé à électrode consommable et celui à électrode non consommable. Dans tous les cas il s'agit de faire fondre les éponges de titane pour ensuite les compacter afin d'obtenir des lingots d'une masse de 2 à 5 tonnes en général. On obtient ainsi du titane d'une teneur de 99,6% en titane. ArG° (kJ.mol'l) 500 1 000 1 500 2000 0 T (K) -200 TiCl4/ Ti E E f MgC12/ Mg "400 E NaCl / Na F e f --600 F 9 -go. f Diagramme d'Ellingham des chlorures des couples : TiCIJT i, MgCh/Mg et NaCl/Na D Fabrication de titane ultra pur Pour certaines applications (militaires notamment) la pureté de 99,6% n'est pas suffisante. Pour obtenir du titane ultra pur, on utilise le procédé Van Arkel. Le titane provenant de la métallurgie classique est placé dans une enceinte sous vide, en présence de diiode et d'un filament de titane pur, chauffé par effet Joule, entre 1100°C et 1500°C. Le titane à purifier, chauffé vers 150 --- ZOO°C, par le rayonnement du filament, réagit seul avec le diiode gazeux pour former du tétraiodure de titane (Til4) gazeux qui au contact du filament de titane se décompose avec dépôt de titane sur le filament qui grossit. Le diiode est recyclé. On peut résumer par les réactions suivantes : , 200°C 1400°C Ti+212 ---------- % Tih ------------ -> Ti+212 11 --- Expliquer comment ce procédé permet de purifier le titane. Page4/6 III Utilisation du titane en chimie organique Le titane est utilisé pour réaliser des époxydations asymétriques dites de Sharpless. La synthèse asymétrique est de plus en plus recherchée en chimie car la séparation des deux énantiomères est très difficile. La politique actuelle est donc de ne fabriquer qu'un seul des deux énantiomères. Nous allons étudier dans cette partie la réaction suivante : H C CH H CHz OH (+)--tartrate de diéthyle H3 .. .|C3I12 OH ___--___, la . | ' ' H3 C: :CH3 T1(Oin)4 , tBuOOH 0 rendement 77% Le mécanisme proposé pour cette réaction est le suivant : H CH20H EtOOC Ô\@OOEt >=< + tBuOOH + __) H3 C CH3 O\ /O _ Ti H 3 C CH3 EtOOC \\CÛÛEt HHH"CHZOH + tBuOH + : \ ___--> 0 O\/0 Ti 12 -- Pour fabriquer le catalyseur à base de titane intervient le (+)-tartrate de diéthyle. Que signifie le (+) du (+)--tartrate de diéthyle '? La structure de la molécule est la suivante : HO on EtOOC'H"H H coca _ Quel est le nom de cette molécule en nomenclature officielle ? Page 5 / 6 _ Tournez la page S.V.P. ' Donner la configuration absolue du ou des carbones asymétriques en la justifiant. On se propose de préparer le réactif de départ : H CH2 OH >=< H3C CH3 13 -- On effectue la bromation du but--2--ène. De quel stéréoisomère du but--2-ène faut-il partir pour obtenir un seul composé, méso, noté A ? Vous justifierez votre réponse en écrivant le mécanisme. 14 --- Le composé A est soumis à un équivalent de soude concentrée à chaud. On obtient un composé B. De quelle réaction s'agit--il ? Ecrire le mécanisme de cette réaction et donner la structure du composé B. 15 -- On fait réagir B avec du magnésium dans de l'éther anhydre. On obtient le composé C suivant : H MgBr >=---< H 3 C CH3 On donne les électronégativités suivantes : C : 2,5 0 : 3,4 Mg: 1,3 Quelle est la polarité de la liaison C-Mg ? Comment se comporte le composé C (électrophile ou nucléophile) ? 16 --- On fait réagir C sur le méthanal CH20. Donner une représentation de Lewis du méthanal ainsi que sa géométrie. Quel est le site électrophile du méthanal '? Après hydrolyse on obtient le composé recherché : H cr1,ou >=< H3C CH3 Quel est le type de réaction que l'on a effectué en faisant réagir C sur le méthanal ? 17 -- On effectue, comme indiqué plus haut, l'époxydation asymétrique : H CH OH _ ., H3C CH3 : : 2 (+) tartrate de d1ethyle H"'l-. ,'.mCH2 OH Ti(OiPr)4 , tBuOOH H3 C CH3 () ' rendement 77% excès énantiomérique 94% Donner la configuration absolue du ou des carbones asymétriques de l'époxyde final en la justifiant. FIN DE L'EN ON CE FIN DE L'EPREUVE. Page6/6
