CCINP Modélisation de systèmes physiques ou chimiques PC 2020
| Thème de l'épreuve | Calcul de la contribution de la rotation interne du groupe méthyle à l'entropie de la molécule d'éthane |
| Principaux outils utilisés | chimie organique, mécanique quantique, analyse numérique |
| Mots clefs | chimie, équation de Schrödinger, mécanique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
SESSION 2020 C PCSMO
CONCOURS
COMMUN
INP
ÉPREUVE MUTUALISÉE AVEC E3A-POLYTECH
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC
MODÉLISATION DE SYSTÈMES PHYSIQUES OU CHIMIQUES
Mercrediémai:8h-12h
N.B. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa copie
et devra poursuivre sa composition en expliquant les raisons des initiatives
qu'il a êté amené à prendre.
RAPPEL DES CONSIGNES
«_ Utiliser uniquement un stylo noir ou bleu foncé non efjaçable pour la
rédaction de votre composition ; d'autres
couleurs, excepté le vert, peuvent être utilisées, mais exclusivement pour les
schémas et la mise en évidence
des résultats.
° Ne pas utiliser de correcteur.
«_ Écrire le mot FIN à la fin de votre composition.
Les calculatrices sont autorisées
Le sujet est composé de deux parties (pages 1 à 13)
et d'une annexe (pages 14 à 15).
1/15
Calcul de la contribution de la rotation interne du groupe méthyle
à l'entropie de la molécule d'éthane
Présentation du problème
Le calcul des propriétés chimiques de systèmes moléculaires est aujourd'hui
facilité par le
développement de logiciels basés sur les lois fondamentales de la mécanique
quantique. Ce type de
logiciels permet par exemple de trouver la géométrie pour laquelle l'énergie
d'une molécule est
minimale, de calculer son énergie et ses fréquences de vibration.
Même s1 la plupart des étapes de calcul des données thermodynamiques des
molécules sont
automatisées, 1l est parfois nécessaire de réaliser des corrections
manuellement pour obtenir des
valeurs en accord avec l'expérience.
C'est le cas lorsque l'on souhaite calculer précisément la valeur de l'entropie
d'une molécule qui
possède des groupes méthyles. Une des molécules se trouvant dans ce cas est la
molécule d'éthane
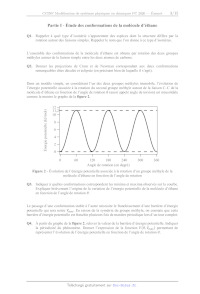
(C2H6) dont la structure est donnée à la figure 1.
Figure 1 - Structure de la molécule d'éthane
La rotation du groupe méthyle autour de la liaison entre les deux atomes de
carbone peut être
représentée par différents modèles simples. Le choix du modèle est dicté par la
hauteur de la barrière
d'énergie potentielle à franchir lors de la rotation du groupe méthyle autour
de la liaison entre les
deux atomes de carbone. Parmi ces modèles, on trouve celui de la rotation
libre, le modèle de
l'oscillateur harmonique et le modèle de la rotation empêchée.
La première partie de l'épreuve concerne l'étude des conformations de l'éthane.
Une attention
particulière est portée aux informations que l'on peut tirer de l'évolution de
l'énergie potentielle
associée à la rotation du groupe méthyle. La partie suivante est relative au
calcul de la contribution
de la rotation interne du groupe méthyle à l'entropie de la molécule d'éthane
en considérant différents
modèles pour représenter la rotation.
2/15
Partie I - Étude des conformations de la molécule d'éthane
Q1. Rappeler à quel type d'isomérie s'apparentent des espèces dont la structure
diffère par la
rotation autour des liaisons simples. Rappeler le nom que l'on donne à ce type
d'isomères.
L'ensemble des conformations de la molécule d'éthane est obtenu par rotation
des deux groupes
méthyles autour de la liaison simple entre les deux atomes de carbone.
Q2. Donner les projections de Cram et de Newman correspondant aux deux
conformations
remarquables dites décalée et éclipsée (en précisant bien de laquelle 1l
s'agit).
Dans un modèle simple, en considérant l'un des deux groupes méthyles immobile,
l'évolution de
l'énergie potentielle associée à la rotation du second groupe méthyle autour de
la liaison C--C de la
molécule d'éthane en fonction de l'angle de rotation @ (aussi appelé angle de
torsion) est sinusoïdale
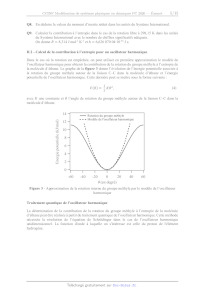
comme le montre le graphe de la figure 2.
12 --
= 112 -- -- _------ _---- -- __-- -
É 10-
--,
LÉ
» Ô--
S
E 6-
a
2, 4--
oO
EE
oO
S
En 0 2
| | | | | | |
0 60 120 180 240 300 360
Angle de rotation (en degré)
Figure 2 - Évolution de l'énergie potentielle associée à la rotation d'un
groupe méthyle de la
molécule d'éthane en fonction de l'angle de rotation
Q3. Indiquer à quelles conformations correspondent les minima et maxima
observés sur la courbe.
Expliquer brièvement l'origine de la variation de l'énergie potentielle de la
molécule d'éthane
en fonction de l'angle de rotation 6.
Le passage d'une conformation stable à l'autre nécessite le franchissement
d'une barrière d'énergie
potentielle qui sera notée V,,,4. En raison de la symétrie du groupe méthyle,
on constate que cette
barrière d'énergie potentielle est franchie plusieurs fois de manière
périodique lors d'un tour complet.
Q4. À partir du graphe de la figure 2, relever la valeur de la barrière
d'énergie potentielle. Indiquer
la périodicité du phénomène. Donner l'expression de la fonction V(8,V...,,)
permettant de
représenter l'évolution de l'énergie potentielle en fonction de l'angle de
rotation 6.
3/15
Partie II - Contribution de la rotation interne du groupe méthyle à l'entropie
de
la molécule d'éthane
Comme indiqué dans l'introduction, la rotation interne du groupe méthyle par
rapport à l'autre
apporte une contribution à l'entropie de la molécule d'éthane. Le calcul de
cette contribution dépend
du type de rotation considérée. On distingue deux cas :
e la rotation est libre. C'est le cas si l'énergie potentielle V,.,, (en joule
par molécule) est
inférieure au produit k£ X T où kg est la constante de Boltzmann et T la
température ;
e la rotation est empêchée. C'est le cas si VW... est supérieure au produit kg
XT.
Q5. Conclure quant à la liberté de la rotation à très basse température, 100 K,
puis à très haute
température : 2 000 K. On donne kg = 1,380 648 52-10 J K'! et la constante
d'Avogadro
Na = 6,022-10** mol!.
IL.1 - Calcul de la contribution à l'entropie pour une rotation libre
Dans le cas d'une rotation libre, le calcul de la contribution de la rotation
interne à l'entropie S,; peut
être effectué dans le cadre d'un modèle simple. Le résultat dépend d'un petit
nombre de paramètres :
S.=R F ln (meet )| ()
avec R la constante des gaz parfaits, h la constante de Planck, 6;,+ le nombre
de symétries internes
du groupe méthyle égal à 3 et /;,. le moment d'inertie réduit du groupe méthyle
en rotation par rapport
à l'autre groupe méthyle. Rappelons que l'expression du moment d'inertie réduit
est :
TA XIB
Ia +1p°
(2)
lat --
avec JA et IR les moments d'inertie des deux groupes méthyles (on a J/1 = 18
dans le cas de l'éthane).
Le moment d'inertie du groupe méthyle en rotation autour de l'axe matérialisé
par la liaison entre les
deux atomes de carbone de la molécule d'éthane est :
Î = > Cm; X ré), (3)
avec M, la masse de l'atome ; et r;, la distance entre l'atome ; et sa
projection orthogonale sur l'axe
de rotation du groupe méthyle considéré.
Q6. Expliquer pourquoi la contribution de l'atome de carbone au moment
d'inertie du groupe
méthyle en rotation autour de la liaison matérialisée par les deux atomes de
carbone de la
molécule d'éthane est nulle.
Q7. Calculer le moment d'inertie (dans les unités du Système International)
pour un groupe méthyle
à partir des données suivantes :
© masse d'un atome d'hydrogène : 1,673 7:10' kg
© longueur des liaisons C-H : 0,109 4 nm
© valeur des angles C---C-H : 111,4°
4/15
Q8. En déduire la valeur du moment d'inertie réduit dans les unités du Système
International.
Q9. Calculer la contribution à l'entropie dans le cas de la rotation libre à
298,15 K dans les unités
du Système International avec le nombre de chiffres significatifs adéquats.
On donne R = 8,314 J mol'! K'! et h = 6,626 070 04-10 * Js.
IL.2 - Calcul de la contribution à l'entropie pour un oscillateur harmonique
Dans le cas où la rotation est empêchée, on peut utiliser en première
approximation le modèle de
l'oscillateur harmonique pour obtenir la contribution de la rotation du groupe
méthyle à l'entropie de
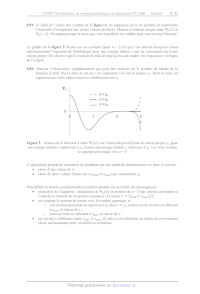
la molécule d'éthane. Le graphe de la figure 3 donne l'évolution de l'énergie
potentielle associée à
la rotation du groupe méthyle autour de la liaison C---C dans la molécule
d'éthane et l'énergie
potentielle de l'oscillateur harmonique. Cette dernière peut se mettre sous la
forme suivante :
V (0) = = KO? (4)
avec K une constante et O0 l'angle de rotation du groupe méthyle autour de la
liaison C--C dans la
molécule d'éthane.
14 -- ------ Rotation du groupe méthyle
pen --- Modèle de l'oscillateur harmonique
s 12-- , ,
E y 1
SG 10 E \ r
5 4 :
g 8-
5
8 0--
S.
D
Vi
OU
n 2-
0 | | | | | |
-60 -40 -20 0 20 40 60
O (en degré)
Figure 3 - Approximation de la rotation interne du groupe méthyle par le modèle
de l'oscillateur
harmonique
Traitement quantique de l'oscillateur harmonique
La détermination de la contribution de la rotation du groupe méthyle à
l'entropie de la molécule
d'éthane peut être réalisée à partir du traitement quantique de l'oscillateur
harmonique. Cette méthode
nécessite la résolution de l'équation de Schrüdinger dans le cas de
l'oscillateur harmonique
unidimensionnel. La fonction d'onde à laquelle on s'intéresse est celle du
proton de l'élément
hydrogène.
5/15
L'équation de Schrüdinger stationnaire en coordonnées cylindriques peut se
mettre sous la forme
suivante :
h2
-- -- AY + V(8)Y = EY, (5)
2m
avec m la masse d'un atome d'hydrogène, ñ la constante de Planck réduite (h =
h/27), Y la fonction
d'onde associée à un état propre, E la valeur propre associée et V(@) l'énergie
potentielle à laquelle
est soumise l'atome d'hydrogène lorsque le groupe méthyle tourne autour de la
liaison C--C dans la
molécule d'éthane (E et V(8) sont exprimées en joule, @ est l'angle de de
rotation). AY est le
Laplacien de la fonction d'onde Y dont l'expression en coordonnées cylindriques
est :
1 0 f_ 0Y 1 0°Y 9?
At r Ôr (r ) + r2 002 972 (6)
Q10. Simplifier l'expression du Laplacien de la fonction d'onde dans le cas de
la rotation d'un atome
d'hydrogène autour de l'axe matérialisé par la liaison entre les deux atomes de
carbone
confondu avec l'axe (0Z) dans un repère (0,r,0,z). On supposera que le groupe
méthyle est
indéformable lors de sa rotation autour de l'axe (0Z). Donner alors
l'expression de l'équation
de Schrüdinger stationnaire en coordonnées cylindriques, que l'on mettra sous
la forme :
GY =[E ---V(8)|#.
avec G un opérateur dont l'expression est à déterminer et V(@) l'énergie
potentielle donnée par
l'équation (4).
Pour simplifier la résolution de l'équation simplifiée tirée de l'équation (6),
on souhaite la réécrire
sous la forme adimensionnelle suivante :
02
0 2
= _2 Le _ se? w. (7)
, [mc | K
avec EUR un paramètre discuté plus loin, £ = FE rô et w -- ne OÙ & est la
pulsation propre de
l'oscillateur.
Q11. Établir l'expression du paramètre £ qui intervient dans la forme
adimensionnelle de l'équation
de Schrüdinger (équation (7)) et déterminer sa dimension.
Q12. Donner la dimension de EUR. Dans la suite, EUR sera appelée abscisse
réduite et sera notée x.
Résolution numérique par la méthode de Numerov
On peut résoudre numériquement l'équation (7) pour trouver les valeur de Y pour
le niveau d'énergie
E£ par la méthode de Numerov. Il s'agit d'une méthode permettant de réaliser
l'intégration d'équations
différentielles ordinaires du deuxième ordre de la forme :
2
à
K
= = --g(x)yCx) + s(x). (8)
à
X
6/15
Q13. Donner les expressions des fonctions g(x), y(x) et s(x) en procédant par
identification à partir
des équations (7) et (8).
Pour discrétiser l'équation différentielle (8), on effectue des développements
limités. L'intervalle des
abscisses x est divisé en un nombre fini de points régulièrement espacés de Ax,
le pas d'espace. On
utilisera l'indice i pour repérer la position des différents points sur
l'abscisse discrétisée.
Q14. Donner les étapes permettant d'obtenir l'expression discrétisée suivante
(équation (9)) en
précisant à quel ordre ont été effectués les développements limités :
(Ax)*
12 ?
III
Vixa + Via = 2Y + Yi X (Ax) + y" x (9)
avec x; l'abscisse au point i, y,,, = y(x; +Ax) et y,_, = y(x; -- Ax) pour Ax
petit,
d?y d*y
11 _ NIIT --
Y"(x) = due et y"""(x) De
Pour simplifier l'équation (9), on pose À; = y;'.
Q15. Montrer, en précisant les étapes intermédiaires, que l'on peut exprimer
y;'" de la façon
suivante :
LIT Ajyitdi 1 22; 10
Vi EE (Ax)2 ' ( )
L'équation (9) peut se mettre sous la forme factorisée suivante (équation (11))
où a et b sont des
scalaires et g; une fonction de y; et À;dont l'expression est obtenue à partir
de l'équation (8) :
(ax)? (Ax)? (Ax)2
Vi+1 (1 Tax ÿix: =) = 2y; (1 -- bX g; =) -- V;i_4 (1 +aX g;i-: --). (11)
Q16. À l'aide de l'équation (8), donner l'expression de g; en fonction de À, et
y;. Déterminer les
valeurs des scalaires a et b.
. vu Ax)?
D'un point de vue pratique, on introduit une fonction intermédiaire f telle que
: f; = 1 + g; D
Q17. Démontrer alors la formule de récurrence suivante :
(12-10, p ii
Vi+1 -- (12)
J'iti
L'intégration de l'équation (8) à l'aide de la formule de récurrence (12)
établie à la question
précédente nécessite de connaître les valeurs des premiers termes de la suite :
y, et y. Les valeurs
de ces deux paramètres seront discutées plus loin. Pour résoudre numériquement
l'équation (7) par la
méthode de Numerov, on prendra g; = 2 Le -- x? | avec EUR le paramètre de
l'équation (7) dont
l'expression est établie à la Q11.
7/15
Algorithme général de résolution du problème
Note : les codes numériques demandés au candidat devront être réalisés dans le
langage Python.
On supposera la bibliothèque « numpy » chargée. Une annexe présentant les
fonctions usuelles de
Python est disponible pages 14 et 15. Les commentaires suffisants à la
compréhension du programme
devront être apportés et des noms de variables explicites devront être utilisés
lorsque ceux-c1 ne sont
pas IMpPOsés.
Pour résoudre numériquement ce problème et obtenir simultanément les valeurs de
la fonction d'onde
Y, (x) et l'énergie réduite £,, correspondant à l'état quantique n, (n est un
entier positif ou nul), on
souhaite développer une méthode par dichotomie pour approcher la valeur de
l'énergie réduite &,.
Il existe des fonctions d'onde W(x) satisfaisant à l'équation (7) pour toute
valeur de £. Cependant
toutes ne vérifient pas les conditions aux limites. Les conditions aux limites
ne sont satisfaites que
pour un ensemble discret de valeurs de EUR.
Les solutions discrètes sont repérées par un indice n qui représente le nombre
de zéros de la fonction
(défini comme le nombre de points d'intersection entre la fonction d'onde et
l'axe des abscisses). Il
est donc nécessaire de trouver une condition permettant de s'assurer que la
fonction d'onde puisse
satisfaire les conditions aux limites et donc que l'énergie obtenue corresponde
bien à un état
quantique. Cette condition peut porter par exemple sur le nombre de noeuds de
la fonction d'onde
W, (x).
Q18. À partir de l'allure des fonctions d'onde Y, (x) associées aux premiers
niveaux d'énergie de
l'oscillateur harmonique quantique unidimensionnel de la figure 4, déterminer
la condition
portant sur le nombre de noeuds de la fonction d'onde W, (x) qui doit être
satisfaite pour une
énergie réduite £, (on supposera par la suite que cette condition est valable
pour tout niveau
d'énergie).
Po ÿ, À
6 + 2 0 2 sl 6
X
Y;
6 À -2 ) 2 { 6
X
Figure 4 - Allure des fonctions d'onde W, (x) associées aux premiers niveaux
d'énergie de
l'oscillateur harmonique quantique unidimensionnel
8/15
Q19. À l'aide de l'allure des courbes de la figure 4, on supposera qu'il est
possible de restreindre
l'intervalle d'intégration aux seules valeurs positives. Donner la relation
unique entre W,, (x) et
YW,(--x). On supposera par la suite que cette hypothèse est valable pour tout
niveau d'énergie.
Le graphe de la figure 5 illustre sur un exemple (pour n = 2) ce que l'on
obtient lorsqu'on résout
numériquement l'équation de Schrôüdinger pour une énergie réduite £ qui ne
correspond pas à une
valeur propre. On observe que la fonction d'onde diverge au lieu de tendre vers
0 quand on s'éloigne
de l'origine.
Q20. Préciser l'observation supplémentaire qui peut être réalisée sur le nombre
de noeuds de la
fonction d'onde W, (x) dans le cas où EUR est supérieure à la valeur propre
EUR. Dans la suite, on
supposera que cette observation est valable pour tout n.
P2
£ > E)
mm-- É=E)
E, pour
une énergie réduite & supérieure à &, et pour une énergie réduite EUR
inférieure à &,. Les trois courbes
se superposent Jusque vers x -- 5
L'algorithme général de résolution du problème par une méthode dichotomique est
donc le suivant :
e choix d'une valeur de n ;
e choix de deux valeurs limites de EUR (£,nin EURt Emax) qui contiennent EUR.
Puis débute la boucle conditionnelle (condition portant sur un critère de
convergence) :
e résolution de l'équation : intégration de W, (x) en partant de x = 0 par
valeurs croissantes à
l'aide de la formule de récurrence (équation (12)) pour £ = (Erin + Emax)/2 ;
e on compare le nombre de noeuds avec le nombre quantique n :
o s1le nombre de noeuds est supérieur à n, alors £ > EUR, et dans ce cas on
1tère en affectant
À Emax la valeur de EUR ;
o sinon on itère en affectant à &5 la valeur de EUR ;
e on calcule la différence entre £a et Emin. S1 celle-c1 est inférieure au
critère de convergence
choisi suffisamment petit, on arrête les itérations.
9/15
Codage de l'alsorithme
Pour réaliser l'intégration numérique de l'équation (7), 1l faut tout d'abord
définir Ax le pas
d'intégration. L'abscisse réduite est comprise entre les valeurs xmin -- 0 et
xmax -- 6. On souhaite
diviser le segment en 100 intervalles de même longueur. On appelle imax le
nombre de valeurs des
abscisses comprises entre xmin et xmax.
Q21. Donner la valeur numérique de imax. Donner ensuite le code permettant de
calculer le pas de
position Ax (noté dx) en fonction de xmin, xmax et imax.
Q22. Donner le code permettant de calculer les valeurs du vecteur xmesh qui
contient les valeurs des
abscisses réduites et du vecteur vpot qui contient les valeurs du potentiel V;
= V(x;) = 0,5 x{
pour chaque pas d'intégration.
L'intégration numérique de l'équation de Schrüdinger nécessite le choix des
valeurs des termes y, et
y. Celui-ci dépend de la parité de la fonction d'onde Y, (x) :
e sin est impair, alors y, = 0 et y, peut prendre n'importe quelle valeur finie
(on prendra pour
le code y: = 1) ;
e sin est pair, alors y, peut prendre n'importe quelle valeur finie (on prendra
pour le code
12-10
Yo = 1) et y. est obtenu par la formule de Numerov (équation (12)) : y = ee
1
(12---10f5)Yo
2 fi
Q23. Démontrer l'expression y: = dans le cas où n est pair.
On suppose dans la suite que le nombre quantique n a déjà été défini par
l'utilisateur. On note nodes
la variable correspondant au nombre quantique n qui est aussi le nombre de
noeuds de la fonction
d'onde et y le vecteur contenant les valeurs de la fonction d'onde. On suppose
également que les
valeurs E;nin EURt EmAx Ont été définies (elle seront notées emin et emax). On
prendra &,,;5, = 0 et pour
Emax la Valeur maximale du vecteur vpot.
Q24. Écrire le code de la fonction calcul f(e) qui permet de calculer et de
retourner les valeurs
de la fonction f de l'algorithme de Numerov pour chaque valeur de x. La
variable e correspond
à l'énergie réduite EUR.
On souhaite maintenant développer une fonction calcul _ y noeuds (nodes,f) qui
renvoie y le
vecteur contenant les valeurs de la fonction d'onde et neross le nombre de
noeuds. Sa structure est
fournie dans le code suivant (page 11), 1l est incomplet et les portions à
compléter sont demandées
dans les questions suivantes.
10/15
#Fonction ayant pour objet de calculer les valeurs de la fonction
d'onde et du nombre de noeuds
def
calcul y noeuds (nodes, £) :
#Calcul des valeurs initiales y0 et y1
#finitialisation de la variable y
RS
#Nombre pair de noeuds
LÉ == nodes :
YIO] =
VIII] =
#Nombre impair de noeuds
else:
YIOI] =
VII] =
#Intégration et comptage du nombre de noeuds
#finitialisation de la valeur de ncross
#Boucle de calcul des valeurs de y et du nombre de noeuds
for i in range ( ) :
#Calcul la valeur de yfi]
YII] =
#Calcul du nombre de noeuds
#Arguments de sortie de la fonction calcul y noeuds
return
Q25.
Q26.
On souhaite que le comptage du nombre de noeuds, neross, soit intégré à la
boucle de calcul
des valeurs de la fonction d'onde y. Donner une méthode simple permettant de
réaliser le
comptage (le code n'est pas demandé dans cette question).
Recopier et compléter le code de la fonction calcul y noeuds (nodes,f) fourni.
Les
informations manquantes et attendues concernent :
linitialhisation de la variable y ;
le calcul des valeurs initiales y [0] et y[1] avec la condition permettant de
considérer le cas
pair ;
l'initialisation de la variable neross :
les instructions de début et de fin pour la boucle de calcul des valeurs de y
et du nombre de
noeuds :
le calcul des valeurs y[i] ;
le calcul du nombre de noeuds ;
les arguments de sortie de la fonction calcul y noeuds.
Pour obtenir une valeur de £&, suffisamment précise par dichotomie, 1l est
nécessaire d'intégrer les
fonctions calcul f(e) etcalcul y noeuds (nodes,f) dans une boucle de type «
while » avec
une condition portant sur un critère de convergence. La condition de
convergence porte sur la
différence Emax -- Emin qui doit être inférieure à une valeur suffisamment
petite, par exemple 10°!°.
11/15
Q27. On suppose que la valeur de neross a été calculée dans les étapes
précédentes du code. Donner
l'algorithme (le code est demandé à la question suivante) permettant de
calculer la valeur de &,
notée e pour l'itération suivante et la valeur du critère de convergence, noté
critere.
Q28. Donner le code correspondant à la boucle permettant d'obtenir la valeur de
£&,, par dichotomie.
Elle doit faire intervenir les deux fonctions calcul f(e) etcalcul y noeuds
(nodes, f).
La résolution numérique de l'équation de Schrôdinger stationnaire pour
l'oscillateur harmonique
donne les valeurs suivantes pour les niveaux d'énergie (tableau 1) :
Niveau n Energie EUR, (sans dimension)
0 0,5
l 1,5
2 2,5
3 3,5
4 4,5
5 5,5
Tableau 1 - Évolution de l'énergie &, en fonction de n.
Q29. Proposer une expression permettant de déterminer la valeur de &, en
fonction de n pour tout n
compris entre 0 et 5.
Le calcul de l'entropie à partir des énergies déterminées précédemment ne sera
pas abordé 1c1. La
contribution que l'on obtiendrait à la température de 298,15 K serait égale à
6,1 J mol! K'!.
IL.3 - Comparaison des différents traitements de la rotation interne du groupe
méthyle
Le tableau 2 donne les valeurs de la contribution de la rotation du groupe
méthyle à l'entropie de la
molécule d'éthane pour les différents modèles et pour plusieurs températures.
Les modèles utilisés
pour le calcul sont le modèle de la rotation libre, celui de l'oscillateur
harmonique et celui de la
rotation empêchée qui correspond à la résolution de l'équation de Schrôdinger
avec le potentiel V
déterminé à la question Q4.
Température 100 K 298,15 K 500 K 1 000 K
Modèle de l'oscillateur harmonique 0,7 6,1 10,0 15,6
Modèle de la rotation libre 7,5 12,0 14,2 17,1
Modèle de la rotation empêchée 0,7 6,8 11,2 16,1
Tableau 2 - Valeurs de la contribution de la rotation du groupe méthyle à
l'entropie de la molécule
d'éthane (unité : J mol! K.
Q30. Commenter l'évolution globale avec la température de la contribution de la
rotation du groupe
méthyle à l'entropie de la molécule d'éthane. Justifier de manière qualitative
la tendance
observée.
12/15
Q31.
Q32.
En admettant que le modèle de la rotation empêchée fournit la meilleure
estimation de la
contribution de la rotation du groupe méthyle à l'entropie de la molécule
d'éthane quelle que
soit la température, émettre des recommandations quant à la possible
utilisation des deux autres
modèles.
Justifier de manière qualitative l'ordre des valeurs de la contribution de la
rotation du groupe
méthyle à l'entropie de la molécule d'éthane obtenue pour les trois modèles
(S,;(rotation libre) > S,;(rotation empêchée) > S,;(oscillateur harmonique)).
13/15
ANNEXE
Fonctions de Python
Bibliothèque numpy de Python
Dans les exemples ci-dessous, la bibliothèque numpy a préalablement été
importée à l'aide de la
commande : import numpy as np.
On peut alors utiliser les fonctions de la bibliothèque, dont voici quelques
exemples :
np.array(liste)
Description : fonction permettant de créer une matrice (de type tableau) à
partir d'une liste.
Argument d'entrée : une liste définissant un tableau à 1 dimension (vecteur) ou
2 dimensions
(matrice).
Argument de sortie : un tableau (matrice).
Exemples : np.array([4,3,2])
D [43 2]
np.array([[5],[71,[111)
D [[]
[7]
[1]]
np.array([[3,4,10],[1,8,7]1)
oe [[3 410]
[187]
AT, j].
Description : fonction qui retourne l'élément (i + 1,j + 1) de la matrice À.
Pour accéder à
l'intégralité de la ligne i+1 de la matrice À, on écrit A{i,: |. De même, pour
obtenir toute la
colonne j+1 de la matrice À, on utilise la syntaxe A{:, j|.
Arguments d'entrée : une liste contenant les coordonnées de l'élément dans le
tableau À.
Argument de sortie : l'élément (i + 1,j + 1) de la matrice À.
ATTENTION : en langage Python, les lignes d'un tableau À de dimension n X m sont
numérotées de 0 à n -- 1 et les colonnes sont numérotées de 0 à m -- 1
Exemple : A=nparray(|[3,4,10],[1,8,7]1])
AT0,2]
D 10
A[1,:]
D [1 87]
A[:2]
oe [10 7]
14/15
np.zeros((n,m))
Description : fonction créant une matrice (tableau) de dimensions n x m dont
tous les
éléments sont nuls.
Arguments d'entrée : un tuple de deux entiers correspondant aux dimensions de
la matrice à
créer.
Argument de sortie : un tableau (matrice) d'éléments nuls.
Exemple : np.zeros((3,4))
D [[00001]
[0 0 0 0]
[0 0 0 01]
np.linspace(Min,Max,nbElements)
Description : fonction créant un vecteur (tableau) de nbElements nombres espacés
régulièrement entre Min et Max. Le 1% élément est égal à Min, le dernier est
égal à Max et
les éléments sont espacés de (Max -- Min)/(nbElements -- 1).
Arguments d'entrée : un tuple de 3 entiers.
Argument de sortie : un tableau (vecteur).
Exemple : np.linspace(3,25,5)
D [3 8.5 14 19.5 25]
np.loadtxt('nom fichier',delimiter=--"'string*,usecols=[n])
Description : fonction permettant de lire les données sous forme de matrice
dans un fichier
texte et de les stocker sous forme de vecteurs.
Arguments d'entrée : le nom du fichier qui contient les données à charger, le
type de caractère
utilisé dans ce fichier pour séparer les données (par exemple un espace ou une
virgule) et le
numéro de la colonne à charger (ATTENTION, la première colonne porte le numéro
0).
Argument de sortie : un tableau.
Exemple : data=np.loadtxt('fichier.txt",delimiter--" ',usecols=[0])
dans cet exemple data est un vecteur qui correspond à la première #colonne
de la matrice contenue dans le fichier 'fichier.txt'.
FIN
15/15
