X/ENS Chimie PC 2017
| Thème de l'épreuve | Le glucose en synthèse et chimie des polymères. Intérêt des tensioactifs en analyse et en synthèse. |
| Principaux outils utilisés | chimie organique, polymères, solutions aqueuses |
| Mots clefs | glucose, acétate de cellulose, cellulose, tensioactif, micelle, émulsion |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
Énoncé complet
(télécharger le PDF)















Rapport du jury
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
ÉCOLE POLYTECHNIQUE _ ÉCOLES NORMALES SUPÉRIEURES
ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2017 FILIÈRE PC
COMPOSITION DE CHIMIE A -- (XEULC)
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée pour cette épreuve.
Les deux problèmes proposés sont totalement indépendants.
* * *
Premier problème
Le glucose en synthèse et chimie des polymères
Les sucres sont des molécules organiques constituées d'une chaîne carbonée
porteuse de groupements
hydroxyles et de groupements aldéhyde, cétone, carboxyle ou amide. Ce sont les
biomolécules les plus
abondantes sur Terre et elles possèdent un rôle capital. Elles constituent
ainsi la principale source d'énergie
dans l'alimentation, participent au bon fonctionnement du corps humain et
structurent la paroi cellulaire
des végétaux et des bactéries ainsi que celle des tissus conjonctifs et
cellulaires des animaux. Parmi les sucres,
dans la famille des oses de formule brute C.,H2...O... le glucose occupe une
place particulière car il s'agit de la
molécule dont les cellules du corps humain ont besoin en permanence. Le glucose
s'avère de plus
extrêmement intéressant en synthèse organique car il est peu coûteux, non
toxique, et énantiomériquement
pur. Il peut donc constituer un synthon de choix pour l'obtention de molécules
naturelles ou être la brique
de base de composés naturels telle la cellulose par exemple. La synthèse
organique fait aujourd'hui
largement appel à la chimie des sucres avec des applications dans divers
domaines : synthèse asymétrique,
chimie pharmaceutique, biologie, chimie supramoléculaire, polymères...
Un soin particulier est attendu dans l'écriture des mécanismes réactionnels ;
les formules utilisées dans
les réponses aux questions de cette partie portant un astérisque (* ) après le
numéro devront obligatoirement
être des représentations topologiques et faire apparaître les doublets non
liants et les formes mésomères des
intermédiaires réactionnels s'il y a lieu. Une représentation simplifiée des
molécules peut être utilisée dans
l'écriture des mécanismes réactionnels mais doit être clairement explicitée.
Données :
. pKA: Hg/HÎ (35), RC(O)NH2/RC(O)NHÎ (17), ROH/ROÎ (16-18), R2NH/R2NÏ (25),
HgPO4/HgPO4" (2,2) et RNI--Iÿ/RNI-h (9,0).
. MN--diméthylformamicle : DMP.
Des tables IR et RMN du proton sont données en annexe 1 (page 9).
1
1. Étude du glucose
Le glucose en solution aqueuse est présent sous plusieurs formes en équilibre:
la forme en chaîne
ouverte et deux formes cycliques à 6 chaînons appelées pyranoses (formes et et
B, représentées sur la
Figure 1). Ces formes cycliques sont majoritaires (: 99 %) en comparaison de la
forme ouverte (0,002 %).
o 1 OH
o 1_\\OH OH OH HO
HO
. . : Ho&/H/l\ÿo <----' HO" 2"OH ôH OH HO 2 OH OH OH a-D-glucopyranose Forme ouverte du D-glucose B-D-glucopyranose Figure 1 : Équilibres entre les différentes formes du D-glucose. 1.1 Les oses sont aussi appelés hydrates de carbone. Proposer une explication. 1.2 Écrire les deux représentations chaises conformères l'une de l'autre de l'OL-- puis du B-D- glucopyranose. Indiquer en le justifiant la conformation la plus stable dans chaque cas. Discuter la stabilité relative des formes et et B--D-glucopyranose. La dissolution d'une masse de 1 g de cristaux d'a--D--glucopyranose ou de B--D-glucopyranose dans un même volume d'eau donne initialement des solutions de pouvoir rotatoire respectivement égal à 112 ° et 18,7 °. Après une durée de 3 h, on obtient dans les deux cas une solution notée 81 dont le pouvoir rotatoire et est égal à 52,7 °. Les valeurs de pouvoir rotatoire sont données à 25 °C, pour la raie D du sodium et pour une cuve de 10 cm de longueur. Si le milieu est acide, l'équilibre est atteint au bout de quelques minutes. La présence de la forme ouverte du glucose en solution est négligée dans la suite (questions 1.3 à 1.7). 1.3 Rappeler la loi de Biot. Donner l'unité et la signification des différents termes de cette loi. 1.4 Décrire en quelques lignes et grâce à un schéma le dispositif expérimental qui permet de déterminer l'activité optique d'une solution. 1.5 (*) Proposer un mécanisme pour la réaction ayant lieu en milieu acide permettant d'expliquer les résultats expérimentaux pour l'OL-D-glucopyranose. 1.6 Nommer la réaction précédente et justifier son caractère renversable. 1.7 Estimer la proportion de chacune des formes et et B dans la solution S]. Discuter ce résultat au regard de la réponse à la question 1.2. 2. Utilisation du glucose comme précurseur en synthèse organique 2.1 Préparation d'une copule chimie Le 3,4,6-tri-O--acétyl--D-glucal (Cul--11607) peut être obtenu à partir du D--glucose puis conduire par une suite de réactions décrites sur le Schéma 1 au composé noté A qui peut servir de réactif chiral en synthèse stéréosélective : on parle de copule chirale. _» ACO 7 O D-glucose --> &» 1 "_, K
\" 2. MeONa/MeOH w
A \\ \" \\
CO 3. Hydrolyse (Cel--11204) Ph O
CAC 90 % 2 OH
3,4,6-tri-O--acétyl-D-glucal
Ph-CHfir/NaH/DMF
95 %
"COCVEÏ3N H2, Pd/C PivCl/pyridine (excès) CH3COOH/HZO
83 % 97 % 97 % 78 %
pyridine 0 0
; OÊ N\ )i\ H3C' À *
: H30 0 H c'ç Cl ;
i i / 3 CH3 ;
; Ph--Ë AcO--â PivCl .
Schéma ] : Synthèse du composé A à partir du D--glucose.
2.1.1 Ecrire la structure du composé ] en représentation de Gram. Donner le nom
des deux
premières réactions mises en jeu pour obtenir le composé 1.
2.1.2 (*) Proposer des conditions opératoires et un réactif pour le passage du
composé ] au composé
2 en précisant le nom de la réaction mise en jeu et le mécanisme de cette
dernière. On ne tient
pas compte ici de la stéréochimie de la réaction.
2.1.3 Indiquer le descripteur stéréochimique acétalique du composé 2.
2.1.4 Donner la structure des composés 3 à 6 en représentation de Gram.
2.1.5 Donner le rôle et la nature des réactions mises en jeu dans chacune des
étapes permettant de
passer du composé 2 à A.
2.1.6 (*) Proposer un mécanisme de formation du composé 3 à partir du composé 2.
2.1.7 (*) Proposer un mécanisme de formation du composé 5 à partir du composé
4. Préciser le(s)
rôle(s) de la pyridine.
Le composé A peut notamment s'avérer particulièrement intéressant en synthèse
stéréosélective dans le
cas d'une réaction de Diels-Alder. Nous proposons ici d'étudier la réaction
entre A et deux diènes : le penta--
1,3-diène et le 1-méthoxybuta-l,3-diène. Dans les deux cas, on obtient
majoritairement un composé que
l'on notera B (Figure 2) pour le penta-l,3-diène et C pour le
1--méthoxybuta--l,3-diène. Les réponses aux
questions suivantes (2.1.8 à 2.1.11) s'effectuent à l'aide de l'annexe 2 (page
10).
Figure 2 : Produit issu de la réaction entre le composé A et le
penta--l,3--diène.
2.1.8 Proposer une explication aux différences d'énergie observées entre les
orbitales frontières de
l'acrylate de méthyle (prop--2-énoate de méthyle) et celles de l'éthène. Faire
de même pour
celles du penta-l,3-diène et du 1-méthoxybuta-l,3-diène en comparaison de
celles du
butadiène.
2.1.9 Montrer, en s'appuyant sur les caractéristiques régiochimiques et
stéréochimiques de la réaction
de Diels--Alder, que la réaction entre A et le penta--1,3--diène conduit à deux
composés B et B'
issus d'une même approche. Proposer une structure en représentation de Gram du
composé B'
minoritairement obtenu en précisant sa relation stéréochimique avec B. Les
orbitales frontières
du composé A sont assimilées à celles de l'acrylate de méthyle (cf. annexe 2,
page 10).
2.1.10 Expliquer en représentant la conformation la plus stable de la molécule
A et en invoquant des
considérations stériques que l'on obtient majoritairement le composé B plutôt
que B".
2.1.1] Déduire des questions précédentes une structure pour le composé C.
Indiquer si la formation
de ce composé est plus ou moins favorable que celle du composé B. Justifier la
réponse en
invoquant une règle connue.
2.2 Préparation d'un intermédiaire de synthèse
On étudie la préparation, à partir du D--glucose, d'une molécule précurseur
d'un médicament. Ce
précurseur est représenté ci--dessous (molécule 11).
\ COZEt
BocHN ; "'OH E
ÔH ;
11 E
Plusieurs étapes préliminaires permettent d'obtenir à partir du D-glucose le
composé 7 représenté sur le
Schéma 2. La fonction triflate (OTf) possède une réactivité du même ordre que
celle de la fonction mésylate
(OMS). La suite de réactions proposée sur le Schéma 2 permet de passer du
composé 7 au composé 11. Le
passage du composé 8 au composé 9 entraîne un dégagement de méthanal (CI--120,
] équivalent). De plus,
le spectre IR du composé 9 présente deux bandes supplémentaires par rapport à
celui du composé 8 : une
intense à 1700 cm"1 et une d'intensité moyenne à 2800 cm'l. Le passage du
composé 10 au composé 11
met en jeu plusieurs réactions non étudiées par la suite.
><Ê o NaN3 1. Ac0H/H,0 NaBH4 D-glucose O 8 9 + H2CO 10 11 (... o DMF 2. NalO4 EtOH ' ? î/ NaHCO3/HZO _______________________________ 5 9 o : | Il ; H30"fi--ë Fac--fi--â : 0 0 ' & Ms--ë Tf--â 5 Schéma 2 : Suite réactionnelle pour la synthèse du composé 11 à partir du D--glucose. 2.2.1 Donner la nature et le rôle de chacune des fonctions présentes dans le composé 7. 2.2.2 Proposer une structure de Lewis linéaire de l'ion azoture Ngf. Montrer que celui--ci peut jouer le rôle de nucléophile. En déduire la structure du composé 8 en représentation de Gram en précisant sa stéréochimie. 2.2.3 Donner la structure des composés 9 et 10 en représentation de Gram en précisant leur stéréochimie sachant que le composé 9 est bicyclique. Le composé 11 est caractérisé par sa RMN du proton (CDCla, 400 MHZ). Les signaux obtenus sont donnés dans le Tableau 1 ci-dessous. Les protons des groupements hydroxyles et amine ne sont pas observés. Proton Déplacement Multiplicité Couplage en Hz Intégration en ppm 3H 1,25 Triplet 7,1 3 9H 1,39 Singulet -- 9 H] 2,45 Doublet de doubler 14,5 et 7,6 1 H], 2,74 Doublet de doublet 14,5 et 3,0 1 Hz 3,35 Doublet de doubler 8,8 et 2,0 1 H3 3,52 Multiplet - 1 2H 4,17 Quadruplet 7,1 2 H4 4,47 Multiplet - 1 H5 5,16 Doublet de doublet 10,5 et 1,3 1 H5> 5,22 Doublet de doublet 17,4 et 1,3 1
H6 5,74 Doublet 1,5 1
H7 5,85 Doublet de doublet de doubler 17,4 et 10,5 et 5,2 1
H6' 6,23 Doublet 1,5 1
Tableau 1 : RMN du proton du composé 11.
2.2.4 Identifier les signaux correspondant aux protons des groupements ester
éthylique et 130EUR.
Justifier votre réponse.
On souhaite par la suite identifier certains des signaux des protons H,, à Hg)
du composé 11 représenté
sur la Figure 3 et les relier aux protons H1 à H7 du spectre RMN (exemple : H({
= Hg).
Figure 3 : Composé 11.
E R R 5
e R+:R =
R R R R R\ ,H : H H :
R--i--(C)...+R R--H--R ,c\ : ;
R H : :
H H H H 030H : H H :
- - Z | .
n>1 0 Hz 0 15 Hz : R H R R :
R R H R R H : :
H H R H R H : R R R H R E
6-12 Hz 12-18 Hz 0-3 Hz : R :
Figure 4 : Constantes de couplage en RMN duprot--o--n.
------------------------------------------------
2.2.5 Identifier les signaux correspondant aux protons éthyléniques (H,, I--Lf,
Hf, Hg et Hg) en
attribuant autant que possible les déplacements chimiques, les multiplicités et
les couplages sur
un schéma pour ces protons.
2.2.6 Les protons Hb, Hb' et Hd correspondent respectivement à H1, H1' et H2.
En s'appuyant sur
des projections de Newman adéquates, et en s'aidant des Figure 3 et Figure 4,
justifier la
multiplicité et le couplage de ces signaux.
3. Un polymère naturel du glucose : la cellulose
Les polysaccharides sont des polymères constitués de plusieurs oses liés entre
eux par des liaisons O--
osidiques. Parmi ceux--ci, la cellulose constituée d'une chaîne linéaire de
molécules de D--glucose (entre 200
et 26 000 molécules) est la matière organique la plus abondante sur Terre (plus
de 50 % de la biomasse). Sa
structure est donnée sur la Figure 5. La quantité synthétisée par les végétaux
est estimée à 50--100 milliards
de tonnes par an. On retrouve notamment de la cellulose dans le papier et les
textiles.
OH 0 OH OH
%\o 0 HO H 0 0 OH 0
Ho 0 0 H0 OHO oHO o
HO ° \Ë
HO HO
OH OH
Figure 5 : Structure de la cellulose.
La cellulose est l'un des trois composants principaux du bois, avec les
lignines et les hémicelluloses qui
sont des polymères constitués d'unités osidiques différentes. La Figure 6
illustre certaines de ces structures.
La cellulose possède une température de transition vitreuse Tg comprise entre
230 et 255 °C, les
hémicelluloses entre 165 et 220 °C et les lignines entre 135 et 235 °C.
Structure générale d'une hémicellulose Structure possible d'une lignine
(Xyloglucane) "*Î'°"
@ : " |
' ' H OH
HOC--ÎH--CHpH 1 OH HCf(Carbohydrale) '? OCH'
"" °°" nc--o
. Hé0H H"'|'OH C...) |
CHO ' ocw U---CH
- ' "? °"
O--CH
HC{--O Hc' o Y_JH "fo"
HÎ' ocrt Hcl--YH cno H_C'OH HÎ--O
HOCH_, H,C 0 CH 0--(IÏH H,coe HCG"
n nocn cer--r HOCH |
OH H(|: cup H}{:OH ocnl Y"°
0 H.C\ofcn Û--CH cm0 0 YH
HO 0 How o--érc HQC--ïH--CHpH Hé-- CH
HO OH HO OH CH.O l . nocn H>COH
OH X 1 OH ' H""CH"cæi,o @ --l '
Glucose Y 056 ° °|H "Y on
OCH' °""»° HOCH HC :
co ' " \0
OH OH 0: C o--c'n HpOH co
0 . 3 0 | Hé--éH CH'O HC (")--CH
HO OH 0 OH °"4° HOCH, ; | >: | | --' nc.--g
H HC\ /CH, no CH HC--D
HO OH ° H[IDDH néon
Galactose Fucose "°°" '
HCOH CHO
Hpof... ° 00H,
Figure 6 : Structure générale d'une hémicellulose (xyloglucane) et d'une
lignine.
3.1 Identifier le motif de répétition de la cellulose si l'on considère
celle--ci comme un homopolymère.
La masse molaire du motif vaut 324 g.molä
3.2 Identifier le caractère linéaire, ramifié ou réticulé de la cellulose, du
xyloglucane et de la lignine.
3.3 Expliquer la valeur élevée de la température Tg pour la cellulose. Déduire
de la question 3.2 une
interprétation des températures de transition vitreuse du xyloglucane et de la
lignine.
Des travaux sur l'évolution de la température de transition vitreuse Tg d'un
papier contenant de la
cellulose en fonction de son pourcentage d'humidité, noté Hu, ont montré qu'il
existe une relation
empirique entre ces deux grandeurs :
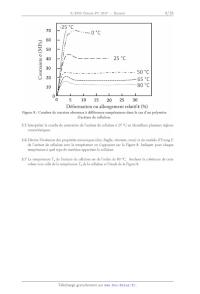
Tg (°C) = 234,2 >< exp(--O,131 >< Hu) 3.4 lnterpréter cette équation et expliquer pourquoi l'eau est qualifiée de « plastifiant » dans le cas de la cellulose. Une étude des propriétés mécaniques de l'acétate de cellulose, représentée sur la Figure 7, est possible grâce à l'analyse des courbes de traction. Celles-ci, obtenues à différentes températures, sont données sur la OAC OA OAC OAC HO O HO O HO 0 O A 0 o 0 HO \% C OAC ACO CAO DAO Figure 7 : Structure de l'acétate de cellulose. Figure 8. U1OE\l °°° Contrainte 0' (MPa) un :>
o o
N
°
H
O
0 5 10 15 20 25 30
Déformation ou allongement relatif £ (%)
Figure 8 : Courbes de traction obtenues à différentes températures dans le cas
d'un polymère
d'acétate de cellulose.
3.5 lnterpréter la courbe de contrainte de l'acétate de cellulose à 25 °C en
identifiant plusieurs régions
caractéristiques.
3.6 Décrire l'évolution des propriétés mécaniques (dur, fragile, résistant,
mou) et du module d'Young E
de l'acétate de cellulose avec la température en s'appuyant sur la Figure 8.
Indiquer pour chaque
température à quel type de matériau appartient la cellulose.
3.7 La température Tg de l'acétate de cellulose est de l'ordre de 80 °C.
Analyser la cohérence de cette
valeur avec celle de la température Tg de la cellulose et l'étude de la Figure
8.
Annexe 1
--lfi--rrrl--rfi--mfi-fi--m--H--fi--H-fi--m--l--rfiñ-fifi-fl--rfi--
" (""") 4000 3500 3000 2500 2000 1500 1000 500 0
3670 - 3580 O--H libre (Forte) large
3400 _ 3200 O--H lié (Forte) large
3500_ 3100 N--H amine (moyen) 2 bandes si primaire
3500-- 3100 N--H amide (Forte)
3200_ 2500 O--H acide carboxylique (moyenne à Forte) large
3310 I3300 (-CE)C--H (faible à moyen)
H
3100 .3000 (c=)Cï (moyen)
3080. 3030 Ar--H (moyen)
3000 _ 2800 --:c--H (Forte)
2900 _ 2750 (O=)C--H aldéhyde (moyen)
2260 _ 2120 --CEN (moyenne à Forte)
1840 _ 1700 -C=O anhydride (Forte) 2 bandes
1820 I 1770 --C=O chlorure d'acide (Forte)
1740 I 1700 --C=O ester (Forte)
1730 .1650 -C=O carbonyle (Forte)
1710 l 1680 -C=O acide carboxylique (Forte)
1580 . 1510 N=O asymmétrique (Forte)
1365 . 1325 N=O symmétrique (Forte)
1680 . 1600 --C=N (Forte)
2250 _2100 -CEC- (faible)
1685 I1625 -C=C- (moyen)
1600 _ 1450 --C=C- aromatique (variable)
1250 _ 1000 -C--C-- (Forte)
1450 _1050 -C--O (Forte)
1360 --1020 --C--N (moyenne à Forte)
1040 I 1000 -C--F (Forte)
800 - 700 -C--Cl (Forte)
750 -600 -C--Br (Forte)
600 -500 --C--I (Forte)
.--leä--mfifififid--m--fi--Hfi'fi--Ffi--m--Hfifflfi--WH--
" (cm '> 4000 3500 3000 2500 2000 1500 1000 500 0
Table IR en cm'l.
5 PPM
500 300
Qt)" \\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\Y
R--OH .\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\Y
ils--© R--SH m\\'
«\\\\\\' R--Nllæ' @... \\\\\\\\\\\\\\' R-... \\\\\\\\\\
\\\\\\\\\\\\\\\\\\\Y "@
...C'H =CH-- (Cycle)
\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\Y --C H : CH--
\\\\\\\\\\\\\\\\\\\\\\\Y >C = C ":
\\\\\\\' --C EC H
>CH--X l>cu--H<< >CH--O-- À\\\\\\\\\\\\\\\" \\\\Y >CH--fi-- ---:--CH
()
__CHz--X
>C--CH:--No;_ >--C--CHZ--N< ? >c--cm--o--_ _>c_c..._c_
_CH1--0--(cÿrb)- --CH:--(c)'ck)- R--A
appelee queue, lautre hydrophrle soluble dans leau, appelee tete. La
representation la plus utilisee d une
molécule de tensioactif est donnée sur la Figure 9. On classe souvent les
tensioactifs selon la charge nette
portée par la tête hydrophile: anionique si le nombre de charge est négatif,
cationique si le nombre de
charge est positif et non ionique ou zwitterionique (autant de charges
positives que de charges négatives) si
/\/\/\/\/' j\
OEeue 1ipophile Tête polaire (hydrophile)
le nombre de charge est nul.
Figure 9 : Représentation schématique d'une molécule de tensioactif.
Ces molécules connaissent de nombreuses applications dans les produits de la
vie courante (lessives,
savons, détergents, alimentation, produits cosmétiques...) et font l'objet de
nombreuses recherches. Dans
certaines conditions, ces molécules peuvent catalyser des réactions chimiques
ou s'organiser pour stabiliser
des émulsions complexes ou encore des objets de tailles nanométriques.
Données :
' T(°C) = T(K) -- 273.
0 Longueur de liaison : C--H (109 pm), C--C (154 pm), 5--0 (148 pm) et S=O (142
pm).
. Valeurs numériques : TE : 3,14 ; TE2 : 9,86 ; TE3 : 31,01 ;7'c4 : 97,41 ; 3
30 = 3,10.
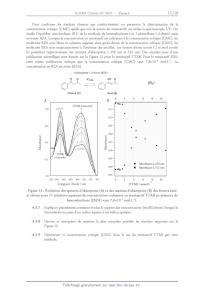
0 Volume d'un cône de hauteur H : Aire de la base><10ÏÎ.m01Ï1 et que AmicH° est égale à --7,00x103 ].molÏ' à 27 °C. Déterminer la valeur de AmicS° et interpréter l'ensemble de ces résultats expérimentaux. Discuter avec soin du caractère enthalpique ou entropique du processus de micellisation à 27 °C. 13 4.3 Détermination expérimentale de la concentration micellaire critique On propose de déterminer cette concentration en utilisant la conductimétrie dans un premier temps. Les résultats obtenus à 27 °C sont donnés sur la Figure 12. La concentration totale en tensioactif SDS est toujours notée [SDS] et les conductivités ioniques molaires des ions Na*, SD_ et des micelles sont notées respectivement ÂNa, Â5D et Âmic- La conductivité de la solution est notée 71 lorsque la concentration [SDS] est inférieure à la concentration critique [CMC] et 72 lorsque la concentration [SDS] est supérieure à la concentration critique [CMC]. 4.3.1 4.3.2 4.3.3 4.3.4 4.3.5 4.3.6 0 5 10 15 20 25 30 35 40 45 50 55 60 Ë ax+b Ë_ a = 0,075 1 0,0006; ; bi=°. ax+b a = 0,0257 : 0,0002' b ; 0,391 :t 0,_0_o9 : : Conductivité / mS.cm 0 5 10 15 20 25 30 35 40 45 50 55 60 _] [SDS] / mmol.L Figure 12 : Évolution de y en fonction de la concentration en tensioactif [SDS]. 0 Donner une express1on de la conduct1v1té molaire ionique d'une m1ceHe Âmic en fonction de a, 0 N et Â5D Sl l'on fait l'hypothèse que celle--cr est la somme des contributions des anions non neutralisés. Dans le cas du tensioactif SDS, décrire et interpréter qualitativement (10 lignes maximum) l'évolution de la conductivité observée sur la Figure 12. Donner une expression de la conductivité y] en fonction de la concentration [SDS]. Exprimer la conductivité "{2 en fonction de l'expression de la question 4.3.1, et et des concentrations [SDS] et [CMC]. Déterminer alors à partir de la Figure 12 les valeurs de la concentration critique [CMC] et de OL pour le tensioactif SDS à 27 °C. Identifier quelle(s) est (sont) la(es) limite(s) de cette technique et du modèle « closed association model » utilisé. En déduire quel(s) est (sont) le(s) tensioactif(s) parmi ceux décrits sur la Figure 10 pour le(s)quel(s) cette technique ne serait pas judicieuse pour déterminer la concentration critique [CMC]. 14 Pour confirmer les résultats obtenus par conductimétrie ou permettre la détermination de la concentration critique [CMC] quelle que soit la nature du tensioactif, on utilise la spectroscopie UV. On étudie l'équilibre céto--énolique (R1) de la molécule de benzoylacétone (ou 1-phénylbuta--l,3--dione) aussi nommée BZA. Lorsque la concentration en tensioactif est inférieure à la concentration critique [CMC], les molécules BZA sont libres en solution aqueuse alors qu'au-dessus de la concentration critique [CMC], les molécules BZA sont majoritairement à l'intérieur des micelles. Les formes cétone (notée C) et énol (notée E) possèdent respectivement des maxima d'absorption à 250 nm et 312 nm. Des résultats issus d'une publication scientifique sont donnés sur la Figure 13 pour le tensioactif TTAB. Pour le tensioactif SDS, cette même publication indique que la concentration critique [CMC] vaut 7,8x10Ï3 mol.L? La concentration en BZA est notée [BZA]. 1-phénylbuta-1,3-dione (BZA) 0 o K°BzA OH o \ (R1) __ Cétone (C) Énol (E) A B 0 4 8 12 16 20 [TTAB] croissante 0,8 . 0.75 ' - 0,70 | 0,6 * 0,65 . . 0,60 8 8 - ;: |: o t.: e: -E 0,4 * -8 0,55 0 ° . U} un 43 ---D | < < 0,50 0 0,2 * croissante . 0.45 . Absorbance à 250 nm 0'40 I Absorbance à 312 mn 0,0_ | | | | | | 055 220 240 260 280 300 320 340 360 0 4 8 12 16 20 _| Longueur d'onde / nm [TTAB] / mmol.L Figure 13 : Evolution des spectres d'absorption (A) et des maxima d'absorption (B) des formes énol et cétone pour 11 solutions aqueuses de concentration croissante en tensioactif TTAB en présence de benzoylacétone ([BZA] vaut 7,0x10 5 mol.L 1). 4.3.7 Expliquer précisément comment évolue le rapport des concentrations [énol]/ [cétone] lorsque la benzoylacétone passe d'un milieu aqueux à un milieu apolaire. 4.3.8 Décrire et interpréter de manière la plus complète possible les résultats rapportés sur la Figure 13. 4.3.9 Déterminer la concentration critique [CMC] dans le cas du tensioactif TTAB par cette méthode. 15 5. Applications des tensioactifs comme stabilisants d'émulsions Les tensioactifs peuvent être utilisés pour stabiliser des émulsions de type eau--huile comme par exemple dans le cas d'une éprouvette contenant 2,5 mL d'eau surmontée de 2,5 mL d'huile. La surface de l'interface et la tension interfaciale sont respectivement de l'ordre de 1 cm2 et 10"5 ].cm"2. En agitant vigoureusement l'éprouvette fermée, on provoque la formation d'une émulsion qui est une dispersion d'une phase liquide dans une autre phase liquide. Dans le cas de l'émulsion précédente, les fines gouttelettes ont un rayon d'environ 5 pm. Si aucun tensioactif n'est ajouté avant agitation, la solution revient à son état initial avec deux phases bien distinctes : on parle de démixtion. Si l'on ajoute un tensioactif, la démixtion n'a plus lieu ou est largement ralentie. Plus la surface interfaciale eau--huile est grande, plus le processus de démixtion est favorisé. Les tensioactifs sont qualifiés parfois d'émulsifiants en raison de leur capacité à stabiliser des émulsions. 5.1 Montrer à partir d'un calcul simple que l'émulsion décrite dans le paragraphe ci--dessus (huile--eau) est bien instable et expliquer soigneusement la démarche suivie. Pour un tensioactif donné, on introduit un paramètre caractéristique, noté EHL, qui exprime l'équilibre hydrophile--lipophile. Ce paramètre traduit l'importance relative de la partie polaire et de la partie apolaite, et il conditionne les affinités relatives de la molécule tensioactive pour l'eau et pour les milieux organiques. Plus sa valeur est élevée, plus la solubilité dans l'eau est grande. Le paramètre EHL est déterminé à partir de la formule empirique de Davies et Rideal : EHL : 7 + Z EHLgroupes hydrophiles _ î EHL,«groupes hydrophobes La lecture du texte suivant permet de répondre aux questions 5.2 et 5.3 : La typologie des systèmes eau/huile/tensioactif a été proposée en 1948 par P. A. Winsor, et depuis adoptée dans l'étude des émulsions. On note généralement « o » la phase organique (pour ail), et « W » la phase aqueuse (pour water). La notation « o/w », ou « huile dans l'eau », indique que la phase continue est la phase aqueuse, dans laquelle le tensioactif forme des micelles avec la phase organique dispersée. La notation « W/0 », ou « eau dans l'huile », indique que la phase continue est la phase organique, dans laquelle le tensioactif forme des micelles avec la phase aqueuse. 00000'0'00 >000000000
"gyæ0oqÿ
0
war
00
00
;
0
EUR
0
0
&
0
%ÿ
d%
»:.
à£
'
0
*3
%
&
;»:
"
0
4%!
0
00000
0
0
00
$:
&&
0
&b
@;
«&
0
«$
x
00
%&ÿ
000
0'0'0
%%
&&
:
DO
M:
0
&?
**
0q,000
.
Z'
0
3
0
0
%
0
2
à
0
0
&
;
0
&
&
5
$
0
.
.
0
0
%
%%
00
00
..
&?
«!
00000
%&%Üï
'
&
&
0
0
0
%
%
g
0
3
*:
&0
0
0
&
ww
qÿ
%fi%%
0
$
;
;
db
&!
0
0
0
0
0
00
00
0ÊË%
000
0000
EUR"%%
«êum
.
t
0000
0000
0éWWÜ
0qÿ00
A'
0
%!
0&V
%"?
0000
000
0000
0000
%Wÿ
000
0
%
45
O
0
0
0
0
0
0
45
,0
%0
&?
$$
&?
,3,.
«
gp
Type 1 Type II Type III
Le type Winsor I désigne un système biphasique, où une phase organique surnage
sur une phase de type
0/W où se trouve le tensioactif, très majoritairement dissous dans l'eau.
Le type Winsor Il désigne un système biphasique, où une phase de type W/0, dans
laquelle se trouve le
tensioactif (majoritairement dissous dans la phase organique), surnage sur une
phase aqueuse.
16
Le type Winsor III désigne un système triphasique dans lequel une phase
intermédiaire riche en tensioactif
se forme entre les phases aqueuse et organique. Cette phase intermédiaire est
formée de zones de phase
aqueuse et de phase organique intriquées, sans micelle ni phase continue
prépondérante.
Le type Winsor IV peut être considéré comme un Winsor III monophasique sans
excès de phase aqueuse ni
de phase organique. Elle est obtenue lorsque la concentration en tensioactif
est relativement élevée.
5.2 Relier qualitativement les valeurs de EHL des tensioactifs aux émulsions
Winsor I à III qu'ils
stabilisent. En déduire l'organisation des molécules de tensioactif dans
chacune des phases où elles
se trouvent pour ces mêmes émulsions I à III.
5.3 Déterminer le paramètre EI--IL des tensioactifs SDS, CTAB et Triton X--100.
En déduire lequel des
trois est le plus adéquat pour stabiliser une émulsion de chaque type (Winsor I
à III).
6. Utilisation des tensioactifs en catalyse
Le procédé Wacker est un procédé industriel largement développé qui permet de
transformer des
alcènes en aldéhyde ou cétone au moyen d'une catalyse par le chlorure de
palladium (II). Il fut découvert en
1958 et à partir de cette date largement utilisé pour réaliser la
transformation de l'éthène en éthanal selon le
cycle catalytique donné sur la Figure 14.
1/2 02 + 2H+
+
H20 2CU CH2=CH2
PdCl42'
CI"
20u2+
Cl3Pd_
4Cl'
"Pd"
HZO
ZCI' + HCI + CH3CHO ,
, Etape 1
Etape 4
H+
H
| 2-
2-
Cl3Pd--C--CH3 H2C--OH
\ /
Étape 2
' H OH
Etape 3 | _ Cl"
Cl" Cl--PÎ-- ' ]
Cl
Figure 14 : Cycle catalytique du procédé Wacker dans le cas de la
transformation de l'éthène en
éthanal.
6.1 Donner le nom des étapes 2 à 4 ainsi que la variation du degré d'oxydation
de l'atome de palladium
au cours de chacune d'entre elles.
6.2 Établir l'équation de réaction du cycle catalytique.
17
6.3 Expliquer le rôle de l'ion Cu2+ dans ce cycle.
Des études montrent que cette réaction est nettement accélérée en
microémulsion. Une synthèse
datant de 1994 propose de réaliser tout d'abord un mélange constitué d'eau, de
N,N--diméthylformamide,
de cyclohexène et d'un composé nonylphénolpolyéthoxylé. Puis, sous agitation,
de la benzoquinone
(CéH40z) et du chlorure de palladium sont ajoutés au milieu réactionnel en vue
de synthétiser un produit
P. Au cours de cette réaction la benzoquinone est réduite en
1,4--dihydroxybenzène selon la réaction R2
o=®=o + 2H+ + 2e" : HO--@OH (R2)
Benzoquinone 1,4-dihydroxybenzène
d'équation :
6.4 Proposer une structure pour le produit P issu de la réaction R2. Indiquer
le(s) rôle(s) et/ ou l'intérêt
de chacun des constituants suivants : eau, MN-diméthylformamide, cyclohexène,
composé
nonylphénolpolyéthoxylé et benzoquinone.
6.5 Donner la nature de la réaction intervenant lors de l'étape 1 du cycle de
la Figure 14 et justifier le
caractère électrophile de la double liaison dans ce cas.
6.6 Interpréter l'accélération de la réaction en microémulsion. Préciser quel
type d'émulsion de Winsor
est recherché dans cette expérience, et expliquer le choix de l'utilisation
d'un composé
nonylphénolpolyéthoxylé.
18
