X Chimie PC 2014
| Thème de l'épreuve | Dissolution des gaz dans les liquides ioniques. Les PPAPS. |
| Principaux outils utilisés | solutions aqueuses, oxydoréduction, thermochimie, chimie organique |
| Mots clefs | liquide ionique, clusianone, hyperibone K, PPAPS |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
ECOLE POLYTECHNIQUE -- ECOLES NORMALES SUPÉRIEURES
ECOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2014 FILIÈRE PC
COMPOSITION DE CHIMIE -- (XEULC)
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée pour cette épreuve.
***
1 Première partie -- Dissolution des gaz dans les liquides ioniques
Les liquides ioniques constituent une classe de sels organiques ayant la
particularité de pré--
senter une température de fusion inférieure a 100°C. Leurs structures peuvent
être extrêmement
variées mais les cations 1--alkyl--3--méthylimidazolium, N--alkylpyridinium,
tétraalkylammonium
ou tétraalkylphosphonium sont les plus fréquemment décrits, associés a des
anions organiques
ou inorganiques tels que des hexafluorophosphate (PFg ), tétrafluoroborate
(BFl), trifluoromé--
thanesulfonate (CF3805 ), trifluoroéthanoate (CF3CO£ ), éthanoate, nitrate, ou
halogénures.
4 5
/ \ \® 1@ 4 1@ 4
MeN.NR ( ÏNR RËNïR RËPÇR
3\2/1 _ R2 R3 R2 R3
1-alkyl-3-méthylimidazolium N-alkylpyridinium tétraalkylammonium
tétraalkylphosphonium
R, R1, R2, R3 et R4 : groupes alkyles
Des centaines de liquides ioniques ont ainsi été décrits, et la gamme des
températures de fusion,
initialement restreinte, s'est considérablement étendue. Ainsi, des sels ayant
une température de
fusion pouvant descendre jusqu'à --96°C ont été récemment découverts.
Au cours des dernières années, leurs applications se sont multipliées dans des
domaines aussi
variés que les industries chimique et pharmaceutique, la purification et le
traitement des gaz ou
encore en tant qu'électrolyte remplacant l'eau dans les piles électrochimiques.
D'un point de vue
synthétique, leur caractère ininflammable et leur très faible pression de
vapeur saturante font
d'eux des candidats de choix pour le remplacement des solvants organiques
classiques volatils,
toxiques et présentant des risques d'explosion.
Données thermodynamiques à 298 K :
Masses molaires :
Élément H C N O 8 Cl Ag 1
Massemolaire/g.moï' 1,0 12,0 14,0 16,0 32,1 35,5 107,9 126,7
Masses volumiques (en g.cm_3) :
Pyridine liquide anhydre C5H5N 0,978
Méthanol anhydre CH30H 0,791
Dioxyde de soufre gazeux 802 2, 77.10--3
Potentiels standard d'oxydoréduction (par rapport a l'électrode standard a
hydrogène) :
Couple H+(aq)/Hz(3) 02(3)/H20(0 12(aq)/1_(aq) SOg(âQ)/SOg(aq)
E /V 0,00 1,23 0,62 0,17
On prendra : % ln 10 = 0, 06 V.
Produits de solubilité : pKS(AgCl) : 9, 75; pKS(AgSCN) : 11, 9.
Constante de formation globale : 5([Fe(SCN)PÜ : 2, 2.
Le complexe [Fe(SCN)]2+ en solution aqueuse est de couleur rouge sang.
Polarisabilités (07) et moments dipolaires (a) de quelques gaz :
Molécule H20 COQ C2H4 CH4 02 N2 Hg
6 / 10-24 cm3 1,43 2,64 4,25 2,6 1,53 1,74 0,31
0/D 136 0 0 0 0 0 0
Avec 1 D:3,3310--30 C.m.
1.1 Dosages dans les liquides ioniques
Dosage des ions halogénures
Lors de la synthèse des liquides ioniques, il arrive qu'un échange d'anion soit
effectué. Il peut
être alors nécessaire de connaitre la quantité résiduelle d'ions halogénures.
Quantitativement, les
ions chlorure sont dosés dans les liquides ioniques par la méthode de
CHARPENTIER--VOLHARD.
Le mode opératoire est le suivant : a une prise d'essai de 10,0 mL du liquide
ionique chlorure
de 1--butyl--3--méthylimidazolium (noté [BMIMÏCÎ]) sont ajoutés 15,0 mL d'une
solution de
nitrate d'argent a 0,1 mol.L_1, provoquant la formation d'un solide blanc qui
est éliminé par
filtration. Le filtrat obtenu est dosé par une solution de thiocyanate de
potassium (K+, SON--)
a 0,05 mol.L_1 en milieu acide nitrique et en présence de quelques gouttes
d'une solution de fer
(IH) ((NH4)Fe(SO4)2 dans l'eau). Un volume équivalent de 17,2 mL est obtenu.
1.1.1 Quelle est la nature du solide blanc précipitant aprés ajout de la
solution de nitrate d'ar--
gent ?
1.1.2 En supposant que les ions Ag+ sont introduits en excès, écrire l'équation
de la réaction
de titrage et calculer sa constante d'équilibre. Commenter. Avec quelle
verrerie la solution de
nitrate d'argent doit--elle être prélevée ?
1.1.3 Comment l'équivalence est--elle détectée ?
1.1.4 En déduire la concentration molaire résiduelle en ions chlorure dans la
prise d'essai.
1.1.5 Pourquoi est--il nécessaire de filtrer le solide blanc ? Écrire
l'équation bilan de la réaction
susceptible de se réaliser et calculer sa constante d'équilibre. Effectuer le
titrage sans l'éliminer
conduirait--il a surestimer ou sous-estimer la quantité d'ions chlorure ?
1.1.6 Discuter l'influence de la quantité d'indicateur coloré ajouté sur la
précision du dosage.
Dosage de l'eau dans un liquide ionique
L'eau (provenant de l'atmosphère ou sous-produit de synthèse) modifie les
propriétés phy--
siques des liquides ioniques. Cet effet est particulièrement sensible sur la
viscosité, ce qui peut
poser de nombreux problèmes pour l'homogénéisation des réactions en solvant
liquide ionique.
Une technique de dosage de l'eau, précise et reproductible, a été appliquée a
ces composés.
Développée en 1935 par un chimiste allemand, la méthode KARL FISCHER permet de
déterminer
la quantité d'eau contenue dans un échantillon quelconque et est
particulièrement adaptée aux
concentrations de l'ordre du ppm {partie par million).
Le réactif de KARL FISCHER est préparé de la façon suivante : dans une fiole
jaugée d'un litre
contenant 270 mL de pyridine anhydre (C5H5N) et 670 mL de méthanol anhydre sont
dissous 45
mL de dioxyde de soufre gazeux et 85 mg de diiode solide. Après
homogénéisation, un volume
de 940 mL d'une solution brune fortement colorée est obtenu. Une prise d'essai
de 10,0 mL du
liquide ionique dont on cherche la teneur en eau est alors titrée par la
solution précédente. Une
expérience réalisée avec le liquide ionique [BMIMÏPFë ] a été menée et un
volume équivalent de
14,9 mL obtenu.
1.1.7 Dans un premier temps on ne tient pas compte de la présence de pyridine
et de méthanol.
Écrire la réaction d'oxydoréduction se produisant entre l'eau de l'échantillon,
le dioxyde de soufre
et le diiode. Calculer sa constante d'équilibre et commenter (on ne prendra pas
en compte les
réactions d'hydratation des oxydes de soufre en raison de leur faible constante
de vitesse).
1.1.8 Les espèces issues de la réaction de dosage réagissent avec la pyridine.
Donner la structure
des produits obtenus.
1.1.9 Expliquer par un calcul la manière de détecter l'équivalence. Que
pourrait--on ajouter aux
environs de l'équivalence afin de rendre sa détermination plus visible ?
1.1.10 Calculer la concentration molaire d'eau dans le liquide ionique
[BMIM+,PF6_ ]
1.1.11 Dans la littérature, il est indiqué que le réactif de KARL FISHER est
instable et doit être
régulièrement étalonné avec une solution étalon d'eau dans le méthanol.
Proposer une explication.
Analyse spectroscopique d'un liquide ionique
Souvent, une analyse précise n'est pas requise et il suffit de disposer de
l'ordre de grandeur
de la concentration en eau présente dans le liquide ionique. On substitue alors
a la méthode de
KARL FISCHER une analyse par spectroscopie infrarouge (IR), rapide a mettre en
oeuvre.
1.1.12 L'eau pure en phase vapeur présente deux bandes de vibration
d'élongation a 3756 et
3657 cm_1. Ces deux bandes fusionnent en phase liquide pour donner une bande
large présentant
un maximum vers 3300 cm_1. Comment interpréter ces deux faits expérimentaux
(fusion des
bandes et abaissement du nombre d'onde) ?
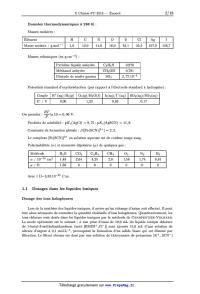
Un extrait des spectres IR (en absorbance) du tétrafluoroborate de
1--butyl--3--méthylimidazolium
(noté [BMIMÏBFÂ]) (traits pleins), et de l'eau liquide (traits pointillés),
enregistrés dans les
mêmes conditions, est présenté figure 1. Ces spectres sont limités a la zone
2800--3800 cm--1
(région OH).
------
-- --_
Absorbance
0,10--
0,05 --
0,00 ""'--/\/\-- ' > Glem--1
| | | |
3800 3600 3400 3200 3000 2800
Figure 1 -- Spectres IR du [BMIMÏBFZ] (traits pleins) et de l'eau liquide
(traits pointillés)
1.1.13 En déduire dans quel état d'agrégation se trouve l'eau dans le liquide
ionique. Que peut--
on dire de la présence de liaisons hydrogène entre les molécules d'eau dans le
liquide ionique ?
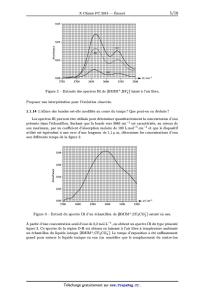
La figure 2 montre un extrait des spectres IR (région OH) obtenus après avoir
laissé a l'air libre
un échantillon de [BMIMÏBFZ]. Les courbes correspondent a des temps croissants
d'exposition
a l'air (courbe (a) : 1 h, courbe (b) : 5 h, courbe (c) : 8 h d'exposition a
l'air).
0,03
0,02
Absorbance
0,01
0,00 0/ cm--1
3750 3700 3650 3600 3550 3500
Figure 2 -- Extraits des spectres IR de [BMIMÏBFÂ] laissé a l'air libre.
Proposer une interprétation pour l'évolution observée.
1.1.14 L'allure des bandes est--elle modifiée au cours du temps ? Que peut--on
en déduire ?
Les spectres IR peuvent être utilisés pour déterminer quantitativement la
concentration d'eau
présente dans l'échantillon. Sachant que la bande vers 3640 cm_1 est
caractérisée, au niveau de
son maximum, par un coefficient d'absorption molaire de 100 L.mol_1.cm_1 et que
le dispositif
utilisé est équivalent a une cuve d'une longueur de 1,1 ,a m, déterminer les
concentrations d'eau
aux différents temps de la figure 2.
0,08
0,06
0,04
Ab sorbance
0,02
0,00 0 / cm--1
3700 3600 3500 3400 3300 3200
Figure 3 -- Extrait du spectre IR d'un échantillon de [BMIMÏCFgCOQ ] saturé en
eau.
À partir d'une concentration seuil d'eau de 3,2 mol.L_1, on obtient un spectre
IR du type présenté
figure 3. Ce spectre de la région O--H est obtenu en laissant a l'air libre a
température ambiante
un échantillon du liquide ionique [BMIMÏCFgCOQ ] Le temps d'exposition a été
suffisamment
grand pour saturer le liquide ionique en eau (on considère que le remplacement
du contre-ion
BFZ par CF3COE ne modifie pas significativement la valeur du coefficient
d'absorption molaire
du liquide ionique).
1.1.15 Les deux bandes du spectre de la figure 2 fusionnent dans ce cas en une
seule, plus large.
Proposer une interprétation.
1.1.16 L'enthalpie standard de dissolution de l'eau dans le composé
[BMIM+,CF3COZ_ ] est de
--30,0 kJ .mol_1. Quel est l'effet d'une hausse de la température sur la
solubilité? Justifier la
réponse. En déduire une technique d'élimination de l'eau résiduelle dans le
liquide ionique.
1.1.1? L'entropie standard de dissolution de l'eau dans le composé
[BMIM+,CF3COZ_] a été
calculée a 298 K et vaut --53, 2 J .K_1 .mol_1. lnterpréter le signe de cette
grandeur. La dissolution
de l'eau dans le liquide ionique est--elle due au facteur enthalpique ou au
facteur entropique ?
1.2 SolubiIité des gaz dans les liquides ioniques
L'utilisation des liquides ioniques en tant que solvant de substitution pour
les réactions or--
ganiques classiques a fait l'objet de nombreuses publications ces dernières
années, notamment
pour les synthèses mettant en jeu des gaz dissous comme le dioxyde de carbone
ou l'éthylène.
La cinétique des réactions chimiques faisant intervenir les concentrations
résiduelles en solution,
l'étude de leur solubilité dans ces liquides ioniques a trouvé un écho
particulier tant pour le milieu
académique qu'industriel.
Méthodologie Une masse connue de liquide ionique est introduite dans une
enceinte placée
sur une balance de précision et au sein de laquelle un vide poussé est
effectué. Lorsque la masse
du système ne varie plus, le vide est rompu et remplacé par le gaz étudié. Un
système d'enregis--
trement mesure simultanément la pression du gaz dans l'enceinte et la masse de
la phase liquide
du système lorsque l'équilibre est atteint. La variation de masse de la phase
liquide, due a la
dissolution du gaz dans le liquide ionique, permet alors d'accéder a la
fraction molaire du gaz
dans le solvant.
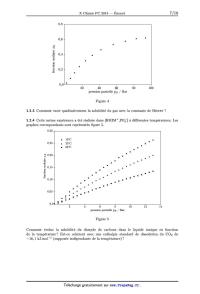
La courbe représentant la fraction molaire en dioxyde de carbone (notée 563) en
fonction
de la pression partielle (notée pg) du gaz dissous dans l'hexaflu0rophosphate
de 1--butyl--3--
méthylimidazolium [BMIM+,PF6_ ] a 50°C est reproduite figure 4.
1.2.1 Pourquoi effectuer un vide initial puis attendre que la masse ne varie
plus ?
1.2.2 On remarque que, si le comportement est linéaire a basse pression, il
n'en est pas de même
a haute pression. Proposer une interprétation pour ces deux régimes.
On définit la constante de HENRY K H comme le rapport de la fugacité du gaz f 3
a sa fraction
molaire en solution 5173 lorsque celle--ci tend vers 0 :
KH : lim (f--B).
oeB-->O SUB
Que représente la fugacité du gaz lorsque la fraction molaire du gaz dissous
(et donc sa pression)
tend vers 0 ? Que peut--on dire du coefficient d'activité V du gaz ? En déduire
une méthode de
calcul de la constante de HENRY d'un gaz a partir d'un graphe comme celui
reproduit figure 4.
Calculer la constante de HENRY du C02 dans le liquide ionique [BMIM+,PF6_ ] a
50°C.
0,8
0 6 - A '
' A
A
EQ
& A
Si
fil 074 _ A
O
E .
:
.9
4.7 A
% 0,2 -
$--4
"H A
A
0,0 ' . . . .
20 40 60 80 100
pression partielle pB / Bar
Figure 4
1.2.3 Comment varie qualitativement la solubilité du gaz avec la constante de
HENRY ?
1.2.4 Cette même expérience a été réalisée dans [BMIM+,PF6_ ] à différentes
températures. Les
graphes correspondants sont représentés figure 5.
0,30
. 10°C 0
0
0,25-- A 25°C .
50°C _ °
o
o
.
$ 0720" . . A A
8 A A
----4 . A
% o A
A
i 0,15- . ° . '
. A
% 0 A A I ' '
c6 . A ' I
È . A I .
0,10-- . A A . I '
. A . '
A I
0 |
o A A . I '
0,05-- 0 A ' . I
I
o A I
o A . '
A I
070 : . l l l l l l
2 4 6 8 10 12 14
pression partielle pB / Bar
Figure 5
Comment évolue la solubilité du dioxyde de carbone dans le liquide ionique en
fonction
de la température? Est--ce cohérent avec une enthalpie standard de dissolution
du COg de
--16, 1 kJ.mol_1 (supposée indépendante de la température)?
Afin de comparer l'efficacité des liquides ioniques pour la solubilisation de
différents gaz,
les constantes de HENRY (exprimées en bar a 298 K) de différents systèmes gaz /
solvant sont
rassemblées dans le tableau 1 ci--dessous.
[BMIM+ ,PF6-- ] heptane cyclohexane benzéne
H20 0,17 97 10
COQ 53,4 84,3 133,3 104,1
C2H4 173 44,2 82,2
CH4 1690 293,4 309,4 487,8
02 8000 467,8 811,9 1241
N2 > 20000 748,3 1331,5 2271,4
H2 > 15000 1477,3 2446,3 3927,2
Tableau 1 -- Constantes de HENRY de différents systèmes gaz / solvant
1.2.5 En quoi l'eau et le dioxyde de carbone constituent-ils un cas particulier
en ce qui concerne
la solubilité dans le liquide ionique ?
1.2.6 lnterpréter la différence de solubilité des autres gaz entre le liquide
ionique et les autres
solvants (voir les données en page 2). Quel paramètre semble être le plus
pertinent ?
1.2.7 Parmi les solvants présentés, est--il envisageable de réaliser
l'hydrogénation catalytique de
l'éthène dans le liquide ionique? lndustriellement, on réalise la réaction en
l'absence de solvant
en utilisant l'éthène gaz. Proposer une explication.
1.2.8 Comment interpréter la singularité observée pour l'eau ? Ceci permet--il
d'expliquer le cas
du COQ ?
1.3 Modélisation des interactions soluté-solvant
Compte tenu des pressions nécessaires a la mise en oeuvre de la plupart des
réactions orga--
niques impliquant le dioxyde de carbone, le comportement a basse pression,
linéaire, est particu--
lièrement intéressant. Un modèle théorique a ainsi été appliqué aux solutions
dans les liquides
ioniques afin de rationaliser les différents comportements.
Dans toute cette partie, un mélange A/ B est étudié a température et pression
constantes.
L'ensemble constitue une seule phase liquide homogène de volume global constant.
Pour toute grandeur extensive Z, on appelle grandeur Z de mélange, notée Amélz
, la diffé--
rence :
Amélz = ZF -- ZI--
L'indice "I" représente l'état initial, avant l'opération de mélange, et
l'indice "F" l'état final,
après l'opération de mélange. L'état final est un état d'équilibre dans lequel
chaque constituant
est a l'équilibre liquide-vapeur.
On note nA (resp. 713) la quantité de matière du composé A (resp. B) dans le
mélange.
La quantité de matière totale, fixe, est notée n et le nombre total de
molécules est noté N.
Thermodynamiquement, on note VAA le potentiel d'interaction entre deux
molécules A, VBB
entre deux molécules B et VAB entre une molécule A et une molécule B. On admet
que le
mélange liquide ionique / gaz solubilisé se comporte comme le mélange de deux
composés liquides.
On note pff, le potentiel chimique du corps pur 72.
Dans un premier temps le mélange est considéré comme idéal.
1.3.1 Définir ce qu'est un mélange idéal. Quelles sont conséquences sur les
énergies de paire VAA,
VBB et VAB ? À quelles conditions structurales un mélange A/ B peut--il être
considéré comme
idéal?
1.3.2 Donner l'expression du potentiel chimique de chacun des constituants du
mélange résultant,
en référence corps pur. Donner l'expression de l'enthalpie libre du système
avant l'opération de
mélange et l'enthalpie libre du système après l'opération de mélange en
fonction de la température
T, de la quantité de matière n et de la fraction molaire 563, de ,uÎ4 et ME .
En déduire l'expression
de l'enthalpie libre de mélange Amé1G en fonction des mêmes paramètres.
1.3.3 En déduire l'expression de l'entropie de mélange AméIS et commenter son
signe.
1.3.4 En déduire l'expression de l'enthalpie de mélange Amé1H. Oe résultat
était--il prévisible?
Est--il cohérent avec l'étude des interactions liquide ionique / gaz dissous
effectuée dans les parties
précédentes ?
1.3.5 En réalité le mélange liquide ionique / gaz dissous ne remplit pas les
conditions structurales
énoncées ci--dessus. Etait--ce prévisible ?
Le modèle idéal est trop grossier pour décrire ce mélange liquide ionique / gaz
dissous, essen--
tiellement pour ses conséquences drastiques sur la valeur de l'enthalpie de
mélange. Il est corrigé
dans le modèle des solutions régulières. Par hypothèse, une solution régulière
est un mélange au
sein duquel la répartition des constituants A et B dans le volume final se fait
parfaitement au
hasard, l'entropie de mélange gardant la même eæpressz'on que dans le modèle
idéal.
On note ?: le nombre moyen de plus proches voisins avec lesquels chaque
molécule A ou B du
mélange partage une énergie d'interaction. Afin de calculer l'enthalpie de
mélange dans le cadre
du modèle des solutions régulières, il est tout d'abord nécessaire de dénombrer
les différentes
interactions présentes avant et après le mélange.
1.3.6 Pour un mélange de deux solides ordonnés totalement miscibles, a quoi
correspond le
nombre z ?
1.3.7 On considère le système initial, avant le mélange. Exprimer le nombre de
paires A--A, noté
N A A, en fonction de N, ?: et 563. Exprimer de même le nombre de paires B--B ,
noté N B B. Sachant
que l'on néglige l'interface A/ B initiale, que vaut N A B, le nombre de paires
A--B ?
1.3.8 En déduire l'énergie d'interaction avant mélange, notée U [, en fonction
de N, z, 563 et des
potentiels d'interaction VAA, VBB.
1.3.9 On considère a présent le système final, après mélange. Parmi ses ?:
voisins, avec combien
de voisins A une molécule A est--elle en interaction ? Avec combien de voisins
B interagit--elle ?
13.10 En déduire le nombre de paires A--A, noté N Â A, en fonction de N, ?: et
553. Exprimer de
même le nombre de paires B--B , noté N ]'3 B et N Â B, le nombre de paires A--B
.
13.11 En déduire l'énergie d'interaction après mélange, notée U F, en fonction
de N, z, 563 et
des potentiels d'interaction VAA, VBB et VAE.
On admet qu'il n'y a pas de variation d'énergie cinétique et que par conséquent
l'enthalpie
de mélange est essentiellement due a la variation d'énergie intermoléculaire.
Dans ce cas :
Amé1H : UF -- U;.
1.3.12 Montrer que l'enthalpie de mélange peut se mettre sous la forme :
Amé1H=KXnXOEB >< (1--oeB). On donnera l'expression de K en fonction de 75, de la constante d'AVOGADRO NA et des potentiels de paires VAA, VBB et VAE. 1.3.13 Que vaut Amé1H si 2VAB = VAA + VBB ? À quel cas est--on alors ramené? 1.3.14 Que vaut Amé1H si 5173 vaut 0 ou 1 ? Oe résultat était--il prévisible? 1.3.15 Discuter le signe de Amé1H en comparant VAA + VBB et VAE. Dans quel cas le facteur enthalpique favorise--t--il le mélange ? 1.3.16 Donner l'expression de l'enthalpie libre du système final, notée Gp, en fonction de n, 563, Amé1H, AméIS , de T et des potentiels chimiques du corps pur ,uÎ4 et u*B. En déduire l'expression de Gp, en fonction de n, 563, T, K, ,uÎ4 et u*B. 1.3.17 En déduire l'expression du potentiel chimique de A, noté ,uA, en fonction de fil,, K, T et 553. Exprimer de même le potentiel chimique de B, noté ,uB, en fonction de u*B, K, T et 563. 13.18 En déduire le coefficient d'activité du composé A dans le mélange, noté FA. 1.3.19 De même, exprimer le coefficient d'activité du composé B, noté FB. Dans tout ce qui suit, on se place dans le cadre de solutions régulières diluées. Le solvant liquide ionique A est donc en très large excès par rapport au soluté B. 1.3.20 Comment les expressions des potentiels chimiques ,uA et ,uB se simplifient--elles (on négli-- gera les termes du second ordre et considérera que 2513 B est négligeable devant 1) ? 1.3.21 Traduire en terme de potentiel chimique l'hypothèse d'équilibre liquide--vapeur du liquide ionique A dans le cas où il est pur, puis dans le cas du mélange étudié. En déduire une relation entre la pression partielle en A, notée p A, la fraction molaire 56,4 et la pression de vapeur saturante de A (pË). Quel nom cette loi porte--t--elle ? 10 1.3.22 De la même manière, montrer que la pression partielle en B, notée p 3, est proportionnelle a la fraction molaire 5133. Donner l'expression de la constante de proportionnalité K1 en fonction de la pression de vapeur saturante de B (pÈ), K et T. 1.3.23 Justifier que la constante de proportionnalité K1 est alors assimilable a la constante de HENRY K H. À quelles conditions le mélange liquide ionique / gaz dissous est--il modélisable par le modèle des solutions régulières diluées ? 2 Deuxième partie -- Les PPAPS Un soin particulier est attendu dans l'écriture des mécanismes réactionnels; les formules utilisées dans les réponses auæ questions portant un astérisque (*) après le numéro devront obli- gatoirement être des formules de LEWIS et faire apparaitre les doublets non liants et les formes mésamères des intermédiaires réactionnels s'il y a lieu. Pour décrire le mécanisme dans les sché-- mas réactionnels, les candidats simplifieront l'écriture des molécules a la partie pertinente ( parties de molécules abrégées avec le sigle R ou R' par eæemple). Les données nécessaires a la résolution de certaines questions sont rassemblées en fin de partie. 2.1 Préparation du synthon précurseur de la (i)-clusianone La clusianone appartient a la famille des PPAPS (PolyPrenylated AcylPhloroglucinol ), molécu-- les naturelles utilisées en médecine traditionnelle dont les propriétés thérapeutiques couvrent un remarquable spectre d'activités : anti--cancéreux, anti--bactérien, anti--HIV, anti--dépresseur, anti-- inflammatoire, anti--neurodégénératif, anti--ulcéreux. . . selon la nature des substituants portés par une structure commune du type bicyclo[3.3.1]nonane--2,4,Q--trione ou bicyclo[3.2.1]octane--2,4,8-- trione. 0\ ° O\ ° O O o 0 o 0 Clusianone bicyclo [3 . 3. 1] nonane--2 ,4,9--trione bicyclo [3 . 2. 1] octane--2 ,4,8--trione Durant la dernière décennie, plusieurs stratégies de synthèses ont été élaborées afin de construire ces structures. Nous nous intéresserons a celle de Porco (2007), utilisée pour la synthèse de la (i)--clusianone (molécule isolée de Clusia, une famille de plantes poussant en Ouzbekistan, possédant une activité anti--HIV). Nous verrons comment cette stratégie a été utilisée en 2010 par le même auteur pour obtenir une molécule voisine, la (--)--hyperibone K (molécule isolée en 2004 de Hypericum scabrum, une plante poussant dans le Caucase, l'Asie centrale et l'ouest de la Sibérie et possédant une activité anticancéreuse). L'étape--clé de cette synthèse de la clusianone s'appuie sur la transformation en milieu basique d'un cycle benzénique hexasubstitué (noté [A]). 11 OH O C6H5 HO OH [A] | La synthèse de [A] s'effectue en deux étapes a partir du phloroglucinol (nom commun du 135-- trihydroxybenzëne) : la première étape est la réaction du phloroglucinol [1] sur le chlorure de benzoyle (1 équivalent) dans le toluène (C6H5--CH3) comme solvant en présence de trichlorure d'aluminium (AlClg) pour donner le produit [2] (de formule moléculaire C13H1004), aprés hy-- drolyse acide : DH 0 A|C|3 "' _) (C13H1004) C6H5ÀC| TO|UèHG HO DH [2] [1] 2.1.1 Quelle est le nom de la réaction entre le phloroglucinol [1] et le chlorure de benzoyle ? 2.1.2 * Ecrire le mécanisme de cette réaction en détaillant les étapes élémentaires {pour cette question l'écriture des formes mésomères sera limitée a 3 formes-limites). 2.1.3 Le chlorure d'aluminium doit--il être employé en quantité catalytique ou en excès? Pour quelle raison ? 2.1.4 Pour quel raison le toluène peut--il être employé comme solvant dans cette réaction malgré sa parenté structurale avec le réactif ? La deuxième étape est la formation de [A] (avec un rendement de 45 %) a partir de [2] par réaction avec deux équivalents de bromure de prényle (CH3)2C:CH--CHQ--BÏ (1--bromo--3-- méthylbut--2--ène) : OH C) C6H5 KOH (C13H1004) + 2 )\/\Br HO OH eau/éthanol [21 [A] | Le bromure de prényle est obtenu par addition d'acide bromhydrique (HBr) sur l'isoprène (2-- méthylbuta--l,3--diène : CH2:CH(CHg)--CH:CH2). 2.1.5 * Écrire le mécanisme de la réaction d'addition de l'acide bromhydrique sur l'isoprène en détaillant les étapes élémentaires du mécanisme. 12 Un produit isomère du bromure de prényle est également obtenu au cours de cette réaction. Les signaux de son spectre de résonance magnétique nucléaire du proton [a 300 MHz dans le chloroforme (CDClg)] sont les suivants : Déplacement chimique Multiplicité Constantes de couplage Intégration 5,5 ppm dd J1 : 16 Hz, J2 : 3 Hz 1 H 5,5 ppm dd J1 : 10 Hz, J2 : 3 Hz 1 H 5,0 ppm dd J1 : 16 Hz, J2 : 10 Hz 1 H 1,2 ppm singulet -- 6 H 2.1.6 Au moyen des tables données en fin de partie, attribuer les signaux du spectre RMN aux différents atomes d'hydrogène de ce produit et proposer une structure pour cet isomère. 2.1.7 * En reprenant le mécanisme proposé a la question 2.1.5, expliquer la formation de ce produit isomère. Dans des conditions mal contrôlées d'addition, l'acide bromhydrique réagit sur l'isoprène pour donner un polymère. 2.1.8 De quelle type de polymérisation s'agit--il? Préciser le motif du polymère de l'isoprène et les stéréoisomères possibles. La réaction du bromure de prényle avec [2] est réalisée en présence d'hydroxyde de potassium. 2.1.9 Quel est le rôle de l'hydroxyde de potassium ? 2.1.10 * Quel autre type de réaction pourrait--on attendre entre le bromure de prényle et [2] ? Donner le mécanisme de cette réaction. 2.1.11 * Proposer un mécanisme expliquant la formation de [A] a partir de [2]. 2.2 Synthèse de la (i)-clusianone Le phloroglucinol [A] est mis a réagir en présence d'hexaméthyldisilamidure de potassium (KHMDS ) et d'un aldéhyde oz, 5--éthylénique [B] dans le tétrahydr0furane (THF) a 65°C. On obtient, après hydrolyse acide, le produit [3] qui possède la structure du type bicyclo[3.3.1]nonane-- 2,4,9--trione, ce produit est transformé en éther d'énol [4] par une réaction qui n'est pas détaillée ici. Le rendement de la transformation [A] + [B] --> [4] est de 54 %.
OH O O
\
C6H5 oJJ\ KHMDS 0
HO OH + _)
o THF, 65 °C
|
[A] [B] H
13
Les auteurs ont observé que le remplacement d'un groupe hydroxy par un groupe
méthoxy
sur le cycle aromatique d'un dérivé similaire (noté [A']), dans lequel les
groupes prényle (--CH2--
CH:C(CH3)2) sont remplacés par des groupes allyle (--CHg--CH:CH2), ne conduit
pas, dans des
conditions voisines (aldéhyde oz, fi--éthylénique [B] et Lil--[MDS au lieu de
KHMDS ), a un produit
possédant la structure bicyclique attendue, mais a une molécule (notée [A"])
dont la structure
est donnée ci--dessous.
o o 0
OH C) )]\
\ o LiHMDS C6H5
C6H5
+ _»
MeO DH 0 THF, 65°C CHO
/
| H "
[A] [B] [A ]
2.2.1 Indiquer, en justifiant votre réponse, la position des sites
électrophiles sur l'aldéhyde oz, fi--
éthylénique [B].
2.2.2 En vous appuyant sur le résultat de la deuxième expérience
(transformation [A'] + [B]
--> [A"]), proposer une structure pour le composé intermédiaire (que l'on
nommera ...) de la
première étape de la transformation de [A] + [B] en [3].
2.2.3 * Proposer un mécanisme expliquant cette étape [A] + [B] --> [I].
2.2.4 Déterminer les sites électrophiles et les sites nucléophiles présents sur
l'intermédiaire [I].
2.2.5 * Sur la base du résultat de la question précédente, des structures de
[I] et de [3], et en
tenant compte des conditions de la transformation [A] + [B] --> [3], proposer
un mécanisme
expliquant la transformation [I] --> [3].
L'étape suivante de la synthèse ([4] --> [5]) est la réaction de [4] avec un
organomagnésien
mixte préparé dans le tétrahydr0furane a partir du bromure de vinyle
(bromoéthène : CH2:CH--
Br) et de magnésium métallique. Après hydrolyse et extraction, le produit [5]
est transformé
en ester [6] au moyen d'anhydride acétique (noté Ac20 avec Ac : --CO--CHg) dans
le dichloro--
méthane en présence de 4--N , N --diméthylaminopyridine (DMAP) et de
diz'sopropyléthylamine :
[(CH3)2CH]2NCHQCH3.
O
\ / 1) MgBr \N/
A O
O OMG C6H5 fi CZ \
--> [5] --> ] /
o 2)H20 DMAP N
diiSOpfOle DMAP
éthylamine
2.2.6 Écrire l'équation de la réaction de formation de l'organomagnésien mixte.
2.2.7 L'eau détruit les organomagnésiens. Pour quelle raison ?
14
2.2.8 Comment procède--t--on pour éviter la présence d'humidité dans le milieu
réactionnel ?
2.2.9 Le contact entre un organomagnésien mixte et le dioxyde de carbone est
également a éviter.
Pour quelle raison ?
2.2.10 * Donner le mécanisme de la réaction de formation de l'ester [6]. Quel
est le rôle de la
DMAP ?
L'étape suivante est une réduction de l'ester [6] par le formiate d'ammonium
(HCG; , NHÎ)
en présence d'un catalyseur au palladium. On obtient le composé [7]) du dioxyde
de carbone et
de l'acétate d'ammonium (CH3COE, NHÎ).
OMG C6H5
HC021 NH4+ + + 002 + CH3COZ',NH4+
2.2.11 Écrire les demi--équations d'oxydo--réduction pour chacun des couples
mis en jeu dans la
réaction.
L'étape suivante est une métathèse qui permet de remplacer la chaîne --CH:CH2
par
--CH:C(CH3)2. On obtient le composé [8].
OMG C6H5 Métathèse
Le chlorure de lithium (LiCl) en solution dans le DMSO (diméthylsulfoxyde :
CHg--SO--CHg)
permet, après hydrolyse et extraction, la transformation de [8] en
(i)--clusianone.
clusianone
Le diméthylsulfoxyde est un solvant aprotogène (ou aprotique) très polaire; la
molécule possède
un moment dipolaire de 4,05 D et le solvant une constante diélectrique EUR =
46, 9. La solubilité
du chlorure de lithium dans le DMSO est de 10,2 g pour 100 mL a 298 K.
2.2.12 Expliciter la nature et l'intensité (qualitativement) des interactions
entre le DMSO et le
chlorure de lithium ?
15
2.2.13 Quelles sont les conséquences de cette solvatation sur les caractères
électrophile et nu--
cléophile des ions présents en solution ?
2.2.14 * Proposer un mécanisme expliquant la réaction de déméthylation de [8] en
(i)--clusianone par le chlorure de lithium dans le DMSO.
2.3 Synthèse de la (--)-hyperibone K
Les mêmes auteurs ont préparé la (--)--hyperibone K par une réaction similaire
a celle étudiée
dans la partie précédente. La réaction de l'aldéhyde oz, fi--éthylénique
légèrement modifié (noté
B') sur [A] est réalisée en présence d'une base chirale dans des conditions de
transfert de phase.
OH @ O '? OH
\ O
C6H5 )[\C6H13 Base
HO C6H5
chirale O O
| 71 %, 90 % ee
[A] [E'] H [9]
2.3.1 Expliquer, au moyen de diagrammes énergie potentielle : f (coordonnée
réactionnelle),
comment l'utilisation d'une base chirale permet, dans des conditions de
contrôle cinétique dans le
cas de la transformation [A] + B' --> [9], d'obtenir un énantiomère très
majoritaire, alors qu'une
base achirale (cas de la transformation [A] + [B] --> [3]) conduit a un mélange
racémique.
2.3.2 * En reprenant l'analyse de la réaction [I] --> [3] examinée dans la
partie 2.2, indiquer quelle
modification stéréochimique se produit pour obtenir la transformation [I] -->
[9] (la justification
de cette modification stéréochimique n'est pas demandée). On précise que les
intermédiaires [I]
dans les transformations [A] + [B] --> [3] et [A] + [B'] --> [9] sont
structurellement identiques.
La fin de la synthèse de la (--)--hyperibone K est effectuée en deux étapes. Le
composé [9]
est traité par le diisopropylamidure de lithium (base forte), puis par un
organomagnésien mixte
(CH3)QC:CHMgBr Après hydrolyse, on isole le produit [10].
4(N--Li MgBr
% F
--> [9'1'----'[9"] -->
2.3.3 Écrire l'équation de la réaction entre le diisopropylamidure de lithium
et [9]. Donner la
structure de l'intermédiaire obtenu (noté [9']).
[9'] est en équilibre avec un isomère [9"]. Écrire la structure de cet isomère
[9"].
16
2.3.4 * Écrire le mécanisme de la réaction conduisant a [10] a partir de
l'organomagnésien mixte
et de l'équilibre [9'] : [9"] (préciser l'espère réagissante : [9'] ou [9"]).
2.3.5 Donner le nombre de centres stéréogènes de [10]. Préciser les
descripteurs stéréochimiques
des atomes de carbone signalés par une étoile dans le dessin suivant (utiliser
la numérotation four-
nie dans le dessin pour la justification des descripteurs stéréochimiques des
centres stéréogènes).
Enfin7 [10] est mis a réagir avec le trifluorométhanesulfonate de scandium
[(CF3803)3Sd,
un acide de LEWIS qui permet de former des carbocations a partir des alcools
benzyliques et
allyliques.
(CF3803)3SC
[10'] _,
C6H5
[10] (--)-hyperibone K
2.3.6 Écrire la structure du carbocation [10'] formé par action du
trifluorométhanesulfonate de
scandium sur [10]. Préciser les éléments structuraux expliquant la stabilité
particulière de ce
carbocation.
2.3.7 Le carbocation [10'] se cyclise pour donner) aprés hydrolyse, la
(--)--hyperibone K. Quel
type de réactivité doit posséder l'atome de carbone avec lequel réagit le
carbocation pour former
le système polycyclique? Proposer un isomère de [10'] possédant la structure
permettant de
réaliser cette réaction de formation de cycle.
2.3.8 Préciser la géométrie du carbocation et expliquer l'origine de la
stéréosélectivité de la
réaction de formation de la (--)--hyperibone K a partir du carbocation 10'.
17
Données :
Électronégativités (Échelle de PAULING) : XH : 2, 1 ; XC : 2, 2; XN : 3; XO =
3, 5; XS : 2, 5.
Tables de spectroscopie RMN 1H
Déplacements chimiques
Substituant groupe fonctionnel déplacement chimique
(en ppm)
X--CH2-CH3 0,8 -- 1,5
X--CH2-CH2-- 1,3 -- 2,0
--CH--phénylc 2,4 -- 2,6
--CH--halogène F 4,3 -- 4,4
Cl 3,0 -- 3,5
Br 2,7 -- 3,4
1 2,1 -- 3,2
--CH--OR alcool 3,4 -- 3,6
éther 3,2 -- 3,4
ester 3,7 -- 4,2
--CH--NRR' amine 2,5 -- 2,8
amide 2,8 -- 3,3
--CH--COR aldéhyde 2,2 -- 2,5
cétone 2,1 -- 2,5
acide 2,1 -- 2,4
ester 2,0 -- 2,3
:C--H aromatique 6,5 -- 8,0
:C--H vinylique non conjugué 4,9 -- 6,0
:C--H vinylique conjugué 4,5 -- 7,0
--CEC--H acétylénique non conjugué 1,8 -- 2,0
--CEC--H acétylénique conjugué 1,3 -- 3,4
Constantes de couplage H--H
CH--CH (rot. lib.) H2C:C HC:CH cis HC:CH trans
J/Hz 6--8 0--3 6--12 12--18
Dans la description des spectres de résonance magnétique nucléaire, les
multiplicités des
signaux sont données de la manière suivante : s, singulet ; d, doublet ; t,
triplet ; q, quadruplet ; m,
multiplet ou massif. Ainsi dd signifie que le massif apparaît sous forme d'un
doublet de doublet.
L'intégration des signaux est donnée dans les spectres sous la forme 77. H, 77.
étant le nombre
d'atomes d'hydrogène magnétiquement équivalents.
18
