X Chimie PC 2013
| Thème de l'épreuve | Étude des zéolithes et synthèse du Rippertenol |
| Principaux outils utilisés | chimie organique (aldolisation, Diels-Alder, organomagnésien, Friedel-Crafts, estérification), acido-basicité, thermochimie |
| Mots clefs | zéolithes, rippertenol, oxoacide, surface spécifique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
ECOLE POLYTECHNIQUE -- ECOLES NORMALES SUPÉRIEURES
ECOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2013 FILIÈRE PC
COMPOSITION DE CHIMIE -- (XEULC)
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée pour cette épreuve.
***
Présentation générale.
Ce sujet comporte deux parties indépendantes. Dans la première partie nous vous
invitons
a découvrir les zéolithes, des minéraux poreux provenant des cendres
volcaniques, et dans la
deuxième partie nous vous proposons d'étudier la synthèse du rippertenol, une
molécule utilisée
par les termites pour se défendre de leurs prédateurs.
L'utilisation de la calculatrice n'est pas autorisée. Les masses, rayons
atomiques,
électronégativités et numéros atomiques de certains atomes, les distances
interato--
miques de certaines liaisons et d'autres données sont fournis en fin du sujet.
Première partie : CHIMIE GÉNÉRALE
Les zéolithes : des solides microporeux
Préambule
Les zéolithes sont des minéraux microporeux, qui sont actuellement utilisées
dans plusieurs
domaines, tels que la catalyse, l'adsorption de métaux toxiques et la
formulation des lessives.
Ce sont des alumino--silicates hydratés présents a l'état naturel. Ils se sont
formés, il y a des
millions d'années, par recristallisation des cendres volcaniques dans des lacs.
Ces solides ont été
décrits pour la première fois par le minéralogiste suédois Axel Frederik
Cronstedt en 1756. Leur
nom vient du grec Çéw (zeô) "bouillir" et Ài90ç (lithos) "pierre". En effet,
comme ces solides
présentent une grande surface spécifique, ils peuvent contenir une quantité
importante d'eau, qui
peut être évacuée en chauffant, d'où le nom "pierre qui bout".
La découverte des zéolithes se fera a travers un parcours de questions
commencant par les
oxoacides moléculaires, en passant par la notion de polyacidité pour enfin
comprendre l'acidité
de ces solides. De plus, la porosité de ces solides sera étudiée. Ces deux
propriétés, acidité et
grande surface, sont a la base de leurs applications en catalyse acide et dans
la séparation de
constituants.
I Les oxoacides
Nous vous proposons de découvrir la spécificité des oxoacides par rapport aux
autres acides, et
de retrouver la relation entre leur structure et leur acidité (pK A). Lorsque
le pK A d'un oxoacide
HA sera mentionné, il est sous--entendu qu'il s'agira du pK A du couple acide /
base HA / A_.
LA De l'exemple à la définition
1. Donner la structure de Lewis des acides nitrique, carbonique et sulfurique.
Indiquer leur
géométrie par rapport a l'atome central en la justifiant.
2. Donner la valeur du pK A de l'acide éthanoïque (valeur approximative).
Comparer ce pK A
a celui de l'alcool primaire le plus proche en structure, que l'on précisera,
et justifier la
différence d'acidité.
3. Selon le même raisonnement, justifier l'évolution des pK A dans la série
suivante : HClO,
HC102 et HClOg (Tableau (1)).
4. Pour la série de la question (3), écrire chacun des acides en utilisant la
formule générale
X(O)n(OH)p, avec X : Cl. En déduire une équation linéaire
approximative qui permet de retrouver leur pK A.
des oxoacides suivante :
OECfl
. Déterminer le pKA de HClO4.
. Un écart entre la valeur estimée par la relation approximative établie en (4)
et la valeur
expérimentale est observé car l'acidité est modulée par l'atome X. Proposer une
explication
a cette différence dans le cas des acides chlorique et iodique.
Acide Nom pK A1 pK A2 pK A3
HNOg acide nitrique --1,4
HF acide fluorhydrique 3, 2
HCl acide chlorhydrique --7
HClO acide hypochloreux 7, 5
HClOg acide chloreux 2,0
HC103 acide chlorique --2, 7
HClO4 acide perchlorique - - -
HIOg acide iodique 0,8
H2C03 acide carbonique 3, 9 10, 3
H3B03 acide borique 9, 2 12, 7 13, 8
H2803 acide sulfureux 1, 8 7, 2
HgSO4 acide sulfurique --2 2
H3PO4 acide phosphorique 2, 1 7, 2 12, 4
H3P03 acide phosphoreux 2,0 6, 7
H3AsO4 acide arsénique 2, 2 7,0 11, 5
H4SiO4 acide orthosilicique - - - - - - - - -
Tableau 1 : Valeurs de pK A pour différents acides.
I.B L'acide borique : un oxoacide un peu spécial
7. Proposer la structure de Lewis de l'acide borique, sachant que c'est un
acide de Lewis.
8. Ecrire l'équation de la réaction exprimant l'acidité de cette molécule dans
l'eau, sachant
que l'acide borique n'exprime pas son acidité par la rupture d'une liaison O--H
préexistante.
II
Des monoacides aux polyacides : étude détaillée
(P. Chaquin, L'Actualité Chimique 2012, 359, 37--41)
II.A pKA et structure
9.
10.
11.
Ecrire l'équation de la réaction (El) de dissociation d'un oxoacide en solution
aqueuse, tra--
duisant la première acidité. Par souci de simplification, il sera noté HAaq.
Etablir l'expres--
sion de l'enthalpie de cette réaction en fonction des données thermodynamiques
suivantes :
. enthalpies de solvatation AH°S de HAgaz et des ions H+ et A_ a l'état gazeux;
. affinités électroniques AE que l'on précisera;
. énergies d'ionisation Ei que l'on précisera;
. énergie de liaison D que l'on précisera.
On dessinera le cycle thermodynamique utilisé pour cette étude en précisant la
nature et
l'état physique des espèces impliquées.
Montrer que le pK A1 de l'oxoacide HA peut s'écrire sous la forme :
pKA1 : a + b (DHA--AE(A)--TATSO)
où a et b désignent des termes invariants pour la famille des oxoacides et où
ATSO désigne
l'entropie standard de la réaction de dissociation de l'oxoacide HA et T la
température
absolue. Expliciter les approximations effectuées, et donner les expressions de
a et b en
fonction des données.
Ecrire l'équation de la réaction (EZ) qui traduit la première acidité de HA en
phase gazeuse.
Pour la famille des oxoacides, a T fixée, les représentations de pK A en
fonction des enthal--
pies libres standard A.,.Gog et des enthalpies standard ATHOQ de cette réaction
prennent la
forme de deux droites parallèles (Figure (1)). Déduire une propriété du terme
entropique
pour la réaction traduisant l'acidité de HA en phase gazeuse pour la famille
des oxoacides
représentés.
20-
pKA
kJ/mol
1100 1200 1300 1400 1500 1600 1700
Figure 1 : pK A en solution aqueuse en fonction de ATHOQ et A.,.Gog de quelques
oxoacides.
12.
On admet que cette propriété est encore conservée en phase aqueuse pour l'étude
qui est
conduite. En outre, en admettant que la rupture homolytique d'une liaison ne
dépend
quasiment que de la nature des atomes de la liaison et pas des voisins, montrer
que le
pKA1 de l'oxoacide HA se met sous la forme : pKA1 : a' + b' AE(A), où a' et b'
désignent
des termes invariants pour la famille des oxoacides. Donner les expressions de
a' et b'.
II.B Utilisation d'un modèle électrostatique simple
On tient compte a présent de la formule générale des oxoacides X(O)...,(OH)p
possédant plu--
sieurs acidités. Pour la
13.
14.
15.
16.
17.
18.
kième acidité, l'anion formé s'écrit [X(O)n+k(OH)p_k]kî
Pour l'acide phosphorique (X : P), indiquer les anions successivement formés.
Sur la forme
monobasique, indiquer en le justifiant, le nombre d'atomes d'oxygène de la
molécule sur
lesquels la charge négative est répartie. Montrer que l'atome P participe
également a la
délocalisation de la charge négative de la monobase.
Pour l'oxoacide de formule X(O)n(OH)p, indiquer le nombre total d'atomes N qui
parti--
cipent a la délocalisation électronique de la charge négative de la monobase,
et exprimer
N en fonction de n.
L'anion monobase [X(O)n+1(OH)p_l]_ peut être modélisé par une sphère
conductrice de
rayon R1 dont le volume est égal au volume total des atomes sur lesquels la
charge négative
est répartie. En première approximation, on peut considérer tous ces atomes
comme des
sphères identiques de volume v. Donner l'expression du rayon R1 de cette sphère
en fonction
de n et de v.
Dans ce modèle, l'énergie électrostatique W1 de l'anion monobase
[X(O)n+1(OH)p_l]_,
noté aussi A_, sphérique, de rayon R1 et de charge Q est W1 : , 6 étant la
permit--
Æ
tivité du milieu.
En ne prenant en compte que l'énergie électrostatique, montrer simplement que
l'on peut
relier W1 et l'affinité électronique de A9 par une relation affine, dont les
coefficients sont
invariants dans la famille des oxoacides. Déterminer l'expression de W1 en
fonction de n et
de v. Déduire une relation entre pK A1 et W1 sous la forme : pK A1 : a" + b"
W1. Donner
l'expression de b". On ne demande pas d'expliciter a".
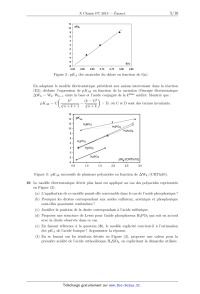
Mettre la relation trouvée ci--dessus sous la forme pK A1 : a" + Of(n), f étant
une fonction
de 77. sans dimension a préciser. Donner l'expression de O en fonction de v, T
et EUR. La
Figure (2) traduit cette relation pour les oxoacides du chlore dont les pK A
sont donnés
dans le Tableau (1). Attribuer les différents points a chacun de ces oxoacides.
En déduire
graphiquement la valeur de pK A de l'acide perchlorique. Comparer avec la
valeur obtenue
en question (5).
La kième acidité en solution aqueuse est traduite par la réaction (ES)
d'équation :
{Xn+k_lp_k+fl--OEq + H20 : [X<0>n+k<0H>p_kr--aq + H30+aq
En adaptant l'étude thermodynamique des questions (9) et (10) a l'étude de la
réaction
(ES), montrer que l'on obtient pour la kième acidité, avec k > 1 :
pKAk : 04 + 5 (AE,k -- AE,k-1)
où A E, ;EUR désigne l'affinité électronique associée au processus de perte de
k charges négatives
par l'anion de nombre de charge k, et où oz et 5 sont des coefficients
invariants dans la
famille des oxoacides.
_\
N
_ PKA
_\
0
f(")
àoôäLù0N-hoeoe
llllllll
0,55 0,60 0,65 0,70 0,75 0,80 0,85
Figure 2: pK A des oxoacides du chlore en fonction de f(n).
En adaptant le modèle électrostatique précédent aux anions intervenant dans la
réaction
(ES), déduire l'expression de pK A], en fonction de la variation d'énergie
électrostatique
AW}, : Wk--Wk_1 entre la base et l'acide conjugué de la k1ème acidité. Montrer
que :
iç2 (k--1)2
pKAk:C 3 -- 3
Vn+k+1 Vn+lc
16
14 -
) + D, où C et D sont des termes invariants.
_2 - H2804
AWk/(CRTIn10)
0,5 1:0 1:5 2:0 2,5 3,0
Figure 3: pK A], successifs de plusieurs polyacides en fonction de
AWk/(CRTln10).
19. Le modèle électrostatique décrit plus haut est appliqué au cas des
polyacides représentés
en Figure (3).
(a) L'application de ce modèle paraît--elle convenable dans le cas de l'acide
phosphorique ?
(b) Pourquoi les droites correspondant aux acides sulfureux, arsénique et
phosphorique
sont--elles quasiment confondues ?
(c) Justifier la position de la droite correspondant a l'acide sulfurique.
(d) Proposer une structure de Lewis pour l'acide phosphoreux H3P03 qui soit en
accord
avec la droite observée dans ce cas.
(e) En faisant référence a la question (8), le modèle explicité convient--il a
l'estimation
des pK A de l'acide borique ? Argumenter la réponse.
(f) En se basant sur les résultats décrits en Figure (3), proposer une valeur
pour la
première acidité de l'acide orthosilicique H4SiO4, en explicitant la démarche
utilisée.
III Les zéolithes : des solides poreux
Les zéolithes sont des aluminosilicates poreux cristallisés basés sur un réseau
de tétraèdres
[TO4] reliés par leurs sommets (T : Si4+, A13+, B3+, ). Dans le cas de la
zéolithe ZSM--5
la formule générale est [Nan
OAc
Figure 11 : Synthèse de 6 a partir de 4.
10
38.
39.
40.
Le groupement TBDPS est un groupement protecteur, il restera présent sur cet
oxygène
jusqu'à la fin de la synthèse, la déprotection n'ayant lieu qu'à la dernière
étape.
Proposer une structure pour 5 sachant qu'il présente en infra--rouge une bande
large vers
3300 cm_1 et que l'éthanoate de méthyle est le sous--produit de la réaction.
Proposer un mécanisme pour la réaction 4 --> 5.
lnterprétez le spectre RMN 1H de 6 dans CDC13 a 400 MHZ (Figure (12)). On ne
fera pas
de distinction entre les différents protons aromatiques, ni entre les protons
des CH2 inclus
dans le cycle.
TBDPSO
l i @l it
| | | | | | | | 1 | | | | | | | | | '
8.0 7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 ppm
Figure 12: Spectre RMN 1H de 6 dans CDCl3. Les intégrations sont indiquées sur
les pics.
41.
42.
43.
Lors du passage de 5 a 6 l'imidazole joue a la fois le rôle de nucléophile et
de base. Ecrire
la formule protonée de l'imidazole en justifiant le site de protonation.
La réaction entre un équivalent de diisopropylamidure de lithium (i--Pr2NLi :
LDA) et un
équivalent du composé 6 conduit a un intermédiaire qui est ensuite mis en
présence d'un
équivalent d'iodométhane pour fournir le composé 7. L'action de
l'organomagnésien 8 en
présence de cuivre (I) dans le THF sur le composé 7 conduit au dérivé 9 de
formule brute
C30H4204Sl isolé avec un rendement de 86 %. En présence d'acide
pam--toluènesulfonique
et d'eau, 9 est chauffé au reflux du benzéne pendant 48 h et conduit tout
d'abord a un
intermédiaire A qui, dans ces conditions réactionnelles, se cyclise en
fournissant 10 (Figure
(13)).
Le LDA est préparé m situ par réaction entre un équivalent de diisopropylamine
et un
équivalent de butyllithium. Ecrire l'équation--bilan de cette réaction.
Proposer une structure pour 7, sachant que l'on obtient un nouveau centre
stéréogène et
que l'on observe un nouveau signal en RMN 1H intégrant pour trois protons et
sous forme
de doublet. On ne se préoccupera pas de la stéréochimie du nouveau centre
stéréogène
formé.
11
44.
45.
46.
47.
48.
49.
50.
51.
52.
O O
1)
O Berlg &
o
p--TSOH,HgO Me
1) LDA, THF, -78°C CuBr
0 -- z-- -- -- «
2) Mel, -78°C
Me 2) NH4CI, H20 Me
OTBDPS @ OTBDPS 1_0
| \D
O
Acide pam-toluènesulfonique : +|s--w
0
Figure 13: Synthèse de 10 a partir de 6.
Donner le mécanisme de formation de 7.
Pouvait--on utiliser, a la place du LDA, de l'hydroxyde de sodium (NaOH) ou du
butylli--
thium (BuLi) lors du passage de 6 a 7 ? Justifier votre réponse.
Proposer une synthèse en deux étapes de l'organomagnésien 8 a partir du
3--bromopropanal
B (Figure (14)). On prendra soin de discuter l'ordre relatif de ces 2 étapes.
lè /\J'\
Br H
Figure 14: Composé B.
Rappeler les conditions expérimentales pour synthétiser un magnésien a partir
d'un halo--
génoalcane. On précisera en particulier les réactions parasites a éviter et les
précautions a
prendre.
Dessiner le montage d'une synthèse magnésienne. Donner deux moyens pour faire
démarrer
la réaction si cela se révèle nécessaire.
Donner la structure de 9 sachant que dans son spectre infra--rouge on observe
la disparition
de la bande présente a 1591 cm_1 dans le spectre de 7, que la bande a 1678 cm_1
pour 7
se décale a 1711 cm_1 pour 9, et qu'il comporte de plus une fonction acétal.
Par ailleurs,
l'action de l'organomagnésien 8 en présence de cuivre (I) dans le THF sur le
composé 7
conduit au dérivé 9 selon un processus analogue a celui obtenu avec un
organocuprate de
lithium.
Expliquer a l'aide d'un modèle simple, pourquoi la bande a 1678 cm_1 se décale
a 1711 cm--1
lors du passage de 7 a 9.
Quel est le rôle du traitement acide lors du passage de 7 a 9 ? Peut--on
utiliser HCl/HgO
pour effectuer ce traitement acide ?
En présence d'acide pam--toluènesulfonique et d'eau, 9 donne tout d'abord un
produit mo--
nocyclique A dont le spectre RMN 1H présente un proton ayant un déplacement
chimique
a 9 ppm. Proposer une structure pour cet intermédiaire A.
12
53. Donner le mécanisme pour le passage de 9 a A.
54. Proposer un mécanisme permettant de rendre compte de la formation de 10 a
partir de A.
Justifier la régiosélectivité de la dernière étape de cette séquence.
Le composé 10 en milieu acide réagit avec la 4--chlorobutan--2--one pour
conduire au composé
11. Celui--ci se cyclise en présence d'une base, le tert--butanolate de
potassium, pour former
12. La fonction alcool de 12 réagit ensuite avec le chlorure de
méthanesulfonyle (MsCl)7
puis une réaction d'élimination d'acide méthanesulfonique a partir du mésylate
formé m
situ conduit a 13 (Figure (15)).
O 0
Me P'T50Ha 80°C t-BuOK, THF
NEC]
o = --1--2--
0
Et3N
Me )J\/\ (excès) Me
Me Cl
fi Me
OTBDPS
MSC]: Me--S--Cl _ OTBDPS
Figure 15: Synthèse de 13 a partir de 10.
55. Donner la structure de 11 ainsi que le mécanisme de sa formation. Justifier
la stéréosélec--
tivité de la réaction. Préciser le rôle de l'acide para--toluènesulfonique.
56. Proposer une structure pour le composé tricyclique 12.
57. Donner le mécanisme de la réaction mise en jeu lors du passage de 11 a 12.
58. L'action du chlorure de méthanesulfonyle sur un alcool en présence de
triéthylamine permet
de réaliser la réaction représentée dans la Figure (16). Proposer un mécanisme
pour cette
réaction sachant que la triéthylamine permet l'élimination d'une molécule d'HCl
a partir
du chlorure de méthanesulfonyle (MsCl).
59. Cette réaction permet de transformer la fonction hydroxyle en un bon groupe
partant.
Justifier.
O O
Et3N + ROH + Me--!--Cl : O_!_Me "' EÏ3NHC1
l « L'
Figure 16: Action du chlorure de méthanesulfonyle sur un alcool en présence de
triéthylamine.
60. Donner la suite de transformations conduisant de 12 a 13.
61. Préciser le type de mécanisme mis en jeu dans la réaction d'élimination
conduisant a 13.
Tracer le profil réactionnel [Ep : f(coordonnée réactionnelle)] correspondant
et préciser la
loi cinétique ainsi que les ordres partiels et l'ordre global.
Le composé 13 donne le composé 14 par une réaction de Diels--Alder (Figure
(17)).
13
62.
63.
64.
OTBDPS
OTBDPS
Figure 17: Synthèse de 14 a partir de 13.
Rappeler la règle d'Alder.
Pour justifier la régiosélectivité de la réaction, le diène a été modélisé par
la molécule 15
et le diénophile par la molécule 16 (Figure (18)).
3 OMe
////,1
Figure 18: Molécules 15 et 16.
On donne les énergies associées a chacune des orbitales moléculaires du système
7r notées
%- obtenues par la méthode de Hückel. On note gb,- l'orbitale atomique 2p de
l'atome
i correspondant. On considère que le groupement méthoxy se comporte comme un
seul
atome avec un doublet libre qui participe aux orbitales moléculaires 7r
localisées.
Pour 15 :
El : 04 + 1,94 Ô, 1ÿ1 : 0,13 ÇÔ1 + 0,26 ÇÔ2 + 0,37 ÇÔ3 + 0,46 ÇÔ4 + 0,52 ÇÔ5 +
0,55 @@
E2 : 04 + 1,50 6, @D2 : -- 0,37 Çb1 -- 0,55 çÔ2 --0,46 çÔ3 -- 0,13 ÇÔ4 + 0,26
ÇÔ5 + 0,52 @@
E3 : 04 + 0,71 Ô, @b3 : 0,52 Çb1 + 0,37 fig --0, 26 çÔ3 --0, 55 çÔ4 --0, 13 ÇÔ5
+ 0,46 @@
E4 : Oz -- 0,24 Ô, @b4 : -- 0,55 ÇÔ1 + 0,13 ÇÔ2 + 0,52 çb3 -- 0,26 çÔ4 -- 0,46
ÇÔ5 + 0,37 @@
E5 : Oz -- 1,14 Ô, @b5 : 0,46 Çb1 -- 0,52 çÔ2 + 0,13 ÇÔ3 + 0,37 çÔ4 --0,55 ÇÔ5
+ 0,26 @@
Pour 16 :
El : a + 2732 fi) (pl: 0714 @1 + 0733 @2 + 0794 @3
E2 : Oz + 0784 53 îb2 : -- 0773 @1 -- 0761 @2 + 0732 @3
E3 : a _ 1707 fi) Ù3 : _ 0768 @1 + 0772 @2 _ 0715 @3
Identifier les orbitales frontières de 15 et 16.
Les données fournies par la méthode de Hückel permettent--elles de justifier la
régiosélecti--
Vité observée ?
14
65.
66.
67.
68.
69.
70.
VI
En analysant la nature des orbitales frontières du diène et du diénophile
interagissant,
justifier que cette réaction soit qualifiée de réaction de Diels--Alder a
demande inverse.
Proposer un modèle d'approche permettant de justifier la stéréochimie observée
lors du
passage de 13 a 14.
Le composé 14 réagit dans les conditions de Takai--Oshima--Lombardo (Zn, TiCl4,
CH2Br2)
pour conduire au composé 17 (Figure (19)). Le produit obtenu est similaire a
celui qu'aurait
donné la réaction entre 14 et l'ylure de phosphore (Ph) 3P:CH2.
@
O
H Me
H CHzÀ, 17 _, 18 _,
Me . Me
Me
OTBDPS 14 OTBDPS 1_9
Figure 19: Synthèse de 19 a partir de 14.
Proposer une synthèse de l'ylure de phosphore (Ph) 3P:CH2 a partir
d'iodométhane et de
tout réactif nécessaire.
Donner la structure de 17.
Donner la structure de 18.
Proposer des conditions réactionnelles pour transformer 18 en 19.
Le rippertenol est ensuite obtenu en trois étapes a partir de 19 par des
réactions plus
complexes.
Données
VI.A Masses et rayons atomiques de Van der Waals
Atome H C N 0 Al Si Ar
Masse atomique /g.mol_1 1 12 14 16 27 28 40
Rayon atomique /pm 120 170 155 152 205 210 188
VI.B Electronégativités selon l'échelle de Pauling
Atome H B C N 0 F Al Si P S Cl Br l
x 2,2 2,04 2,55 3,04 3,44 3,98 1,61 1,9 2,19 2,58 3,16 2,96 2,66
15
VI.C Numéros atomiques Z
Atome
HBO
N
0 F
Si
SCI
Br
Z
156
7
8 9
14
16 17
35
VI.D Distances interatomiques pour certaines liaisons
Liaison H--H
C--H C--C
C--N C--O
C:C
C--C Benzëne NEN
Distance / pm 74
109 153
147 143
134
140
110
VI.E Déplacements chimiques 5 en ppm en RMN du proton
CH3--C--
CHg--C:C--
--C:C--CH--
--CH2--CO--
CH3--O--
--CHOR--
--CH:CH--
C6H5--H
0,8--1,1
1,6--2,0
2,0-2,5
2,2--2,8
3,4--3,8
3,6--4,5
5,2--6,0
7,3
VI.F Nombres d'onde des bandes d'absorption I.R. d'alcools, d'alcènes et de
deux cétones en cm_1 (R groupe aliphatique saturé)
R--OH
C:C
<:>=o
Q=o
3200--3400
1580--1680
1717
1685
VI.G Autres données
Constante universelle des gaz parfaits R : 8,3 J .K_1.mol_1
Constante d'Avogadro NA : 6,0 X 1023 mol--1
cos 300 = @
Tétraèdre AB4 : angle(B--A--B) : 109, 50 : EUR, -- cos9 : 1/3
2
Racines:fl=1,4g Jä=1,7; Jä=2,2; EUR/î=1,3; EUR/ä=1,4; EUR/1=1,6; EUR/ä=1,7
16
