X Chimie PC 2006
| Thème de l'épreuve | Étude d'un polymère fluoré. Synthèse du clovène. |
| Principaux outils utilisés | polymérisation, cinétique chimique, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
ÉCOLE POLYTECHNIQUE
ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2006 FILIÈRE PC
COMPOSITION DE CHIMIE
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée.
L'épreuve comporte deuoe problèmes indépendants.
***
Premier problème
Étude d'un polymère fluoré
Données :
Numéros atomiques : F : Z = 9; C : Z = 6.
Électronégativités dans l'échelle de Pauling : F : 3,98; O : 3,44; C : 2,54; H
: 2,20.
Masse atomique : F : 19 g--mol"1.
Rayons de Van der Waals : F : 135 pm, H : 120 pm, CH3 : 200 pm.
Distances interatomiques : C--C : 154 pm, C--H : 110 pm.
cos (35, 26°) = 0,81 ; cos (38,940) : 0,77 ; cos (109,47") = --0,33 .
Depuis la découverte du polytétrafluoroéthylène (PTFE) par Roy J. Plunkett en
1938, les
polymères fluorés ont fait preuve d'une facilité d'adaptation qu'aucun autre
matériau n'a pu
égaler. Leurs propriétés antiadhésives, ainsi que leurs inerties thermique et
chimique ont fait le
succès du PTF E, commercialisé sous la marque Teflon® et celui d'autres
copolymères.
Nous proposons d'examiner quelques propriétés structurales et thermodynamiques
du PTFE,
puis sa synthèse et enfin un procédé de préparation des polymères fluorés gràce
à une réaction
de télomérisation, décrite par la suite, et dont l'étude sera abordée a l'aide
de deux mécanismes
réactionnels, l'un par initiation radicalaire, l'autre par catalyse
d'oxydoréduction.
I. Propriétés structurales et thermodynamiques du PTFE
Nous comparons tout d'abord les propriétés de quelques hydrocarbures et
fluorocarbures.
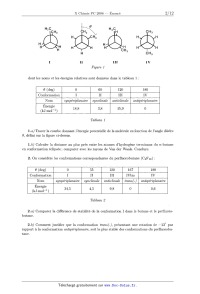
1. Considérons les quatre conformations (I à IV) du butane représentées en
projection de
Newman.
H3C î"'**--Î H3C
CH3 CH3 H CH3
H CH'3 H H
H C' !! H l\ I\
H ' H H . H H ' H H ' H
H H CH3 CH
3
1 11 111 IV
Figure]
dont les noms et les énergies relatives sont données dans le tableau 1 :
......
5,9
Énergie '
1 1
(kJ-mol_ 1) ___--
Tableau ]
La} Tracer la courbe donnant l'énergie potentielle de la molécule en fonction
de l'angle dièdre
9, défini sur la figure ci--dessus.
1.b) Calculer la distance au plus près entre les atomes d'hydrogène terminaux
du n--butane
en conformation éclipsée; comparer avec les rayons de Van der Waals. Conclure.
2. On considère les conformations correspondantes du perfluorobutane (C4F10) :
-----
5 9 8 0,6
Énergie
(kJ'm01"1)-"-
Tableau 2
2.a} Comparer la différence de stabilité de la conformation I dans le butane et
le perfiuoro--
butane.
2.b) Comment justifier que la conformation trans(-), présentant une rotation de
--130 par
rapport a la conformation antipéflplanaire, soit la plus stable des
conformations du perfiuorobu-
tane.
3. L'étude des conformations du butane et du perfluorobutane peut servir de
modèle pour
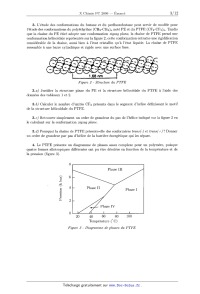
l'étude des conformations du polyéthylène (CH2-CH2)n noté PE et du PTF E
(CF2--CF2)n. Tandis
que la chaîne du PE étiré adopte une conformation zigzag plane, la chaîne de
PTFE prend une
conformation hélicoïdale représentée sur la figure 2, cette conformation
entraîne une rigidification
considérable de la chaîne, aussi bien à l'état cristallin qu'à l'état liquide.
La chaîne de PTFE
ressemble a une barre cylindrique et rigide avec une surface lisse.
3.a} Justifier la structure plane du PE et la structure hélicoïdale du PTFE à
l'aide des
données des tableaux 1 et 2.
3.b} Calculer le nombre d'unités CF2 présents dans le segment d'hélice
définissant le motif
de la structure hélicoïdale du PTFE.
3.0) Retrouver simplement un ordre de grandeur du pas de l'hélice indiqué sur
la figure 2 en
le calculant sur la conformation zigzag plane.
3.d) Pourquoi la chaîne de PTFE présente--elle des conformères trans(-) et
trans(+} ? Donner
un ordre de grandeur par pas d'hélice de la barrière énergétique qui les sépare.
4. Le PTFE présente un diagramme de phases assez complexe pour un polymère,
puisque
quatre formes allotropiques différentes ont pu être décelées en fonction de la
température et de
la pression (figure 3).
Pression (k bar)
20 40 60 80 100
Température (0 C)
Figure 3 - Diagramme de phases du PTFE
4.a} Que représentent les frontières p = f (T) des différents domaines ?
4. b ) Donner l'expression de la chaleur latente de changement de phase en
fonction des volumes
molaires des deux phases et de la pente de la courbe p = f (T) du changement
d'état considéré.
4.c) Que signifie une pente positive ?
4.d} Quels sont les changements de phase du PTFE observables sous la pression
de 1 bar?
5. Dans un domaine cristallin de la phase II, on ne trouve que des hélices
comportant unique--
ment soit des conformations trans(+}, soit les conformations trans(--), dans la
chaîne polymérique
(voir structure de la figure 2). La masse volumique de la phase Il vaut 2,35
g--cm"3 et celle de la
phase IV 2,30 g-cm"3 . La phase III ne comporte que des conformations zigzag
plane.
5.a} À quel(s) phénomène(s) peut--on attribuer à l'échelle moléculaire les
changements de
phases Il ----> IV et IV ----> I?
5.b} Pourquoi la phase III ne peut--elle être obtenue qu'à haute pression ?
5.6} Que se passe--t--il a la fusion du polymère (Tf : 3300 C) sachant que
celle--ci s'accompagne
d'une dilatation de 25 a 30% ?
6. Le PTFE est en fait un polymère semi--cristallin (63% de cristallinitë) dont
la température
de transition vitreuse est de 120°C.
6.a} Qu'appeIIe--t--on polymère semi--cristallin ?
6.b) À quel phénomène peut--on attribuer cette transition vitreuse ?
6.c} Le PTFE est a la fois hydrophobe et lipophobe. Justifier pourquoi.
II. Synthèse du polytétraflu0roéthylène
Le réactif initial, le trichlorométhane, est traité par le fluorure d'hydrogène
en présence d'un
acide de Lewis, le pentafluorure d'antimoine, on obtient ainsi le
chlorodifiuorométhane.
La transformation du chlorodifluorométhane en tétrafluoroéthène se produit en
phase vapeur
vers 700°C en présence de platine comme catalyseur.
1. Écrire l'équation bilan de la transformation.
2. La polymérisation du tétrafluoroéthylène en PTFE s'effectue grâce a un
mécanisme de
polymérisation radicalaire. Préciser les différentes étapes de ce mécanisme
réactionnel en donnant
un exemple d'initiateur de radicaux.
III. Préparation de polymères fluorés par télomérisation
La réaction de télomérisation est un mode particulier de polymérisation dans
laquelle un télo--
gène (X--Y) réagit avec quelques molécules d'un monomère R2(Ë=CR2 pour donner
un polymère
du type X--(CR2-CR2)n-Y.
1. Écrire l'équation bilan dans le cas où le télogène est le
1,1,1,2--tétrafluoro--2--iodoéthane et
le monomère est le tétrafiuoroéthène.
Données :
Énergies de liaison en kJ-mol"l : C-F : 546; C-H : 446; C-I : 213; cc : 348.
2. Une étude expérimentale réalisée a 1750 C fournit la répartition suivante en
fraction molaire
pour différents polymères de courte chaîne (oligomères) :
Pourcentages respectifs des polymères précédents : X--(CF2--CF2)n--Y suivant la
valeur de n
n=1:70% n=2:20% n=3:10%
2.0.) Définir et donner l'expression numérique de la masse molaire moyenne en
nombre Mn
du polymère obtenu.
2.b} Définir et donner l'expression numérique de la masse molaire moyenne en
masse MW du
polymère obtenu.
2.c} Déterminer la polymolécularité du polymère obtenu.
Données :
Masses molaires respectives approchées en g-mol_1 des polymères selon la valeur
de n :
n=1:M1æ400;n=2:M2oe500;n=3:M3æ600.
IV. Etude cinétique de la réaction de télomérisation avec amorçage radicalaire
La polymérisation par amorçage radicalaire satisfait au mécanisme réactionnel
simplifié sui-
vant dans lequel A2 est la molécule d'amorceur, X--Y le télogène et M le
monomère éthylénique :
A2 ---> 2A' constante de vitesse kd
Amorçage : A' + X--Y --> A-- Y +X' réaction rapide
X' + M --> X -- M° réaction rapide
Propagation : X -- Mg + M --> X -- M;I+1 constante de vitesse kp
Terminaison : X--M; + X--M;l --+ polymère constante de vitesse kt
1. Donner l'expression de la vitesse d'amorçage.
2. Dans ce mécanisme, X ---- M; représente n'importe quel radical carboné
contenant le mo--
nomère. Donner alors l'expression de la vitesse de propagation.
3. Donner l'expression de la vitesse de la réaction de terminaison.
4. Dans l'hypothèse des chaînes longues, on peut estimer que la vitesse
d'amorçage est égale au
double de la vitesse de terminaison. Déterminer alors la concentration en
centres actifs [X -- MR].
5. Le degré de polymérisation moyen DPn est défini comme le rapport de la
vitesse de
propagation a la somme des vitesses de disparition des centres actifs.
5.a} Donner l'expression de DPn en fonction des constantes de vitesse et des
concentrations
en espèces stables du milieu.
5.b) Commenter l'influence de la concentration de l'amorceur et du monomère sur
le DPn.
V. Étude mécanistique de la réaction de télomérisation avec catalyse
d'oxydoréduction
De nombreux travaux ont mis en évidence l'intérêt de l'utilisation de cations
métalliques
Me"+ dans les réactions de télomérisation. L'un des mécanismes proposés est le
suivant :
{acc13 + Men+ --> Mec1n+ + Reel;
Amorçage :
RCC15 + M ----> RCClgM°
Propagation : R.CClgM.'1 + M --> RCC12M;+1
Transfert de chaîne : RCClgM.'1 + RCC13 ----> RCClgMHCI + RCC15
Terminaison : RCClgMä + MeCln+ ----> RCClgMDCl + Men+
1. Écrire le mécanisme dans le cas où le télogène est le tétrachlorométhane, le
monomère
éthylénique le chlorotrifluoroéthène et le cation l'ion Fe2+.
2. Pourquoi s'agit-il d'une catalyse d'oxydoréduction ?
F ... du premier problème
Deuxième problème
Synthèse du clovène
Données en RMN du proton
Déplacements chimiques 5 en ppm
Données de spectroscopie infrarouge (LR)
3,6--4,4
-CH2-CO- -oH2-o-oo -OC--CHg-CO-- -CH=CH- (cycle) HO--C=C-
2,2--2,8 1,7-2,1 3,4--3,8 5,2--6,0 10--12
CH3--C- CH3-o:o- CH3--C-CO-- CHg--O-- -CHg--O-
0,9-1,1 1,6--2,0 1,3-1,4 3,4_4,0
Nombres d'onde des bandes d'absorption du carboner en cm"
(R, R' groupes aliphatiques saturés)
--OH (alcool)
3650--3600 (libre)
3500--3250 (lié)
Nombres d'onde des bandes d'absorption du OH en cm"1
Le clovène noté A est un sesquiterpène naturel de formule brute C15H24 présent
dans de
nombreuses huiles essentielles comme l'essence de vétiver utilisée en
parfumerie. Sa structure
tricyclique pontée (un pont CH2), représentée ci--dessous en projection plane
et dans l'espace,
rend sa synthèse délicate et implique une approche particulière au cours de sa
préparation.
1. Indiquer quels sont les atomes de carbone asymétriques du clovène A, puis
représenter un
diastéréoisomère possible de A.
2. Le réactif B utilisé comme produit de départ de cette synthèse est la
cyclohexane--l,3-dione.
Les déplacements chimiques des protons du spectre RMN, obtenus de manière
expérimentale,
d'une solution de B dans le chloroforme deutérié sont comparés ci--dessous avec
ceux calculés,
obtenus par simulation du spectre RMN de B.
Déplacements chimiques (ppm) et multiplicité des protons
nombres de orotons obtenus -ar inté ration
Spectre de la
2,01 2,252,77 5,5 11,25
multiplet (ZH) multiplet (4H) singulet (1H) singulet (1H)
solution de B
dans CDC13
Spectre de B 1,85 2,45 3,61
simulé quintuplet (ZH) triplet (4H) singulet (ZH)
En outre, le spectre l.R. de la solution de B révèle deux bandes
caractéristiques : une bande
principale forte à 1586 cm"1, et une bande très large entre 2200 et 3200 cm_1
centrée sur
2800 cm_1.
Z.a} Attribuer de façon claire les différents déplacements chimiques des
protons du spectre
simulé de B.
2.b) Quel phénomène chimique mettent en évidence les différences observées
entre les deux
spectres? En déduire la structure de la forme prépondérante de B dans ces
conditions, puis
effectuer l'attribution correspondante pour les déplacements observés.
Z.c} Expliquer la valeur particulièrement basse du nombre d'onde de la bande
principale
d'absorption en I.R. de B.
3. La dione B est mise en solution dans un mélange de toluène et d'éthanol (4/1
en volume)
en présence d'une quantité catalytique d'acide para-toluènesulfonique. La
solution obtenue est
ensuite portée au reflux à l'aide d'un réfrigérant équipé d'un appareil de
Dean--Stark. Cet appareil
permet notamment l'élimination de l'eau au fur et à mesure de sa formation.
Après extraction
de la phase réactionnelle, traitement et distillation sous vide,/on récupère un
produit liquide C
de formule brute CgH1202, avec un rendement de 75%. Le spectre RMN proton dans
CDC13
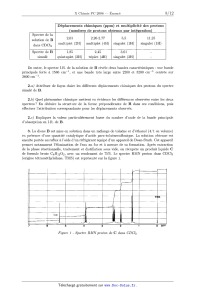
(origine tétraméthylsilane, TMS) est représenté sur la figure 1.
Figure 1 - Spectre RMN proton de C dans CDCZ3
3.a} Dans quel but utilise--t--on un Dean--Stark ?
3.b) À partir des données fournies, écrire l'équation--bilan de la réaction
puis identifier le
composé C formé.
3.c) Par analogie avec le mécanisme d'acétalisation en milieu acide, proposer
un mécanisme
justifiant la formation de C.
4. Le composé C est ensuite traité par un léger excès de diisopropy1amidure de
lithium (LDA)
dans le THF à --78°C, avant qu'une solution d'iodure de méthyle CH31 dans le
THF n'y soit
ajoutée lentement à la même température. Après réaction et traitement, on isole
D auquel on
ajoute dans les mêmes conditions, après un traitement préalable par le LDA, une
solution de
1--bromo--3--chloropropane. Ceci conduit a E de formule brute C12H19C102.
4.a) Quels sont les atomes d'hydrogène de C qui possèdent un caractère acide?
Écrire les
formules des énolates obtenus dans chaque cas par action du LDA. Quel est
l'énolate le plus
stable thermodynamiquement ? Justifier votre réponse.
4.b) Sachant qu'au cours du traitement de C, puis de D, par le LDA, les
énolates, majo--
ritairement formés cinétiquement, ne sont pas les plus stables
thermodynamiquement, donner
les mécanismes des réactions conduisant à l'obtention de D et E, en précisant
leurs structures
stériques.
4.0} Pourquoi n'obtient--on pas plutôt une cétone bromée au cours de la
réaction donnant
naissance a E ?
5. Par action de LiAlH4 dans l'éther (éthoxyéthane) anhydre, E est transformé
en F qui
est isolé après neutralisation (solution aqueuse de chlorure d'ammonium). F est
ensuite dissous
dans l'éthanol en présence d'acide chlorhydrique aqueux, puis le mélange obtenu
est agité à
température ambiante, ce qui conduit finalement à G.
0
(CH2)3CI
5.a} Pourquoi faut--il travailler en milieu anhydre pour préparer F ? Donnez la
formule semi--
développée de F.
5.b) Donnez un mécanisme succinct décrivant l'action de LiAIH4 sur E par
analogie avec
celui de la réduction d'une cétone par NaBH4. Quel est le nombre d'équivalents
théorique de
LiAlH4 que l'on doit utiliser par équivalent de E ?
5.0} Quel intermédiaire F' obtient-on par hydrolyse de F ? Expliquer pourquoi
F' se trans--
forme facilement en G dans les conditions utilisées, en détaillant le mécanisme
de la réaction.
6. G est alors soumis à l'action du LDA dans
le THF à basse température puis mis en présence de
2--(bromométhy1)but--1--ène, ce qui permet d'obtenir H.
Ce dernier composé est a son tour traité par un léger excès
de LDA dans les mêmes conditions opératoires que ci--dessus.
La température du mélange réactionnel est ensuite ramenée
à la température ambiante et l'agitation est prolongée une
journée. Après un traitement approprié, I, dont la structure 1 C2H5
est donnée ci--contre, est finalement isolé.
6.a} Donner la structure de H.
6.b) Détailler l'étape de formation de I.
6.c} Quel produit secondaire pourrait être formé lors de la synthèse de H ?
7. L'énone I est portée au reflux dans l'éthanol en présence d'une quantité
équimolaire de
tétracarbony1hydruroferrate de potassium K[HFe(CO)4]. Ce réactif, source
d'hydrure, réagit de
manière analogue à celle d'un dialkylcuprate de lithium sur une énone. Le
mélange réactionnel
est ensuite hydrolysé dans de l'eau glacée pour conduire à J . L'ozonolyse en
milieu réducteur du
composé J donne ensuite naissance à K, de formule brute C14H2202.
7.a} Donner la structure du produit J obtenu après hydrolyse.
7.19) Donner la formule de K résultant de la réaction d'ozonolyse de J, et
indiquer quel
réducteur il est possible d'utiliser. Quel autre produit organique est
également formé au cours
de cette étape '?
7 .c ) Pourquoi ne peut--on pas effectuer directement une hydrogénation
catalytique de I pour
aboutir à J ?
8. La formation du squelette carboné final du clovène est réalisée par
chauffage du composé
K dans le méthanol au reflux en présence de KOH. Le produit obtenu est L dont
la structure
est donnée ci--dessous :
8.a) Quels sont les protons acides de K ?
8.b) Proposer un mécanisme réactionnel permettant de passer de K a L. Comment
s'appelle
cette réaction ?
8.6) Écrire les formules des autres produits possibles lors de cette réaction.
9. Le précurseur du clovène L est en fait ré--
duit en alcool saturé M par un réactif que l'on
ne précisera pas, puis traité par le réactif de Jones
(Cng/HQSO4) pour donner N. Ce dernier possède
notamment une bande d'absorption intense en I.R.
à 1740 cm"1. La méthylation de N ne conduisant
qu'à un mélange inséparable de plusieurs composés, O
N est mis à réagir avec du méthanoate d'éthyle au
reflux du toluène en présence de méthanolate de so-- \
dium. Le produit () (C15H2202) formé dans ces condi-
tions dont la bande principale observée en I.R. se si--
tue à 1675 cm"17 est traité par la N--méthylaniline \
CH3N(H)C5H5 dans le méthanol en présence d'acide
pam--toluènesulfonique. Le produit résultant P possède
la formule semi--développée indiquée ci--contre.
9.a} Donner la structure de N.
9. b ) Proposer un mécanisme pour expliquer successivement la formation de O et
de l'énamine
P. Préciser la structure de O.
10. La méthylation de P par de l'iodure de méthyle en milieu basique (NaNH2)
fournit Q.
Puis la fonction énamine de Q est hydrolysée en présence d'un mélange 1 : 1
d'acide chlorhydrique
6 mol.L"1 et de méthanol a chaud. Le produit résultant R est traité par une
solution aqueuse
de potasse (KOH) pour donner S dont la structure est donnée ci--dessous.
S est ensuite réduit par LiAlH4 dans l'éther anhydre pour donner T. Le
traitement de T
par C1C02Et dans la pyridine fournit alors U, de formule brute C18H3003, qui,
par chauffage. à
300°C, permet d'obtenir le clovène A.
10.a) Décrire schématiquement les transformations réalisées et donner les
structures des
intermédiaires successifs R, T et U.
10.b) Par analogie avec la décarboxylation des fi--diacides généralement
réalisée en fin de
synthèse malonique, imaginer un mécanisme expliquant la formation du clovène A,
sachant
qu'on observe au cours de cette ultime étape un dégagement gazeux important.
10.c) Quelle était l'utilité de la séquence de transformations réalisées au
paragraphe 9. ?
10.d) Identifier la transformation clé qui fixe la stéréoehimie du clovène en
précisant a quelle
étape on pourrait former un autre diastéréoisomère du clovène.
