X Chimie PC 2004
| Thème de l'épreuve | Du magnésium au chauffe-plat chimique. Le furane. |
| Principaux outils utilisés | thermochimie, diagrammes binaires, oxydoréduction, courbes intensité-potentiel, chimie organique, théorie de Hückel |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Énoncé obtenu par reconnaissance optique des caractères
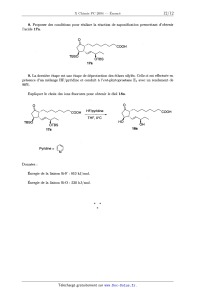
ÉCOLE POLYTECHNIQUE ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES CONCOURS D'ADMISSION 2004 ' FILIÈRE PC COMPOSITION DE CHIMIE (Durée : 4 heures) L'utilisation des calculatrices n'est pas autorisée. L'épreuve comporte deuæ problèmes indépendants. *** Premier problème ' Du magnésium au chauffe--plat chimique Données Numériques Potentiels standard d'oxydoréduction (en V) : Fe2+ (aq) / Fe(s) _=----0, 44 V Mg2+/Mg =--2;35 v Na+(aq)/Na(s) =--2,72 V RT à 298 K = 2,5 kJ.mol"1 Constante de Faraday : F = 96 500 C.mol"1 RT/F >< Ln 10 a 298 K = 0,06 V Enthalpie standard de sublimation du magnésium " : A...,Hc> : 151 k.].mol"1 Enthalpie standard de dissociation de la liaison dans la molécule 02 \ : AdiSH° : 494 kJ .mol_1 Énergie de première ionisation du magnésium : 738 kJ.mol"1 Énergie de deuxième ionisation du magnésium : 1447 kJ.mol"1 Enthalpie d'attachement électronique : de l'atome d'oxygène : O + e" --> O" --141 kJ.mol_1 de l'anion oxygène : O" + e" --> O2_ 851 kJ.mol'1 Enthalpie standard de formation de MgO(s) : 4602 k.].mol"1 Produit de solubilité de Mg(OH)2(3) ; Ks : 10--10,8 ' Masses molaires : Mg : 24,3 g.mol"1 Ni : 58,7 g.mol"1 Mg(OH)2 : 58,3 g.mol"1 Masse volumique : p(Mg)=1)74 g.cm"3 ' I. La magnésie Ou oxyde de magnésium 1. Proposer une méthode pour calculer l'enthalpie réticulaire du cristal MgO, AretH° (MgO), à partir des données fournies. Le calcul numérique fournit |AoetH0 (MgO)l = 3895 kJ.mol"'; préciser le signe. 2. La chaleur de réaction à volume constant de la réaction de combustion du magnésium se détermine expérimentalement en utilisant une bombe calorimétrique qui constitue un système isolé thermiquement à volume constant. a) Établir la relatiOn liant la chaleur de réaction ainsi déterminée à l'enthalpie standard molaire de la combustion du magnésium. b) On dispose au laboratoire du matériel et des réactifs suivants : -- un calorimètre et ses accessoires (agitateur, thermomètre de précision) de capacité calori-- fique connue; -- une balance de précision; ---- du magnésium et de l'oxyde de magnésium purs; -- une solution molaire d'acide chlorhydrique; une fiole jaugée de 100mL. Proposer un protocole expérimental permettant une détermination indirecte de l'enthalpie de combustion standard, AcombHo, du magnésium, connaissant l'enthalpie standard de formation de l'eau liquide à 298 K, Af(H2O)HO. On admettra que la capacité calorifique de la solution d'acide chlorhydrique est peu différente de celle d'un égal volume d'eau. / ° / ' \ , - ' , - . . 0 Detafller les exper1ences a reahser et etabhr la relat10n haut AcombH aux valeurs exp- érimentales obtenues. - II. Alliage magnésium--nickel 1. Le diagramme de phases du système Mg--Ni ( P = 1 bar) est donné sur la figure 1. En abscisse, est porté le titre en masse de Ni, exprimé en % de Ni. Il présente deux eutectiques E1(%Ni = 24l;TE1 = 783 K) et E2(%Ni = 90 ;TE2 = 1368 K). On admettra qu'il n'existe pas de solubilité mutuelle en phase solide. On donne les températures de fusion suivantes : TËuS(Mg) = 923 K ; TËuS(Ni) = 1726 K ; TËuS(Ni2Mg) = 1418 K Le composé Nng2 se décompose à 1033 K pour donner le composé N i2Mg et un liquide dont le pourcentage en masse de Ni est 48%. Compléter le diagramme dans les domaines (1,5,6,9) en précisant la nature des phases mises en présence ainsi que la variance du système. T(K) 1600 1400 1200 1000 0 10 20 30 40 50 60 70 80 90 100 % Ni en masse Figure 1 2. Donner l'allure des courbes de refroidissement isobare des alliages liquides de titre %... = 85 et 95 dans l'intervalle 1700 K -- 700 K. Indiquer pour chaque portion de ces courbes la variance, les phases en présence ainsi que l'évolution de leur composition. III. Le magnésium, combustible d'un chauffe-plat chimique Le magnésium conStitue le combustible d'un chauffe--plat chimique breveté aux U.S.A en 1981 et représenté sur la figure 2. plateau repas scellé sac poreux @ élément chauffant eau salée bac en polystyrène expansé Figure 2 L'élément chauffant est constitué par une fine grenaille de magnésium (incorporant 5% de fer) dispersée parmi des billes de polyéthylène haute densité; le tout est placé dans un sachet poreux fixé au fond d'un bac sur lequel vient s'adapter le plateau repas à chauffer. La mise en marche s'opère par addition d'eau salée dans le bac. On réchauffe le plateau--repas en moins de 15 minutes. Observations L'ajout d'eau salée au solide contenu dans le sac poreux se traduit par une forte effervescence s'accompagnant rapidement d'un échauffement notable et d'un dégagement de vapeur. On peut vérifier que les bulles de gaz qui se dégagent sont inflammables. Quand l'opération est terminée . on constate que la grenaille , métallique a disparu et qu'elle fait place à une bouillie blanche (hydroxyde de magnésium) dispersée sur les billes de polyéthylène. 1. Étude thermodynamique &) Déduire des observations précédentes l'équation--bilan de la réaction notée ( 1) modéli-- sant la transformation réalisée dans l'élément chauffant. b) Déterminer l'enthalpie standard de cette réaction à 298 K a l'aide des données du tableau 1 ; comparer sa valeur à celle de la réaction du sodium avec l'eau. Mg(OH)2(S) H2O(l) Na+HO*(aq) Enthalpie standard de formation (kJ.mol--1) , --924 ----286 --240 ---230 Tableau 1 Des deux métaux étudiés, quel est celui qui conduit à. la réaction la plus exothermique -- pour le même nombre de moles de métal consommé ? -- pour le même nombre de moles d'électrons échangés ? Pour quelle raison n'utilise--t--on pas le sodium dans ce type de dispositif chauffant ? c) À l'aide des données du tableau 2, proposer une méthode pour calculer la valeur des potentiels redox standard des couples Mg2+(aq)/Mg(s) et Na+(aq)/Na(s). Le calcul des valeurs numériques des deus: potentiels redoæ, qui sont fournies dans les données, n'est pas demandé. solvatation de l'ion Mn+ atomisation en M(9) ionisation de l'atome en ion Mn+ Magnésium (3) 114,2 2191,2 --1903, 3 Sodium (8) 497,5 --410,0 Dihydrogène (g) . 203,3* 1313,4 --1088, 7 * par mole d'atome d'hydrogène _ Tableau 2 : Enthalpies libresstandard de' transformatibns successives (kJ par mole de produit)." Déterminer la valeur de la constante d'équilibre associée à la réaction notée (1) définie à la question La) ci--dessus. Que peut--on en conclure '? 2. Aspect cinétique &) À la différence du sodium, à température ambiante, le magnésium est sans action sur l'eau distillée et désaérée. Quelle est la cause de cette inhibition de l'oxydation du magnéSium par l'eau? Comment se nomme ce phénomène '? Interpréter la différence de comportement du magnésium et du sodium. b) À quelles conditions le phénomène précédent peut--il se produire ? Quelle relation doit--on observer entre les volumes molaires du magnésium et de son hydroxyde ? Vérifier cette relation sachant que la masse volumique de l'hydroxyde de magnésium est égale à 2,4 g.cm'3. La condi-- tion précédente est nécessaire mais elle n'est pas suffisante pour entraîner l'inhibition constatée. Quelles conditions sont susceptibles de l'empêcher ? c) On observe expérimentalement que l'attaque du magnésium par l'eau devient possible en présence de chlorure de sodium. Sachant que des chlorohydroxydes complexes se forment à la surface d'une lame de magnésium trempée dans une solution de chlorure de sodium, par réaction d'échange d'anions chlorure / hydroxyde, quelles propriétés de la couche obtenue peuvent expliquer cette observation ? (1) Si on place une lame de magnésium fraîchement décapée dans une solution neutre de chlorure de sodium, on constate la formation de fines bulles gazeuses a sa surface, mais à une vitesse beaucoup trop lente pour que le système constitue une bonne source de chaleur. De plus, les bulles gazeuses restent << accrochées >> à la surface, ce qui entrave la poursuite de la réaction. En revanche, si on met en contact la lame de magnésium avec une lame de fer on Observe un dégagement gazeux intense au niveau de la lame de fer et la réaction "se poursuit jusqu'à disparition complète du magnésium. Proposer une interprétation fondée sur l'utilisation des courbes intensité--potentiel. e) L'expérience précédente ne rend pas compte toutefois de l'intensité du dégagement de chaleur observé. Même en utilisant du magnésium. et du fer en poudre, on ne parvient pas à atteindre l'efficacité thermique du dispositif breveté. L'examen à la loupebinoculaire ne permet pas de déceler deux métaux différents : tous les grains présentent le même aspect, celui d'un métal de couleur argentée à reflets légèrement dorés, ce qui laisse supposer que du fer est pro-- bablement plaqué a la surface du magnésium. Indiquer, en le justifiant, un protocole expérimental permettant de déposer superficiellement du fer sur une lame de magnésium. f) Mais l'oxydation par l'eau salée d'une lame de magnésium ainsi traitée n'est pas encore suffisamment rapide pour rendre compte du fonctionnement du chauffe--plat chimique. L'examen du brevet révèle que l'alliage métallique utilisé s'obtient en traitant le mélange des poudres métalliques dans un moulin à billes d'acier de haute énergie sous atmosphère inerte. On obtient ainsi des grains de diamètre de l'ordre de 200 nm constitués de particules de fer de 30 nm disséminées dans une matrice formée de particules de magnésium. Quel est l'intérêt de ce procédé en termes d'état de surface, et, à quantité de fer et magnésium donnée, d'aire active électrochimique ? Deuxième problème Le -furane Le furane, noté 1, présente la structure suivante : Données R.M.N . : Déplacements chimiques (6 , ppm) de quelques types d'hydrogènes de molécules organiques I. Structure électronique du furane Nous nous proposons d'examiner les orbitales moléculaires (OM) du furane, noté 1. Les valeurs de l'intégrale coulombienne et de l'intégrale de résonance pour effectuer les calculs d'or-- bitales moléculaires par la méthode de Hückel simple sont les suivantes : Pour un oxygène contribuant pour deux électrons au système 7r : ao=a+2/B /8C0=078fl Pour un oxygène contribuant pour un électron au système 77 : ao=a+fi flco=ÿ 1. Quels sont les paramètres qui conviennent pour l'oxygène dans le cas du furane ? Justifier. 2. Écrirele déterminant séculaire permettant de trouver les OM du système 71" du furane. 3. Les OM du système 7r du furane sont décrites dans le tableau suivant : Energies Coefficients des atomes Quelle est l'énergie de l'orbitale moléculaire la plus haute occupée (HO) ? Même question pour l'orbitale moléculaire basse vacante (BV) ? 4.a) Dans le cadre de l'approximation des orbitales frontières, quelle est l'interaction prin-- cipale à considérer lors de l'attaque du furane par un électrophile ? b) En analysant les coefficients de l'orbitale du furane impliquée dans cette attaque, préci-- ser la régiosélectivité de l'addition d'un électrophile sur le furane (dans le cas d'une réaction sous contrôle frontalier). 5.3) Calculer l'énergie totale Edelç exprimée en unité fi, des électrons 77 du furane délocalisé. b) Calculer l'énergie totale Elo... exprimée en unité fi, des électrons 7r du furane en suppo-- sant les doubles liaisons localisées. c) Calculer l'énergie de résonance du furane, définie comme la différence entre Edel et E.... Peut-on dire que le furane est aromatique ? Comparer son énergie de résonance à celle du benzène (2fl). Conclure. 6. Le spectre R.M.N . du proton du furane présente un premier signal à 7,30 ppm et un second a 6,25 ppm. &) Effectuer les attributions de ces différents signaux en vous aidant des données R.M.N. b) En comparant les déplacements chimiques des hydrogènes du benzène à ceux des hy-- drogènes portés par une oléfine simple, confirmez--vous votre réponse à la question 5.c) sur l'aromaticité du furane '? II. Réaction de cycloaddition Le furane 1 est susceptible depréagir en tant que diène dans la réaction de Diels-A1der. Ce type de réaction permet notamment de protéger momentanément la double liaison de l'anhydride maléique 2. 2 1. Écrire l'équation--bilan de la réaction entre le furane 1 et l'anhydride maléique 2. 2. Quelles orbitales frontières interagissent de façon prépondérante lors de l'approche de ces deux réactifs ? Justifier. 3. Le mélange chauffé pendant 48 heures à 40°C dans l'acétonitrile conduit au seul produit 3EUROE0. , ' 0 0 ' o 1/ \) + | 0 / O O H 0 H 0 1 2 ... 3exo Si le chauffage est interrompu après 30 min, on isole le produit de réaction Bendo dont la ' structure figure ci--dessous : O H / \20 0 O 3endo a) Comment peut--on interpréter la formation du composé 3endo ? b) Comment peut-on justifier que le produit 3830 soit majoritaire après plusieurs heures de chauffage ? c) Montrer que cette réaction permet de protéger la double liaison de l'anhydride maléique. Proposer des conditions opératoires pour réaliser la réaction de déprotection. III. Utilisation du furane en synthèse : synthèse de l'ent--phytoprostane E1 Le furane 1 est un composé peu coûteux, point de départ de nombreuses synthèses organiques de produits naturels. Il a ainsi récemment été utilisé comme synthon pour la synthèse de l'ent-- phytoprostane El, composé pouvant provoquer des réactions allergiques chez l'homme pendant la période des pollens. O #OEJMW\ACOOH ""1/ HO % ent--phytoprostane E1 1. Dans une première étape, le furane. est transformé en dérivé 7. Pour cela, l'acide 5 est mis en solution dans le tétrachlorure de carbone puis traité par un équivalent de chlorure de 2- chloroacétyle 4 en présence d'un équivalent de triéthylamine (Et3N). Après une heure d'agitation de ce mélange à 0 °C, on obtient le composé 6 auquel on ajoute un équivalent de furane et de BF3.OEt2. Après 3h à température ambiante, les traitements classiques permettent d'isoler le composé 7 avec un rendement de 77%. O ' O Cl\)l\Cl + HOO COOMe Cl/\ÏCÏ; 0 4 5 6 BF30Et2 / \ 5 + @ o COOMe 1 7 &) À quelle famille de dérivés d'acide le composé 6 appartient--il ? Proposer un mécanisme pour sa formation. Quel est le rôle de la triéthylamine ? b) Écrire une structure de Lewis pour BF3. En déduire à quel type de composés il se rattache. Données: B (Z= 5),F (Z: 9). c) Par analogie avec la chimie du benzène, proposer un mécanisme pour la réaction inter- venant entre 6 et le furane. Préciser le rôle de BF3 dans cette réaction. 2. Le composé 7 est réduit en l'alcool 8 avec un rendement quantitatif. / \ _ _ / \ () COOMe 0 COOMe 0 OH ' Proposer des conditions opératoires permettant de réaliser cette réaction en justifiant le choix du réducteur utilisé. 3. Le composé 8 est mis en solution dans l'eau et celle--ci chauffée au reflux en présence d'une quantité catalytique de HgSO4. On obtient le composé 11. / \ H20, H+ % coowoe HO \ coowæ O reflux 0 OH & f 9 0 * \ _ O-- Wcoom HO \ coowæ OH 11 10 a) Proposer un mécanisme pour expliquer la formation de 9. b) Le composé 9 se transforme rapidement en 10. Proposer un mécanisme pour cette réaction. c) Quel type de réaction permet d'obtenir le composé 11 ? 4. Le composé 11 est instable et il est rapidement traité par du chloral (trichloroacétaldéhyde hydraté, C13CCH(OH)2) en présence de triéthylamine dans le toluène à température ambiante pour conduire au composé 14 avec un rendement de 70%. Cette réaction passe intermédiairement par l'hémiacétal 12. _ OH o olgcJ\ OH coowæ ------*------------ COOMe Et3N toluène HO\(O 12 col3 o o SÎDKA\J/\""\v/\COOMe ÿÎ2/A\JW\"/\"/\CooMe HO " * 0 0 13 Y CCIg a) Expliquer la formation de l'acétal 13 a partir du composé 12. b) Proposer un mécanisme pour expliquer la formation de 14 en admettant que la forma-- tion d'un hémiacétal est réversible dans ces conditions. 5. À ce stade, les deux isomères obtenus 14a et 14b peuvent être séparés. O O COOMe + Ô/WV\COOMG HO 14a Hô 14h a) Quel est le rapport d'isomérie entre ces deux composés ? b) De manière générale, proposer une méthode pour séparer deux isomères tels que 1431 et 14h. 6. La fonction hydroxyle en C4 est protégée sous la forme d'un éther de tert-- butyldiméthylsilyle. Cette réaction s'effectue en traitant l'alcool 14a par un équivalent de chlorure de tefi--buty1diméthylsilyle en présence d'un équivalent de triéthylamine dans le di-- chlorométhane. o o ' TBSCI COOMe COOMe 4 3 Et3N HO 14a CH2C|2 TBSO 15a TBSCI= H30_ÏC_$_CI TBSOR= H3c--îc-sli--os H3C CHS H3C CH3 Proposer un mécanisme pour la formation de 15a, sachant que le chlorure de tert-- butyldiméthylsilyle réagit au niveau du silicium comme un chlorure d'alkyle. 7. L'addition d'un organocuprate correctement fonctionnalisé permet d'obtenir le composé 16a avec un rendement de 53%. o LiCUW) 0 WCOOM e OTBS 2 ©"'"...CO0Me Et20 -.,I / -40°C /Y\ TBSO » TBSO OTBS 15e 16e Pourquoi les auteurs utilisent--ils un organocuprate et non un organolithien pour cette addi- tion ? 8. Proposer des conditions pour réaliser la réaction de saponification permettant d'obtenir l'acide 17 a. 0 _uù\/W\COOH "'o/ TBSO /Y\ OTBS 17e 9. La dernière étape est une étape de déprotection des éthers silylês. Celle--ci est effectuée en présence d'un mélange HF / pyridine et conduit à l'ent--phytoprostane E1 avec un rendement de 90%. Expliquer le choix des ions fluorures pour obtenir le diol 18a. O O .»'\/\/\/\000H HF/pYridine ©"'\\W\/\COOH / ' TH F, O°C ' / TBSO /\l/\ HO /Y\ OTBS OH 173 - 18a \ Pyridine= | , N Données : Énergie de la liaison Si--F : 810 k.] / mol. Énergie de la liaison Si--O : 530 kJ / mol.
