X Chimie PC 2003
| Thème de l'épreuve | Étude d'une source chimique de dioxygène singulet. Caractérisation et synthèse de l'acide shikimique. |
| Principaux outils utilisés | cinétique chimique, chimie organique, diagrammes potentiel-pH |
| Mots clefs | singulet dioxygène, molybdène |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
ÉCOLE POLYTECHNIQUE
ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2003 FILIÈRE PC
COMPOSITION DE CHIMIE
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée.
L'épreuve comporte dence problèmes indépendants.
***
Premier problème
Étude d'une source Chimique de dioxygène singulet :
le système MoOî"/HgOg
Données Numériques
Terme [(RT/F) ln 10] à. 298 K : 0,060 V
Potentiels standard d'oxydoréduction (en V)
couple H+/H2_ 02/H20(l) M03+/Mo(s) MOO3(S)/MO3+ MoOî'/Mo(s) H202/H20(1) 02/H202
E° 0,00 1,23 -0,20 0,32 0,15 1,77 -- 0,69
pKa du peroxyde d'hydrogène (eau oxygénée) H202 : 11,6,
Le terme dioxygène << singulet >>1, noté 102, désigne le premier état excité de
la molécule
de dioxygène; il possède un excès d'énergie par rapport au dioxygène
fondamental << triplet >>1,
noté 302 ou plus simplement 02. C'est un réactif de synthèSe organique très
sélectif qui donne
' en particulier lieu à des réactions de cycloaddition avec une large variété
de composés. Habi--
tuellement produit par photosensibilisation, 102 peut aussi être généré
efficacement par action
d'un molybdate alcalin sur le peroxyde "d'hydrogène (eau oxygénée) en milieu
aqueux basique.
1Les qualificatifs << singulet >> et << triplet >> sont donnés ici sans
justification. Il n'est pas utile d'en comprendre
le sens dans le cadre du problème.
I - Étude atomistique et stabilité thermodynamique
1. Le dioxygène singulet 102.
Les propriétés des états électroniques excités du dioxygène peuvent
s'interpréter correctement
en utilisant le diagramme des orbitales moléculaires de 02.
&) Rappeler la configuration électronique de l'atome d'oxygène. On donne
ci-dessous le
diagramme simplifié des orbitales moléculaires des moléCules diatomiques
homonucléaires consti--
tuées à partir des éléments de la deuxième ligne de la classification
périodique.
A A2 A
'
0 , \
' a * * « \
0 0 \ '
oo X y ' \
" ' \ '
04 \ '
',' '\\
'
\
'æ' "\
$ "
{" ,,
\ ,:
\\ ;:
\\ {I
\\ ' I _
\ \ O
' l
\ ' , l
\ \ , :
\ ' o '
' \ 715 1t / "
' \
\ \ X y " æ ,.
\ \ , l
\ \ , :
' _ -- ,'
' l
' :
' :
' l
' '
\ r
\ I
\ I
\ l
\ I
_
_
' 5
" 'N
" "\
" Ü * ""
r' *
' S "
' s
' s
«' "
" ä\
, \
' \
" \\
" "N
28 _" ' "' 2
_ _ S
" \ 'æ'
' æ
' r
' f
' o
\ &
" "
" "
\\ ,'
' O
\ '
\ ,'
' v
' a
' æ
' æ
\ O
" "
\ '
_
Préciser l'occupation de chacune desbrbitales dans l'état fondamental de la
molécule 02.
Calculer l'indice de liaison associé à ce dernier.
b) L'écriture de Lewis de la molécule 02 respectant la règle de l'octet
est--elle en accord
avec la configuration électronique précédente ? '
C) Quelles configurations électroniques proches en énergie peut-on envisager a
priori pour
10 7
2 .
d) 102 réagit avec le (E, E)-hexa--2,4--diène pour don--
ner quantitativement le composé ci--contre. Donner un nom
et un mécanisme pour cette réaction.
2. L'élément molybdène.
a) Le molybdène M0 est un métal de numéro atomique Z = 42. Indiquer sa position
dans la
classification périodique, puis donner le remplissage attendu des couches de
valence ns et (n--l)d
dans l'état fondamental. Quelle autre configuration peut-on envisager sachant
que les niveaux
ns et (n--1)d sont d'énergies voisines ?
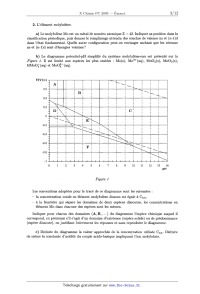
b) Le diagramme potentiel--pH simplifié du système molybdène--eau est présenté
sur la
Figure 1. Il est limité aux espèces les plus stables : Mo(s), Mo3+ (aq),
MOO2(S), M003(S),
HMoOZ (aq) et MoOÎ (aq). ' -
Figure 1
Les conventions adoptées pour le tracé de ce diagramme sont les suivantes :
-- la concentration "totale en élément molybdène dissous est égale à. Ctot,
---- ' ala frontière qui sépare les domaines de deux espèces dissoutes, les
concentrations en
,
elé ment M0 dans chacune des espèces sont les mêmes.
Indiquer pour chacun des domaines (A, B, . . .) du diagramme l'espèce chimique
auquel il
correspond, en précisant s'il s'agit d'un domaine d'existence (espèce solide)
ou de prédominance
(espèce dissoute), en justifiant brièvement les réponses et sans reproduire le
diagramme.
c) Déduire du diagramme la valeur approchée de la concentration utilisée Ctot.
Déduire
de même la constante d'acidité du couple acido--basique impliquant l'ion
molybdate.
(1) Sur le diagramme ont été portées en pointillés les droites délimitant le
domaine de stabi--
lité thermodynamique de l'eau. Rappeler les équations de ces droites en
utilisant les conventions
_ habituelles.
Indiquer lesquels des dOmaines précédents correspondent à une zone de
corrosion, d'immunité
ou de passivité du métal. Jusqu'à quel pH la passivation du métal est--elle
envisageable? On
admettra qu'une couche d'oxyde peut protéger le métal.
e) Que se passe-t--il si on ajoute une base forte à une solution aqueuse
désaérée d'une
suspension de dioxyde de molybdène ? Ecrire les équations--bilan
correspondantes.
II - Étude cinétique et mécanistique
En milieu aqueux basique, l'ion molybdate catalyse la production de 102 à
partir d'eau
oxygénée. Enutilisant une molécule A appelée capteur qui fiXe uniquement le
dioxygène singulet, "
il est ainsi possible de doser la quantité de 102 produite au cours de cette
réaction.
1. Efficacité du système.
a) Donnez l'équation--bilan de formation de 102 a partir de l'eau oxygénée
catalysée par
MoO[. Comment s'appelle ce type de réaction?
b) La cinétique de la peroxydation de A par une source produisant àvitesse vf
c0nstante
de l'oxygène singulet 102 peut être décrite de la façon suivante :
-- Formation de 102 : source de 102 --------> 102
(étape se déroulant à vitesse constante 'Uf, etque l'on ne cherchera pas à
expliciter plus
avant), '
-- Désactivation de 102 par le solvant : 102--------> kd 302
-- Fixation de 102 par le capteur : 102 + A------+ A02
(actes élémentaires où kd et kfix désignent les constantes de vitesse des
réactions corres-
pondantes).
En appliquant l'approximation de l'état quasi--stationnaire (A.E.Q.S.), établir
la vitesse de
disparition de A en fonction de la vitesse of de formation de 102. Indiquer si
la réaction admet
un ordre. Discuter ces résultats en fonction de la valeur des constantes de
vitesse.
c) Montrer qu'à l'instant t, la quantité totale de 102 produit est
proportionnelle à :
[A]0 ---- [A]t + filn ([A]g/[A]Q où [A]() et [A]t sont les concentrations du
capteur à l'instant
initial t = O et à l'instant t, et fi une constante adéterminer.
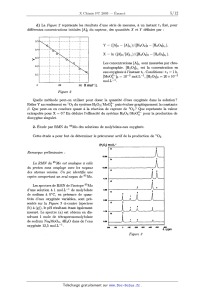
d) La Figure 2 représente les résultats d'une série de mesures, à un instant t1
fixé, pour
différentes concentrations initiales [A]0 du capteur, des quantités X et Y
définies par :
Y : ([A]o -- [A]t1)/([H2O2]O -- [H2O2ltl)a
X = ln ([Alo/ [Alt1)/ (lH2Û2lo "' lH202ltl)-
Les concentrations [A]t1 sont mesurées par chro--
matographie. [H202]t1 est la concentration en
eau oxygénée à l'instant t1. Conditions : t1 : 1 h,
[Mooî--]O : 10"3 mol.L--1, [H202]0 = 20 >< 10-3 mol.L_l. 0 100 200 X mol".L Figure 2 Quelle méthode peut--on utiliser pour doser la quantité d'eau oxygénée dans la solution ? Relier Y au rendement en 102 du système H202 /MoOÎ puis évaluer graphiquement la constante 3. Que peut--on en conclure quant a la réaction de capture de 102 ? Que représente la valeur extrapolée pour X = O ? En déduire l'efficacité du système H202/M00î-- pour la production de dioxygène singulet. ' 2. Étude par RMN du 95M0 des solutions de molybdate--eau oxygénée. Cette étude a pour but de déterminer le précurseur actif de la production de 102. [Hp,] mol.L" Remarque préliminaire : La RMN du 95M0 est analogue à celle du proton sans couplage avec les noyauæ 1255 des atomes voisins. Un pic identifie une espèce comportant un seul noyau de 95Mo. 415 Les spectres de RMN de l'isotope 95Mo d'une solution à 1 mol.L--1 de molybdate 3--00 de sodium à 0°C, en présence de quan-- tités d'eau oxygénée variables, sont pré-- ',_oe sentés sur la Figure .? ci--contre (spectres - (b) à (g)), le pH résultant étant également mesuré. Le spectre (a) est obtenu en dis-- solvant 1 mole de tétraperoxomolybdate de sodium Na2MoOg, 4H20 dans de l'eau o.zs oxygénée 12,5 mol.L"1. 1.15 &) Identifier les pics 0 a 4, en indiquant à quelles espèces, de formule brute 2_ ; pic 2 : A;
pic3:O;pic4z.. '
|
|
L.
|
|
|
Fraction en males
012 3 4 5*6 ? 8 91011121314
[HzOzlmu mol.L"_
Figure 4
Montrer qu'il est possible d'évaluer assez précisément (erreur 10% maximum) a
partir de ce
graphe la constante K 4. "
d) En partant du rapport K " / K n_1, que l'on exprirhera, on détermine les
valeurs suivantes
des constantes Ki
i 1 2 3
Ki 170 1150 ' 160
Que peut--on dire de la concentration de H202 libre en fonction de la
concentration totale
introduite ? '
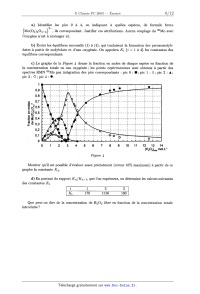
3. Le précurseur de 102.
L'étude précédente permet d'identifier le peroxOmolybdate responsable de la
production de
102. La courbe donnant la vitesse de décomposition de l'eau oxygénée en
fonction de la concen--
tration introduite dans une solution de molybdate deconcentration 1 mol.L_1 est
représentée
sur la Figure 5.
99
mon
l
l
|
I
'--
|
|
l
|
'_
|
l
l
l
|
l
|
l
9
>
0
v (H202) mol.L".h'1
0 2 4 6 8 10 12 16
[H 021 mol. |.-1
Figure 5
_ En déduire l'espèce active principalement responsable de la production
d'oxygène singulet
par le système HgOg/MOO[. Proposer une équation--bilan.
Fin du premier problème
Deuxième problême
Caractérisation et synthèse de l'acide Shikimique
La partie I doit être abordée en premier.
Les parties II et III peuvent être traitées dans un ordre quelconque.
L'acide shikimique,qui sera noté A, de formule brute C7H1005, est un monoacide
polyhy--
droxylé naturel, optiquement actif, précurseur biogénétique dans le règne
végétal de plusieurs
acides aminés fondamentaux, comme la L-tyrosine ou le L--tryptophane. Un pKa de
4,1 a été
mesuré pour A, et les principales bandes observées dans son spectre infrarouge
se situent à 3480,
3390, 3220 et 1680 cmï1.
Données infra-rouge (V, cm--1)
-OH (alcool) --COOR (ester) ' -CO-(cétone) ' --COOH
3650-3600 (libre) 1750--1730 ' 1710 1700--1670 '
3500--3250 (lié)
I - Préliminaires
En milieu aqueux l'ion periodate IOZ oxyde à. froid les 1,2--diols en formant
inte--rmédiairement
un ester periodique cyclique qui subit une ouverture pour conduire à la
formation de deux
groupements carbonyle et à un anion iodate 105 .
OH a) Écrire, dans le cas du (R, R)--cyclohexan--l,2--diol I
l'équation--bilan correspondant à cette coupure. oxydante
I en précisant la formule développée du seul produit orga--
""'/1 nique obtenu. Que donnerait le composé -méso, le (R, S )--
"/QH cyclohexan--1,2--diol II, soumis au même traitement ?
b) En présence de deux équivalents d'acide periodique, le glycérol
(propan--l,2,3-triol)
fournit un mélange de méthanal et d'acide méthanoïque. Donner la formule
Semi--développée des
produits obtenus par action du premier équivalent d'acide periodique sur le
glycérol.
c) Sachant qu'en milieu acide les aldéhydes additionnent facilement une
molécule d'eau
pour conduire réversiblement à. un diol géminé, c'est-à--dire un 1,1--diol,
justifier la formation
d'acide méthanoïque lors de la coupure oxydante du glycérol. Proposer un
mécanisme pour la
réaction de formation du 1,1--diol.
d) Les 1,2--diols peuvent être protégés de l'oxydation par chauffage préalable
avec de l'acé-- '
tone (propanone) en présence d'un acide et d'un déshydratant. Le diol II réagit
ainsi beaucoup
plus facilement et rapidement que le diol I avec la propanone pour donner un
composé bicy--
clique III, de formule brute 09H1602. Écrire l'équation--bilan correspondant à
la formation de
III, dont la formule semi--développée sera précisée. Comment s'appelle cette
réaction? On ne
cherchera pas à} justifier la différence de réactivité des deux diols
vis--à--vis de la propanone.
II - Caractérisation de l'acide shikimique (formule brute C7H1005)
1. Lorsque l'acide shikimique A est traité par quatre équivalents d'iodure de
mêthylma--
gnésiumdanS le diéthoxyéthane anhydre, un dégagement de quatre équivalents de
méthane est
observé, le produit de départ étant récupéré inchangé après hydrolyse acide.
a) Préciser le nombre d'insaturations du composé A, sachant que A contient un
cycle
carboné.
b) À quel type de réaction avec l'iodure de méthylmagnésium donnent lieu les
groupements ,
fonctionnels de A ? Ecrire schématiquement cette réaction sur un des
groupements de A.
c) En déduire la nature et le nombre des groupements fonctionnels oxygénés
présents
dans A. '/
2. Dans les conditions de l'hydrogénation catalytique A donne principalement un
mono--
acide B de formule brute C7H1205. Le traitement de l'esterméthylz'que de B,
noté C, par deux
équivalents d'acide periodique (voir question I--b)) donne naissance à une
molécule d'acide mé--
thanoïque et a un composé D, de formule brute C7H1004, qui peut être aisément
oxydé en un
diacide E achiral. Ce dernier fournit par saponification, suivie de
neutralisation, le triacide F.
HOZC COZH * F
C02H
a) Quelle information apporte l'obtention du monoacide B ? Attribuer toutes les
insatu--
rations de A.
b) Déduire de cette série de réactions les formules semi--développées de E et D.
c) Proposer une formule semi--développée pour C, en justifiant.
d) L'acide shikimique A n'étant pas susceptible de présenter le phénomène de
tautomérie
céto--énolique, en déduire sa formule stérique plane. Combien de stéréoisomères
peuvent corres--
pondre a cette formule '?
3. Par chauffage en présence d'une trace d'acide, le monoacide B conduit à une
lactone
cyclique G, de formule brute C7H1004, optiquement active, et qui demeure
inattaquée par
l'acide periodique.
&) Représenter les deux énantiomères de la lactone G qui sont compatibles avec
ces infor--
mations. Indiquer leurs carbones asymétriques ainsi que la configuration
absolue de ces derniers.
b) Quelles sont les formules semi-développées possibles envisageables pour
l'acide shi--
kimique A ? Préciser les relations d'énantiomérie ou de diastéréoisomérie
existant entre ces
isomères. '
4. Afin de déterminer complètement sa structure, l'acide A est alors traité
dans un excès de
méthanol en milieu acide pour fournir le composé H, qui est ensuite agité dans
de la propanone
en présence d'une trace d'acide pour donner naissance a I, de formule brute
C11H1605 (voir
question I--d)), Ce dernier est finalement soumis à un chauffage avec de
l'anhydride éthanoïque
(noté Ac2O) dans la pyridine, ce qui permet d'obtenir J, de formule brute
C13H1806.
Ecrire sur un des composés proposés pour A les réactions de protection
conduisant à J en
donnant les formules semi-développées de tous les produits intermédiairement
obtenus de H
à.].
5. L'action sur J d'un peracide tel que CH3C03H engendre un intermédiaire K qui
évolue
spontanément dans le milieu acide aqueux pour donner L. Ce dernier traité par
l'acide periodique
conduit à M de formule brute C13H1808. Une oxydation de M par le brome dans
l'acide étha--
noïque, réactif qui est connu pour provoquer une décarboxylation ooeydante des
a--cétoesters
(donc transformer le motif --CO--COOR en --COOH), fournit l'acide N de formule
brute
C11H1607. Une réduction ultérieure de N par le borohydrure de sodium, NaBH4,
suivie d'une
hydrolyse totale au reflux d'acide chlorhydrique aboutit alors à l'acide D--2--
désoxygluconique 0,
dont la formule topologique est donnée ci--après:
O OH OH
a) Donner la formule semi--développée de l'intermédiaire K, puis celle du
produit L, en
précisant son mécanisme d'obtention à partir de K.
b) Donner les structures des composés M et N.
c) Déduire de la dernière séquence de réactions ci--dessus et de la formule
topologique de
0, la structure stérique exacte de l'acide shikimique A.
III - Synthèse de l'acide shikimique
1. L'acide A dont la structure a été déterminée dans la première partie a été
synthétisé de
manière élégante à. partir du (E, E)-1,4--diacétoxybuta--1,3--diène, qui
possède la formule semi--
développée ci--deSsous : " '
/\/\/O '
0
Ce diester est chauffé dans le toluène à 90°C en présence d'une quantité
équimdléculaire d'acide
prop--2--énoïque pour conduire à. la formation d'un mélange de produits qui ont
tous la même
formule brute C11H1405. Par deux recristallisations successives, un produit
majoritaire P racé--
Jmique est aisément obtenu pur; on constate qu'il ne présente pas d'activité
optique. Une analyse
des constantes de couplage de P en RMN du proton permet d'attribuer une
configuration cis
(par rapport au cycle formé) des groupements OCOCH3 et COzH voisins.
&) Donner le nom et le mécanisme de la réaction ci--dessus. .-
b) Représenter les configurations possibles des produits obtenus selon la face
du diène et
de l'acide propénoïque attaquée.
c) Indiquer pourquoi il est possible de séparer P du mélange par
recristallisation.
d) Identifier P et préciser les atomes de carbone asymétrique.
2. La fonction acide du composé P est transformé par action du diazométhane
CH2N2 dans
l'éthoxyéthane (la connaissance de cette réaction n'est pas exigée) en un ester
méthylique Q qui
est ensuite traité par du tétraoxyde d'osmium dans du tétrahydrofuranne.
L'hydrolyse réductrice
de l'ester osmique formé par une solution aqueuse de sulfite de sodium permet
d'engendrer un
seul produit B, qui est alors agité dans l'acétone en présence d'acide
paratoluènesulfonique, pour
donner naissance à S, de formule brute C15H2208.
a) Pourquoi n'est-il pas possible d'utiliser des conditions classiques
(agitation dans le
méthanol acidifié par exemple) pour préparer l'ester méthylique Q ?
b) Donner la formule développée de R, sachant que les trois substituants
initiaux portés
par le cycle sont du même côté du plan. Préciser la stéréochimie de la réaction
qui a conduit a
sa formation. Justifier brièvement, en faisant appel à des considérations
stériques, le fait qu'un
seul produit soit effectivement obtenu.
c) Préciser la formule topologique du composé S.
3. S chauffé dans l'éthoxyéthane en présence d'une base non nucléophile
encombrée Comine
le DBU représentée ci-après, fournit, par une réaction d'élimination, à côté
d'un acétate, un
produit T, de formule brute C13H1806. Ce dernier finalement chauffé dans une
solution aqueuse
d'acide éthanoïque puis saponifié avec de la soude aqueuse à température
ambiante et enfin
hydrolysé en milieu acide conduit à l'acide shikimique A.
N
DBU
\
N
&) Identifier l'hydrogène le plus acide de S. En déduire les formules
semi--développées de
T et du sel formé. '
b) Pourquoi faut--il utiliser une base non--nucléophile pour obtenir T ?
c) Écrire l'intermédiaire obtenu lors du chauffage de T dans l'acide éthanoïque
aqueux,
puis donner la formule semi--développée de A.
(1) Cette synthèse est--elle énantiosélective ?
