Mines Chimie PC 2022
| Thème de l'épreuve | Le graphène |
| Principaux outils utilisés | cristallographie, cinétique chimique, oxydoréduction, thermodynamique, mélanges binaires, chimie organique, orbitales moléculaires, chimie de coordination |
| Mots clefs | graphite, batterie au lithium, CVD, déposition chimique en phase vapeur, Diels-Alder |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - -
Énoncé complet
(télécharger le PDF)
















Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
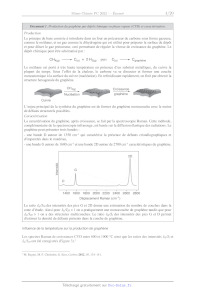
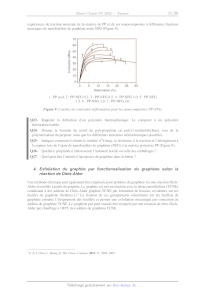
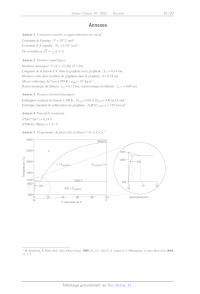
A2022 --- CHIMIE PC Cm Concours commun Mines-Ponts ÉCOLE DES PONTS PARISTECH, ISAE-SUPAERO, ENSTA PARIS, TÉLÉCOM PARIS, MINES PARIS, MINES SAINT-ÉTIENNE, MINES NANCY, IMT ATLANTIQUE, ENSAE PARIS, CHIMIE PARISTECH - PSL. Concours Mines-Télécom, Concours Centrale-Supélec (Cycle International). CONCOURS 2022 ÉPREUVE DE CHIMIE Durée de l'épreuve : 4 heures L'usage de la calculatrice et de tout dispositif électronique est interdit. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE - PC L'énoncé de cette épreuve comporte 19 pages de texte. Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énontcé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. Les sujets sont la propriété du GIP CCMP. Ils sont publiés sous les termes de la licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 3.0 France. Tout autre usage est soumis à une autorisation préalable du Concours commun Mines Ponts. Le Graphène Le graphène a été découvert en 2004 par deux physiciens russes, À. Geim et K. Novoselov,! ce qui leur a valu le prix Nobel de physique en 2010. Ce nouveau matériau, issu du carbone graphite, présente des propriétés extraordinaires. Sa mobilité électronique 120 fois supérieure à celle du silicium, sa très grande conductivité thermique, sa résistance mécanique et sa transparence font de lui un matériau aux applications prometteuses. Ce sujet, qui propose d'explorer quelques propriétés et applications du graphène, est constitué de cinq parties indépendantes, les trois premières de chimie générale (Structures cristallographiques du carbone, Production du graphène par CVD et Quelques exemples d'applications du graphène) et les deux suivantes de chimie organique (Exfoliation du graphite par fonctionnalisation du graphène selon la réaction de Diels-Alder et Post-fonctionnalisation des adduits de graphène). Les données nécessaires à la résolution des différentes parties de ce problème sont fournies en annexes à la fin de l'énoncé (pages 17, 18 et 19). 1. Structures cristallographiques du carbone Le carbone graphite Le graphène est préexistant dans le graphite. En effet, la structure du graphite est un empilement de plans décalés de graphène tenus entre eux par des forces de Van der Waals (Figure 1). Dans cet empilement, la moitié des atomes des hexagones du plan B sont positionnés au-dessous des centres des hexagones du plan A. A A B à Plans A et B (vue de dessus) Figure I. Structure du graphite. Q1- Donner le nombre d'atomes de carbone par maille (représentée en gras sur la Figure 1) ainsi que leur coordinence (les atomes n'appartenant pas à la maille n'ont pas été représentés). Q2- Calculer la densité d du graphite et déterminer l'expression de la compacité C en fonction de L-c, la longueur de la liaison C-C dans le graphite, et du paramètre de maille c. Q3- Justifier le caractère conducteur du graphite. ! K.S. Novoselov, A. K. Geim, S. V. Morozov, D. Jiang, Y. Zhang, S. V. Dubonos, I. V. Grigorieva, A. A. Firsov, Science 2004, 306, 666-669. Page 1/19 Le carbone graphène On considère dès lors l'arrangement bidimensionnel d'atomes de carbone d'épaisseur monoatomique disposés suivant un réseau dit en « nid d'abeilles ». La structure cristallographique du graphène peut être décrite par la cellule unitaire en gras (Figure 2). a Æ------ Maille élémentaire Figure 2. Structure du graphène. Q4- A quelle famille de cristaux appartient le graphène ? Q5- Déterminer le nombre d'atomes de carbone dans la maille, la coordinence du carbone dans cet environnement et les coordonnées des atomes définissant la maille. Q6- Calculer la densité surfacique des atomes de carbone dans une monocouche de graphène. 2. Production du graphène par CVD Historiquement, c'est par exfoliation mécanique que Novoselov et Geim ont isolé le graphène pour la première fois en 2004 : à l'aide d'un papier collant type « scotch », 1ls ont réussi à séparer les feuillets du graphite et obtenu des couches de graphène sur l'adhésif. Mais cette méthode n'est pas efficace pour une production industrielle. Les chimistes se sont tournés vers une autre voie, le dépôt chimique en phase vapeur ou CVD* (Document 1). La méthode, qui s'avère aujourd'hui la plus efficace, est le dépôt chimique sur le cuivre, ce catalyseur ne formant pas de solution solide avec le carbone en dessous de 1000 °C. Nous allons par la suite nous intéresser à l'influence de différents paramètres sur la production de graphène par CVD. 2 CVD : Chemical Vapor Deposition Page 2/19 Document I. Production du graphène par dépôt chimique en phase vapeur (CVD) et caractérisation. Production Le principe de base consiste à introduire dans un four un précurseur de carbone sous forme gazeuse, comme le méthane, et un gaz comme le dihydrogène qui est utilisé pour préparer la surface de dépôt et pour diluer le gaz précurseur, ceci permettant de réguler la vitesse de croissance du graphène. Le dépôt chimique peut être schématisé par : Chag ---- Cés + 2 Hg) puis Ci ---- Cyraphène Le méthane est porté à très haute température en présence d'un substrat métallique, du cuivre la plupart du temps. Sous l'effet de la chaleur, le carbone va se dissocier et former une couche monoatomique à la surface du cuivre (nucléation). En refroidissant rapidement, on finit par obtenir la structure hexagonale du graphène. CH4(g) n wa. Croissance dé : 7" Nucléation D graphène D Cuivre L'enjeu principal de la synthèse du graphène est de former du graphène monocouche avec le moins de défauts structurels possibles. Caractérisation La caractérisation du graphène, après croissance, se fait par la spectroscopie Raman. Cette méthode, complémentaire de la spectroscopie infrarouge, est basée sur la diffusion élastique des radiations. Le graphène peut présenter trois bandes : - une bande D autour de 1350 cm! qui caractérise la présence de défauts cristallographiques et d'impuretés dans le matériau, - une bande G autour de 1600 cm! et une bande 2D autour de 2700 cm! caractéristiques du graphène. 2D Intensité O Ï Ï Ï Ï Ï Ï Ï Ï 1400 1600 1800 2000 2200 2400 2600 2800 Déplacement Raman (cm!) Le ratio /ç/12 des intensités des pics G et 2D donne une estimation du nombre de couches dans la zone d'étude. Ainsi pour /c/2p < 1 on a pratiquement une monocouche de graphène tandis que pour Ic/Lp > 1 on a des structures multicouches. Le ratio //1G des intensités des pics G et D permet d'estimer la densité de défauts présents dans la couche de graphène. Influence de la température sur la production de graphène Les spectres Raman de croissances CVD entre 600 et 1000 °C ainsi que les ratios des intensités //16 et 1c/12p ont été enregistrés (Figure 3)° * M. Regmi, M. F. Chisholm, G. Eres, Carbon 2012, 50, 134-141. Page 3/19 Q7- A partir de quelle température faut-il travailler pour obtenir du graphène ? Justifier, à l'aide des données thermodynamiques, pourquoi 1l convient de travailler à cette température (voir Annexe 3 page 17). Q8- A quelle température est-il préférable de se placer pour obtenir un graphène de bonne qualité ? Proposer une explication. 2 00 600°C + D/G 700°C © 1,50- -e- 1G/Lp © oo o 800°C Ë = Ê c FU, nn 850°C TZ 1,00- Ê 5 900°C A S. A S 0,50- x 1000°C 0,00- 1200 1600 2000 2400 2800 850 900 950 1000 Déplacement Raman (cm!) Température (°C) Figure 3. Spectres Raman de croissance CVD en fonction de la température (gauche) et variation du rapport des intensités 1D/Ic et 1ç/12p en fonction de la température (droite) Influence de la concentration en méthane L'influence de la concentration en méthane sur la qualité du graphène obtenu a été étudiée par spectroscopie Raman (Figure 4) .* À 41 ppm © x u) |, | E Lu 163 ppm on Î 819 ppm 1200 1600 2000 2400 2800 Déplacement Raman (cm!) Figure 4. Évolution des spectres Raman du graphène en fonction de la concentration en méthane (en ppm) " Q9- La synthèse du graphène est-elle favorisée à haute ou faible concentration en méthane ? Proposer une explication à l'évolution de la qualité du graphène en fonction de la concentration en méthane. #7. Luo, Y. Lu, D. W. Singer, M. E. Berck, L. A. Somers, B. R. Goldsmith, A.T.C. Johnson, Chem. Mater. 2011, 23, 1441- 8 1447. Page 4/19 Influence du ratio Pn,/Pcn, On cherche à justifier qu'au fur et mesure que les atomes de carbone s'adsorbent, 1l se produit préférentiellement une agrégation avec les germes déjà présents plutôt que ne se créent de nouveaux germes (ou nucléi). L'effet des variations de la pression et de la température de synthèse sur les tailles des cristaux de graphène en dépôt chimique en phase vapeur (CVD) sur catalyseur au cuivre a été étudié (Figure 5).° Q10- - Processus de nucléatiorf et de croissance des grains À l'aide des information fournies (Figure 5), dans quelles conditions la densité de nucléation et la taille des grains de graphène sont-elles optimales (densité faible et taille des grains élevée) ? SL ET A si A gi 3 "EUR e dE 3 A I, nes Fe PAUSE nee FR AVE Lo ie ru 2 ne ke REA T (°C) T (°C) (c) 1050 1025 1000 975 950 (d) 1050 1025 1000 975 950 1064 --# Py2/Pcna = 1800 = 102 ou # Py2/Pcns = 1800 _ -e- Py2/Pcua = 50 " -e- Py2/Pcra = 50 E EUR -- 10°- 3 ë 2 d S _ O) 5 10 _ 2 8 DS © 2 10$- 27 = 10! = ue 10! - e --e7 F 0 E O e __--° Ê e. 102 [ [ [ [ Î [ [ [ 0,74 0,76 0,78 0,80 0,82 0,74 0,76 0,78 0,80 0,82 T-1x10% (K) T-!x10% (K) (a) Images MEB (microscope électronique à balayage) de croissances hexagonales à P différentes températures pour + = 1800. (b) Images MEB de croissances dendritiques à CH4 P LL différentes températures pour + = 50. Diagrammes d'Arrhénius pour (c) la densité de CH4 nucléation et (d) la taille des grains. Figure 5. Dépendance en température de la densité de nucléation et de la taille des grains du CVD $ * La nucléation (ou germination) est l'apparition de petits domaines (appelés nucléi ou germes) d'une nouvelle phase à l'intérieur d'une phase homogène devenue instable. SI. Vlassiouk, S. Smirnov, M. Regmi, S. P. Surwade, N. Srivastava, R. Feenstra, G. Eres, C. Parish, N. Lavrik, P. Datskos, S. Dai, P. Fulvio, J. Phys. Chem. C 2013, 117, 18919-18926. Page 5/19 Mécanisme de croissance du graphène La croissance CVD du graphène sur différents métaux de transition est possible et a été étudiée dans la littérature. Parmi ces métaux de transition, on peut citer le ruthénium, le nickel, l'iridium et le cuivre. Il existe deux mécanismes de croissance possible pour le graphène CVD, l'un impliquant la migration du carbone adsorbé à la surface, l'autre faisant intervenir d'abord une dissolution du carbone adsorbé dans le matériau puis sa précipitation à la surface lors du refroidissement (Figure 6). Q11- En s'appuyant sur les diagrammes de phase (voir Annexe 5 page 17), justifier l'existence de processus différents selon que l'on utilise un support en cuivre ou en nickel (Figure 6). Ho CH4 1) Décompos CH*, CH,*, CH;* 3) Déshydrogénation F2 4) Migrati gration Caravhe 2) AésarpioN t croi graphène CH CH" CH _Z Cads) et CroIssance EE | Cuivre (D) CH, 2 1) Décomposo CH*, CH,*, CHa* 3) Déshydrogénation Fo 6) Migration 2) AésarpioN / à croissance Cgraphène CH° CH CH Cads) Cads) ? -- | Nickel 4) Dissolution : __/5s) Diffusion et adsorption CH", CH" et CH;" sont des espèces actives sous forme de carbanions ou de radicaux. Cas carbone adsorbé sur la surface du métal. Figure 6. Schéma de croissance du graphène a) sur cuivre et b) sur nickel. On souhaite étudier la cinétique de déposition du graphène sur du cuivre. On peut décrire les étapes nécessaires à la formation du graphène grâce aux réactions suivantes (Figure 7). 7 M. H. Ani, M. A. Kamarudin, À. H. Ramlan, E. Ismail, M.S. Sirat, M. A. Mohamed, M. A. Azam, J. Mater. Sci. 2018, 53, 7095-7111. Page 6/19 X; (1) CH + x = CH (équilibre rapide) (2) Oy + * O;* (équilibre rapide) 3 (3) O;* + %x ----# 2 O* (4) CH + nx --> CH* + nH , À , , (S) CH, x C graphène + Y H * * ÂG + (6) CH, + O* -- CO) + 2% + y H , K7 (7) O + Hg ---- H20(@ + * etpH* -- p/2H;yy + P%x avecp=nouy * : sites inoccupés à la surface du cuivre, X* représente l'espèce X adsorbée, CH. est le gaz précurseur, H: est l'agent réducteur et O2 représente les impuretés oxydantes présentes dans les bouteilles de gaz ou introduites par infiltration d'air dans le four. Figure 7. Cinétique de formation du graphène. Par la suite, on notera t, la fraction de sites libres à la surface du cuivre, ty la fraction de sites à la surface occupée par l'espèce X, vx = dtz/dt la vitesse de formation de l'espèce X à la surface du Cuivre, Ter -- TChraphène la fraction recouverte par le graphène et dt,-/dt le taux de croissance du graphène (dTor /dt = v; = KsTcH;). Pcu, » Pa, » EURt Po, représentent les pressions partielles respectives en méthane, dihydrogène et dioxygène. On considèrera que les espèces adsorbées à la surface, CH,* et l'oxygène O*, sont dans un état quasi-stationnaire. On supposera aussi qu'aucune réaction ne se produit à partir d'îlots déjà formés et donc que la surface active du cuivre est constamment réduite par la couverture grandissante du graphène dans l'étape 5, de telle sorte que TcH;, Sera renormalisé par TcH; (1 = Ter) - PcH4 (1 Ter) 4 1+KinhibPo,/PH; en supposant que T' = 1, hypothèse qui devra être justifiée. Expliciter kinni en fonction des constantes k3, Ks, kç, K7 et X2 (P°sera négligé dans les expressions littérales). dTor | | | Q12- Montrer que --E = K..k dans l'hypothèse où 46 est très petite devant Xz et Q13- Résoudre alors l'équation différentielle et donner l'évolution de tr = f(t). Q14- Montrer qu'il faut plus de temps pour atteindre une couche complète lorsque le niveau d'impuretés augmente. 3. Quelques exemples d'applications du graphène Dans les batteries lithium-ion Les batteries utilisées couramment dans les véhicules électriques, mais également dans d'autres applications comme les téléphones portables, sont de type lithium-ion. Elles présentent l'avantage d'avoir une très grande énergie massique, comprise entre 90 et 180 Wh:kg"'. De plus, ces batteries, même partiellement déchargées, délivrent toujours la même puissance, ce qui permet une utilisation dans les mêmes conditions, quel que soit le niveau de charge. Le principe général d'une batterie lithium-ion est basé sur l'échange réversible des ions lithium entre une électrode positive en oxyde métallique (MO) et une électrode négative en graphite qui va stocker les ions lithium pendant la charge (Figure 8). Page 7/19 * ; k NL (_)C) () () Décharge L NK Srephite N (0 (2 N 2 À LIN I NM DLOS es Cathode Séparateur Anode ® Lit Figure 8. Représentation schématique d'une batterie Li-ion. Q15- L'une des électrodes est en graphite dans lequel sont insérés les ions lithium. Justifier le fait que le graphite est un matériau adapté à l'insertion des 1ons lithium. Q16- A l'état totalement chargé, la structure du composé est LiC. Écrire la demi-équation électronique à cette électrode lors de la charge et de la décharge en précisant son signe. Q17- La seconde électrode peut être en oxyde de cobalt (CoO) qui, après insertion des ions lithium, forme l'oxyde lithié L1CoO:. Montrer que c'est l'élément cobalt qui change de nombre d'oxydation. Donner la demi-équation électronique associée au couple considéré lors de la charge et de la décharge à cette électrode en précisant son signe. Q18- Donner l'équation bilan lors du fonctionnement de la batterie en charge et en décharge. Q19- Déterminer l'expression de la capacité de la batterie (en A-h-kg !) en fonction du nombre d'électrons échangés, de la constante de Faraday et de la masse molaire du matériau d'insertion (le graphite). Pour le véhicule considéré, équipé d'une batterie lithium-ion dont les caractéristiques sont fournies dans le Document 2, la jauge d'autonomie de la batterie indique 20 %. Son conducteur souhaite la recharger et pour cela, 1l utilise une borne de recharge qui fournit une puissance constante de 7,40 KW en délivrant un courant électrique d'intensité constante de 32,0 A. Q20- Calculer l'énergie massique maximale de la batterie considérée (Document 2). Commenter. Q21- Calculer l'énergie emmagasinée par la batterie lors de sa charge pour passer d'un SOC de 20 % à 80 % et définir le rendement de la charge, puis le calculer. Commenter cette valeur. Page 8/19 Document 2. Caractéristiques de la batterie Li-ion du véhicule électrique. La technologie lithium-ion est communément utilisée dans les batteries des voitures électriques. Les principales caractéristiques d'une batterie Li-1on présente dans le véhicule électrique considéré dans cette étude sont les suivantes : Énergie utilisable 41 (KWh) Tension totale (V) 400 Nombre de cellules 192 Masse de Îla batterie 305 (kg) Une des caractéristiques essentielles d'une batterie est son état de charge SOC(State Of Charge) et sa variation en fonction du temps. Il varie de 0 % (batterie déchargée) à 100 % (batterie entièrement chargée). Le SOC'est directement lié à l'énergie emmagasinée par la batterie. L'énergie maximale qui peut être emmagasinée représente son énergie utilisable. soc énergie emmagasinée par la batterie énergie maximale que peut emmagasiner la batterie Pour la batterie considérée, la variation du SOC en fonction du temps de charge de la batterie est donnée dans la figure suivante : 80 70- 60 - 0 Ï Ï Ï Ï Ï (® 1 2 3 À 9 6 Temps de charge (h) Récemment, Wang et coll., en utilisant une anode composée de feuillets de graphène et de SnO: sont parvenus à réaliser une batterie dont la capacité spécifique est de 635 mA:h:# ! après 100 cycles charge/décharge, la capacité spécifique étant à l'origine de 784 mA:h-g ! À La diminution de la capacité spécifique est liée à la grande surface spécifique du graphène et est due à la perte irréversible d'ions lithium, du fait de à la décomposition de l'électrolyte, qui précipite et passive la surface de l'anode accessible pour la lithiation. | Q22- Estimer la perte de surface spécifique pour la batterie étudiée par Wang et coll. Dans les matrices polymères Le polypropylène (PP) est un thermoplastique largement utilisé dans l'emballage, les industries automobile et textile. L'incorporation de feuillets de graphène, pour constituer un matériau composite, permet de modifier ses propriétés. Les courbes de contrainte-déformation ont été obtenues par des $ D. Wang, X. Li, J. Wang, J. Yang, D. Geng, R. Li, M. Cai, T.-K. Sham, X. Sun, J. Phys. Chem. C 2012, 116, 22149-22156. Page 9/19 expériences de traction uniaxiale de la matrice de PP et de ses nanocomposites à différentes fractions massiques de nanofeuillets de graphène notés NFG (Figure 9). 70 L 60 40 - Contrainte (MPa) qq Le 7 qu qu 0 5 10 15 20 25 30 Déformation (%) 1 : PP seul. 2 : PP-NEG 0,2.3 : PP-NFG 0,5. 4 : PP-NEG 10.5 : PP-NFG 1,5.6 : PP-NEG 2,0. 7 : PP-NFG 30. Figure 9. Courbes de contrainte-déformation pour les nanocomposites PP-NFG. Q23- Rappeler la définition d'un polymère thermoplastique. Le comparer à un polymère thermodurcissable. Q24- Donner la formule du motif du polypropylène ou poly(1-méthyléthylène), issu de la polymérisation du propène, ainsi que les différentes structures stéréochimiques possibles. Q25- Indiquer comment évoluent le module d'Young, la résistance à la traction et l'allongement à la rupture lors de l'ajout de nanofeuillets de graphène (NFG)) à la matrice polymère PP (Figure 9). Q26- Quelle(s) propriété(s) intéresse(nt) l'industrie textile ou celle des emballages ? Q27- Quel peut être l'intérêt d'incorporer du graphène dans le béton ? 4. Exfoliation du graphite par fonctionnalisation du graphène selon la réaction de Diels-Alder Une méthode chimique peut également être employée pour produire du graphène via une réaction Diels- Alder réversible à partir du graphite. Le graphite est mis en réaction avec le tétracyanoéthylène (TCNE) conduisant à des adduits de Diels-Alder graphite-TCNE par formation de liaisons covalentes sur les feuilles de graphène (Schéma 1) La fixation de ces groupements volumineux sur les feuillets de graphène entraine l'éloignement des feuillets et permet une exfoliation mécanique par sonication en adduits de graphène-TCNE. Le graphène pur peut ensuite être récupéré par une réaction de rétro-Diels- Alder par chauffage à 100°C des adduits de graphène-TCNE. ° Z. Ji, J. Chen, L. Huang, G. Shi, Chem. Commun. 2015, 51, 2806-2809. Page 10/19 000-009-0000 00-00 000 779-00-20-00--00--90-90 0 se Graphite << | Graphène Diels-Alder (TCNE) NC CN rétro-Diels-Alder SR: Sonication rires | = >< pa (Exfoliation) 0-8 À oo on Adduit graphite-TCNE Adduit graphène-TCNE Schéma I. Production de graphène par exfoliation du graphite via une réaction de Diels-Alder réversible ? Q28- La réaction de Diels-Alder est sous contrôle orbitalaire. Justifier ce terme. Q29- En vous appuyant sur la réaction de Diels-Alder entre le cyclopentadiène et l'acrylate de méthyle (Figure 10), représenter les approches des molécules conduisant respectivement au produit endo et exo (voir Annexe 6 page 18). () 77 CO;Me cyclopentadiène acrylate de méthyle Figure 10. Q30- Justifier que, dans la réaction de Diels-Alder, le graphène peut se comporter à la fois comme un diène et comme un diénophile. L'anthrone (Schéma 2), et ses dérivés, se sont avérés particulièrement intéressants pour réaliser l'exfoliation du graphite, du fait de leur très grande réactivité dans les réactions de Diels-Alder. Dans les années 90, l'équipe de Rickborn a montré que l'anthrone, qui est en équilibre avec sa forme énol, le 9-hydroxyanthracène, réagit 10 000 fois plus vite que l'anthracène sur le N-méthylmaléimide (Schéma 2).'° 10 M. Koerner, B. Rickborn, J. Org. Chem. 1990, 55, 2662-2672. Page 11/19 O FC , CCC eis-Alde LOL Diels-Ald Anthrone modèle simplifié Graphite O NMe EXO) -- C0 -- ms HO Anthrone 9-hydroxyanthracène Schéma 2. Exfoliation du graphite par réaction de Diels-Alder avec l'anthrone et réactivité de l'anthrone. Q31- Justifier le fait que le 9-hydroxyanthracène réagisse plus vite que l'anthracène dans une réaction de Diels-Alder. Q32- L'équilibre céto-énolique anthrone/9-hydroxyanthracène est fortement dépendant du solvant et 1l apparait que la forme cétone est favorisée dans des solvants non polaires tandis que la forme énol existe majoritairement dans des solvants tels que le DMF, la pyridine ou la triéthylamine (Figure 11). Proposer une justification. UN PK N MesN SO -- NEt; DMF Pyridine Triéthylamine Figure 11. Q33- Proposer un mécanisme pour la formation du 9-hydroxyanthracène à partir de l'anthrone en milieu basique (HO sera utilisé comme base). L'intérêt de la réaction de Diels-Alder est qu'elle est réversible. Après exfoliation du graphite, la réaction de rétro Diels-Alder permet d'obtenir le graphène (Schéma 2). Q34- Proposer un mécanisme pour cette étape de rétro Diels-Alder en utilisant le modèle simplifié (Schéma 2). Parmi les dérivés de l'anthrone évalués pour l'exfoliation du graphite, la pentacen-6(13/)-one (1) s'est avérée particulièrement efficace et nous allons nous intéresser à sa synthèse à partir du phtalaldéhyde (2) (Schéma 3). Page 12/19 (LA Te CCC Ko ' TC " THF, 60°C phtalaldéhyde (2 Ce THE, 75°C CL -6(13hH)-one ( Schéma 3. Préparation de la pentacen-6(15H))-one (1). Q35- Proposer un mécanisme pour la première étape de la synthèse (Schéma 3) en se limitant à l'addition d'un seul équivalent de phtalaldéhyde (2). Q36- Donner la structure du composé 4 obtenu par réaction de la dicétone 3 avec le borohydrure de sodium (NaBH) sans tenir compte de la stéréochimie. Q37- Proposer un mécanisme pour la formation de la pentacen-6(13}H)-one (1) à partir de 4. L'utilisation du borohydrure de sodium (NaBH,) n'est pas efficace sur certains dérivés de l'anthrone comme c'est le cas pour la synthèse du composé 6 à partir de la quinone 5 (Schéma 4). Pour ces substrats faiblement réactifs, on utilise alors une réduction par le dichlorure d'étain (SnCb) pour obtenir intermédiairement le diol correspondant, qui, en milieu acide, conduit à la formation de 6 (Schéma 4). O O OH OH OH CL me CC HO HCI, 120°C 120°C HO HO 6 O 9 Schéma 4. Réduction d'autres quinones. Q38- Proposer une explication justifiant la faible réactivité de NaBH, sur la quinone 5. Q39- Donner l'équation bilan de la réaction de réduction de la quinone 5 par SnCl en présence de HCI (Schéma 4). Afin de rendre la molécule 6 soluble dans l'eau on va lui greffer des groupements hydrosolubles pour obtenir le composé 7 (Schéma 5). O O os COQ TA HO PAT o To 6 7 Schéma 5. Dérivé de l'anthrone hydrosoluble. | Q40- Proposer une voie de synthèse de la molécule 7 (réactif 8). 5. Post-fonctionnalisation des adduiïts de graphène Les adduits de graphène, fonctionnalisés par réaction de Diels-Alder, peuvent par la suite être post- fonctionnalisés, c'est à dire modifiés par réaction avec d'autres molécules, afin de leur conférer des Page 13/19 propriétés intéressantes. Dans cette partie, nous allons nous intéresser à l'introduction d'un complexe de ruthénium sur la surface d'un graphène fonctionnalisé par un dérivé de l'anthrone 9 possédant deux groupements amino (Schéma 6). Ces complexes de ruthénium possèdent des propriétés photochimique, photophysique et rédox très intéressantes pouvant être exploitées dans des matériaux composites pour élaborer des biocapteurs ou des photocatalyseurs. 2+ (PF6 )2 Schéma 6. Post-fonctionnalisation de feuillets de graphène par des complexes de ruthénium. Nous allons nous intéresser à la synthèse du complexe de ruthénium 11 à partir de la 4,4'-diméthy1-2,2'- bipyridine (12) commerciale (Schéma 7). CO:H CO:H NT, KMnO, SuOH, DCC H,0, reflux DMAP cat. H 55% 57% N CO-H (T, CO-H 2+ 15 EtOH, 100°C _ (PF6 )2 2) NH4PF6 85% O N \ DCC = N=C=N SUOH = N--OH DMAP = MEN N O Schéma 7. Synthèse du complexe de ruthénium IL. La synthèse de la 2,2'-bipyridine fonctionnalisée 15 débute par l'oxydation des groupes méthyles de la bipyridine substituée 12 par le permanganate de potassium dans l'eau. Les groupements acides carboxyliques sont ensuite activés par l'introduction d'un groupe succinimide à l'aide du N- hydroxysuccinimide (SuOH) en présence de l'agent de couplage dicyclohexylcarbodiimide (DCC) et d'une quantité catalytique de N,N-diméthylpyridin-4-amine (DMAP). Les chaines alkyles, portant une Page 14/19 fonction acide carboxylique terminale, sont finalement introduites par réaction du composé 14 avec l'acide 6-aminohexanoïque. Q41- Calculer la variation du nombre d'oxydation des atomes de carbone modifiés lors de la formation du composé 13 à partir de la bipyridine 12 et justifier qu'il s'agit d'une oxydation. Q42- Donner le bilan de l'étape de formation du composé 14 à partir du diacide 13. En vous aidant du Schéma 8 indiquer l'intérêt de l'utilisation du dicyclohexylcarbodiimide (DCC). son + Ty ao Sn DCC Cy = cyclohexyle Schéma 8. Réaction du DCC avec un acide carboxylique. Q43- Proposer un mécanisme pour la formation de la bipyridine fonctionnalisée 15 à partir du composé 14. Le spectre de résonance magnétique nucléaire (RMN) 'H du composé 15 a été enregistré à 400 MHz dans le DMSO-Wd, et présente les signaux suivants : Signal G(ppm)* [? Multiplicité A 1,20-1,65 12 m B 2,22 4 t,J= 7,1 Hz C 3,30 4 dt,J=6,3 et 7,0 Hz D 7,84 2 d, J = 4,6 Hz E 8,19 2 S F 8,86 2 d, J = 4,6 Hz G 8,95 2 t,J= 6,3 Hz H 12,01 2 S ! Déplacement chimique. ? Intégration. © m: multiplet, s : singulet, d : doublet, t : triplet, dt : doublet de triplet. Q44- Attribuer chacun des signaux aux différents protons de la molécule 15 (voir Annexe 7 page 19, la multiplicité des signaux RMN 'H devra être justifiée et les résultats présentés sous la forme d'un tableau). Q45- Donner la configuration électronique de l'atome de ruthénium et de l'ion ruthénium présent dans le complexe 11. Q46- Quelle est la géométrie des complexes 11 et 16 ? Q47- Donner le nombre d'oxydation du ruthénium dans le complexe 16 et dans le complexe 11. Comment nomme-t-on les étapes de formation de 11 à partir de 15 ? Q48- Le complexe formé 11 est chargé et va pouvoir être séparé du complexe initial 16 à l'aide d'une résine échangeuse d'ions. Le complexe initial est d'abord élué avec de l'eau puis le complexe formé est élué avec une solution de chlorure de sodium. Le chlorure joue le rôle de contre-1on et le Page 15/19 complexe en solution est ensuite précipité à l'aide d'hexafluorophosphate d'ammonium (NH,PF5). Expliquer. Fin de l'épreuve Page 16/19 Annexes Annexe I. Constantes usuelles et approximations de calcul. Constante de Faraday : F = 10° C'mol'!. Constante d'Avogadro : MN, = 6.10 mol. 1 7 On considèrera V3 # DT 3. Annexe 2. Données numériques. Numéros atomiques : EUR (Z = 12), Ru (Z = 44). Longueur de la liaison C-C dans le graphite ou le graphène : £c = 0,14 nm. Distance entre deux feuillets de graphène dans le graphite : d= 0,34 nm. Masse volumique de l'eau à 298 K : p,4= 10° kg:m *. Rayon atomique du lithium : r,; = 0,15 nm, rayon ionique du lithium : r,;+ = 0,08 nm Annexe 3. Données thermodynamiques. Enthalpies standard de liaison à 298 K : De y = 410 et Dy_n = 430 en kJ-mol. Enthalpie standard de sublimation du graphène : AH°(Cosaphène) = 720 KJ-mol. Annexe 4. Potentiels standards. ESn"/Sn°*) = 0,14 V EMnO4/MnO)) = 1,51 V Annexe 5. Diagrammes de phase des systèmes C-Ni et C-Cu./! +000 3828°C 3300 - © & 2600- P (Craphite) 7 G Le ® Lost = 1900- Ê Les £ SSR-- 7 1326°C 1200 - " : (Ni) ï . (Ni) + Cgraphite 500 LE I I T1 | 6-..__.-: 20 -_------ 49--------- 60-- 80 100 Agrandissement Ni C % atomique de C M M. Singleton, P. Nash, Bull. Alloy Phase Diagr. 1989, 10, 121-126. G. A. Lôpez, E. J. Mittemeijer, Scripta Materialia 2004, S1, 1-5. Page 17/19 2400 L 2000 - © 2 1600- L+(C) 2 oe SO Q. 5 1200 -| (Eu+L ___1100°C 1084 (Cu) 200! / (CuH(C) 600 [ [ [ [ [ [ 0 0,04 0,08 0,12 0,16 0,2 0,24 cu % atomique de C c Annexe 6. Orbitales frontalières simplifiées, énergies (en eV) et coefficients du cyclopentadiène et de l'acrylate de méthyle. Cyclopentadiène Acrylate de méthyle Perspective Vue dessus Energie Perspective Vue dessus Energie (eV) (eV) av -0,37 0.60 OMe 0,48 : --0 01 0,60 -0,37 027 -0,60 OMe HO --9,08 « --11,07 0,60 0,37 Page 18/19 Annexe 7. RMN 'H (gamme de déplacements chimiques) .!? Proton Ô (ppm) 4/ 0,8-1,3 4/-- 1,5-24 H a 23-29 OH HT 19-28 O O Ne 2,3-3,7 | H7 07 3,442 4 4,5-72 H \ 65-90 Î 9.0-10.5 , --] , A O LA, R 6-10 H O 10-12 a ok 2 E. Prestsch, P. Bühlmann, M. Badertscher, Structure Determination of Organic Compounds, Springer-Verlag, Berlin, Heidelberg, 4 edn. 2009. Page 19/19
