Mines Chimie PC 2019
| Thème de l'épreuve | Synthèse énantiosélective du trifariénol B. La caféine. |
| Principaux outils utilisés | chimie organique, thermodynamique, potentiel chimique, cristallographie |
| Mots clefs | trifariénol, caféine, supercritique, extraction |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




















Rapport du jury
(télécharger le PDF)








Énoncé obtenu par reconnaissance optique des caractères
A2019 --- CHIMIE PC
Cm
Concours commun
Mines-Ponts
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT Atlantique, ENSAE PARISTECH,
CHIMIE PARISTECH.
Concours Centrale-Supélec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVP.
CONCOURS 2019
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 4 heures
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - PC
L'énoncé de cette épreuve comporte 30 pages de texte.
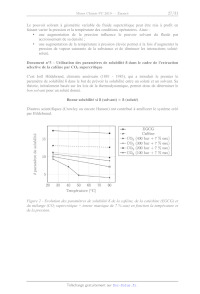
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
À 2019 chimie PC
DEBUT DE L'ENONCE
Des données utiles à la résolution du problème sont fournies à la fin de
l'énoncé.
Cette épreuve est constituée de deux parties indépendantes.
Synthèse énantiosélective du Trifariénol B
Le trifariénol À et le trifariénol B sont des molécules naturelles extraites
d'une plante :
l'hépatique Cheilolejeunea trifaria. Elles présentent un grand intérêt
biomédical en raison de
leurs propriétés anti-inflammatoires, entre autres, justifiant ainsi les études
visant à les
synthétiser. Leurs structures ont été établies en 1994 en utilisant une
combinaison de
techniques telles que la RMN et l'analyse cristallographique aux rayons X
| |
Trifariénol A Trifariénol B
OH OH
HO HO
La synthèse totale du trifariénol B a été achevée dès 1995. Malheureusement, le
composé
était obtenu sous forme d'un mélange racémique. En 1999, une synthèse
énantiosélective fut
réalisée, mais avec un rendement très faible. En 2008, l'équipe du professeur
Toshio Honda
de l'Université Hoshi à Tokyo en publie une nouvelle synthèse, beaucoup plus
efficace, qui
est l'objet de ce problème qui comporte deux parties indépendantes.
La partie 1 étudie la synthèse proprement dite du trifariénol B à partir du
cétoester 1 donné
ci-après.
La partie 2 est consacrée à la synthèse énantiosélective du cétoester 1,
réactif de départ du
travail de l'équipe de T. Honda, en partant de la 2-méthylcyclohexanone et du
crotonate de
méthyle selon la méthode décrite par I. Jabin et collaborateurs dans une
publication datant
de 1995.
MeO,C O
ue À IT
crotonate de méthyle 2-méthylcyclohexanone
Page 1 /30
Chimie 2019 Filière PC
Ouestions préliminaires
1- Le trifariénol B est-1l un composé chiral ? Justifiez la réponse.
2- Déterminer, en expliquant le raisonnement, le nombre de stéréoisomères de
configuration du trifariénol B.
3- Préciser la relation de stéréochimie entre le trifariénol À et le
trifariénol B.
Première partie : Synthèse du Trifarienol B à partir du cétoester 1
Le composé I est d'abord transformé en l'éther d'énol silylé 2 selon une
réaction de O-
alkylation par action du chlorure de triméthylsilyle dans le DMF en présence de
triéthylamine. On précise que les éthers silylés s'hydrolysent en dérivés
carbonylés en milieu
acide aqueux.
MeOOC TMSCI, EUN MeOOC
O DMF, 130°C, 68h TMSO
1 2
a S /
DMF: ON TMSCI Cgf
Une réaction entre le composé 2 et le tétrahydruroaluminate de lithium dans le
THF, suivie
par une hydrolyse, conduit à un composé 3. Dans le dichlorométhane en présence
d'une base
comme la pyridine, le composé 3 est ensuite converti en 4 par action du
chlorure de benzoyle.
Le mécanisme de cette étape d'estérification est détaillé dans le document À.
M
e0oc LiAIH4
TMSO THF, 0°C, 40 min
BzCI, pyridine
- 2.
CHLCl O°C, 60 min
CI
THE: Co BzCI: O
Page 2 /30
Chimie 2019 Filière PC
Document A : Mécanisme d'estérification en présence de pyridine
O--
20 JON (el ZO'
WT" LS Le o
RT "Ci -- RCI UN RY CNT NN + ici
-- ICI À, ( --
: SZ
OR
H
2) OY (Pe --
ICI + IS R <-------- ICI + RSR EN + ICI _-- | d-- H H D à * N® * N | | Z Z 4- Donner Ja structure du composé 3. Préciser également la proportion de tétrahydruroaluminate de lithium à utiliser par rapport au composé 2 pour réaliser cette transformation dans des proportions stoechiométriques. 5- Donner la structure du composé 4 en précisant, à l'aide du document A, le double rôle de la pyridine. Le composé 4 est ensuite transformé en cétone a,b-insaturée 5 selon une oxydation dont le mécanisme n'est pas étudié ici. Pd(OAc)> O; BzO
DMSO, 80°C, 15h 0
5
Par la suite, le composé $ est traité par du méthyllithium dans le THF à --78
°C en présence
d'iodure de cuivre (1) pour conduire principalement au diastéréoisomère 6. Pour
expliquer
cette stéréosélectivité, les auteurs de la publication proposent une approche
axiale de
l'organocuprate sur la conformation demi-chaise la plus stable de l'énone 5.
BzO MelLi, Cul BzO
O THE, -78°C, 80 min O 0)
5 6
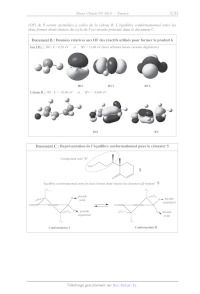
Pour l'étude de cette étape, deux documents sont donnés. Le document B
rassemble les
données relatives aux orbitales moléculaires des réactifs mis en jeu ; les
orbitales frontalières
Page 3 /30
Chimie 2019 Filière PC
(OF) de 5 seront assimilées à celles de la cétone B. L'équilibre
conformationnel entre les
deux formes demi-chaises du cycle de 5 est ensuite présenté dans le document C.
Document B : Données relatives aux OF des réactifs utilisés pour former le
produit 6
Ion CH3 : HO:E-=0,58eV et BV = 13,48 eV (deux orbitales basses vacantes
dégénérées)
HO BV1 BV2
Cétone B : HO:E--10,40 eV et BV = 0,068 eV
HO BV
Document C : Représentation de l'équilibre conformationnel pour le cétoester 5
Équilibre conformationnel entre les deux formes demi-chaises du cétoester
o,B-insaturé 5
CH x Hx
pseudo atég
RW axial H< pseudo équatorial O0---- = e--> O---- ----------
mHs 1% pseudo :H3C H d
fa éq | éq!13 X pseudo
équatorial axial
Hx Rax
Conformation I Conformation II
Page 4 /30
Chimie 2019 Filière PC
6- Proposer un mécanisme expliquant la formation de 6 à partir de 5. La démarche
permettant d'expliquer la régiosélectivité de la réaction devra être justifiée
à l'aide des
données du document B.
7- Des calculs de modélisation moléculaire ont indiqué que l'équilibre
conformationnel
représenté sur le document C est nettement déplacé en faveur de la conformation
I. Montrer
que cette information permet de rendre compte de la stéréosélectivité obtenue
pour cette
addition. Expliquer pourquoi les auteurs ont parlé d'attaque axiale dans ce cas.
Le cétoester 6 est ensuite converti en trois étapes en cétoester vinylique 9,
de structure
donnée ci-dessous.
étape 1 étape 2 étape 3
BzO O "y BzO O BzO
6
8- Préciser la structure du composé 7.
Le cétoester 9% est ensuite solubilisé dans le THF à --78° C, puis est traité
par
l'hexaméthyldisilazoture de sodium (NaHMDS) en présence de
bis(trifluorométhane)sulfoni-
mide de phényle, PhNTf;, pour conduire au composé 10.
PhNTf, NaHMDS
BzO BzO
O > THF, -78°C, 2,5h TO
9 / 10 7
-
|
SO2CF3 Sa
N NaHMDS: (
NS N.
PRNTÉ, : CY SO:CF; Na" Si
9- Quel est le rôle de NaHMDS ?
Le couplage de Kumada-Corriu utilisé dans la réaction suivante permet de former
un
intermédiaire 11 (non isolé) à partir du composé 10. Une hydrolyse par action
de la soude
dans un mélange THF/eau/DMF entraine la conversion de cet intermédiaire 11 en
composé
12. Le cycle catalytique expliquant le couplage de Kumada-Corriu est donné dans
le
document D.
Page 5 /30
Chimie 2019 Filière PC
TMS MC!
TfO D THPF, reflux, 1h THF, H0, DMF TMS
10 | reflux, 15 min
12
Document D : Cycle catalytique du couplage de Kumada-Corriu.
(Ph)3P: pq: P (Ph)
(Ph)3P° 'P(Ph}3
DO = 0
2 en). 1
q P(PN)s
(Ph):P ROTf
DO = 0
(Ph)3P: R:- .P(Ph)}3
(Ph):3P (Ph)3P 'OT
DO = +II DO = +1
R'MgX
R. PPR)s MgXOTf
(Ph}3P° 'R'
DO = +1
10- A quels types de réactions appartiennent les étapes 1, 2 et 5 du cycle
catalytique ?
11- Donner la structure de l'intermédiaire 11.
12- Ecrire un mécanisme pour expliquer la formation de l'alcool 12 à partir de
l'intermédiaire 11.
Le composé 12 est ensuite oxydé en utilisant les conditions douces décrites par
Swern. En fin
de réaction, l'avancement de la réaction est contrôlé par chromatographie sur
couche mince.
Celle-ci révèle que des traces d'alcool 12 de départ sont encore présentes.
Afin de séparer
Page 6 /30
Chimie 2019 Filière PC
l'aldéhyde désiré 13 de l'alcool de départ 12, une purification par
chromatographie sur gel
de silice est alors réalisée.
HO (COCI), DMSO, EN 07
TMS D CH2Cl, -78°C, 2,5h TMS a
12 / 13 /
À l'aide d'une réaction de Hosomi-Sakurai, dont le bilan et le mécanisme sont
proposés dans
le document E, l'aldéhyde 13 est transformé en alcool insaturé 14 par action du
tétrachlorure
de titane dans le chloroforme.
07 TiCl4 :
TMS = CHCI; reflux, 30 min no
13 | puis hydrolyse Z 14
Document E : Bilan et mécanisme proposé pour la réaction de Hosomi-Sakurai
© JR STMS OH
L 2 TiCla TR
puis hydrolyse
Cl
CI Ti CI
C| /y 4 \ CTI
_k RSS er
R: Ro > R: Y + [CI
Ro --
ClaTi, |
OH 3 "ON
RCA Hydrolyse RAR
RTR, NT RTR, NS 4 TMSCI
13- À l'aide du document E, montrer que la réaction de Hosomi-Sakurai permet
effectivement, après hydrolyse, d'obtenir le composé 14 à partir de l'aldéhyde
13.
Page 7 /30
Chimie 2019 Filière PC
L'estérification de l'alcool 14 en 15 suivie d'une oxydation de Upjohn conduit
au composé 16.
Cette dihydroxylation est réalisée en présence d'une quantité catalytique de
tétraoxyde
d'osmium (OsO,) et stæchiométrique en N-oxyde de N-méthylmorpholine (NMO). La
formation diastéréosélective du composé 16 sera admise ainsi que la
régiosélectivité de la
réaction.
O
| ci \
OsO, (cat)
NMO
HO 7 15 > O
(CHNMe;)s THPF, t-BUOH , H,0O
14 CH,Cl 0°C, 60 min O
OH
JO N\ OH
NMO : OO ON. 16
©
14- Donner la structure du composé 15.
15- Proposer un cycle catalytique permettant d'expliquer la formation du
composé 16 à
partir de 15. Illustrer ce cycle en donnant la (les) structure(s) du (des)
composé(s) obtenu(s) à
partir du cyclohexène. On indique que la N-oxyde de N-méthylmorpholine est
convertie en N-
méthylmorpholine à la fin de la réaction.
Le (-)-Trifariénol B est finalement obtenu par action du diiodure de samarium
sur le
composé 16.
Sml
0 HMPA, 5 min
, © MIN (-)-Trifarienol B
0 OH oH
16 CH of ï
AUPA ES nr
EN
16- A quelle classe de réaction appartient cette dernière étape ? Justifier la
réponse.
Page 8 /30
Chimie 2019 Filière PC
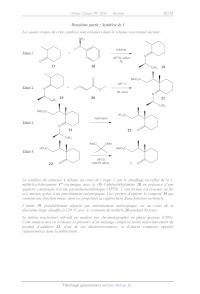
Deuxième partie : Synthèse de 1
Les quatre étapes de cette synthèse sont résumées dans le schéma réactionnel
suivant :
| toluène
Etape 1 :
APTS, "flux |
No
x
MeO;C
120 °C
Étape 2: >
30 jours
en #0 À =
CeHs
MeO;C
HO,C
hydrolyse
Étape 3: >
À * F7 "
Ces
MeO OMe
, HO;:C Xe MeO;C
Etape 4:
APTS
MeOH reflux 1 O
La synthèse du cétoester 1 débute, au cours de l'étape 1, par le chaufjage au
reflux de la 2-
méthylcyclohexanone 17 racémique avec la (R)-1-phényléthylamine 18 en présence
d'une
quantité catalytique d'acide paratoluëènesulfonique (APTS). L'eau formée est
évacuée au fur
et à mesure grâce à un entraînement azéotropique. Ceci permet d'obtenir le
composé 19 qui
contient une fonction imine, dont les propriétés la rapprochent d'une fonction
carbonyle.
L'imine 19, préalablement séparée par entraînement azéotropique, est au cours
de la
deuxième étape chauffée à 120 °C avec le crotonate de méthyle 20 pendant 30
jours.
Le milieu réactionnel refroidi est analysé par chromatographie en phase gazeuse
(CPG).
Cette analyse met en évidence la présence d'un mélange complexe formé
majoritairement du
produit d''addition 21, d'un de ses diastéréoisomères, et d'autres composés
appelés
régioisomères dans la publication.
Page 9 /30
Chimie 2019 Filière PC
La synthèse se poursuit dans l'étape 3 par l'hydrolyse du mélange précédent. Le
cétoacide 22
est à ce stade le composé majoritairement présent dans le milieu organique.
Pour finir, le mélange issu de l'étape précédente est traité par le
2,2-diméthoxypropane dans
le méthanol en présence d'APTS, puis porté à reflux pendant 6 h.
L'analyse du mélange résultant par CPG a donné les résultats suivants :
° 76,5 % de cétoester 1
° 21,5 % de régioisomères de 1
° 2% d'un diastéréoisomère de 1
L'énantiomère de I n'a quant à lui pas pu être détecté.
Après une série d'étapes de purification, le cétoester I est obtenu pur sous
forme d'une huile
incolore qui présente un pouvoir rotatoire spécifique [&)]5° valant 77 ©. g
!.L.dm
17- Le spectre RMN 'H du crotonate de méthyle 20 est donné ci-après sous forme
d'un
tableau. A l'aide du document F, attribuer les signaux aux divers protons de 20
notés selon la
figure suivante, puis confirmer la stéréochimie du composé utilisé. On
négligera le couplage
4
Jac-
H4 O H,
a
O d
h; H,
H
H, c
LT
Hz ppm Intégration Hz ppm Intégration Hz ppm Intégration
2088,2 6,961 20 1738,1 5,794 26 11O0OI,01 3,67 1000
2081,4 6,938 60 1736,4 5,788 70 568,27 1,894 265
2074,6 6,915 61 1734,8 5,783 70 566,61 1,889 265
2072,8 6,909 24 1733,1 5,777 26 561,4 1,871 264
2067,7 6,892 23 1722,6 5,742 24 559,75 1,866 262
2065,9 6,886 66 1720,9 5,736 64
2059,1 6,864 66 1719,3 5,731 64
2052,2 6,841 22 1717,6 5,725 24
Déplacements chimiques (en Hz et ppm) et intégrations des pics du crotonate de
méthyle
selon le spectre RMN 'H dans le chloroforme (300 MHz).
Page 10 /30
Chimie 2019 Filière PC
Document F: données RMN 'H
Groupe fonctionnel Déplacement chimique Structure Juts Ty F ical
range value
x CH; --CH;-- G à T
ss ee
--C--CH,--C-- --
+ » Fr
| CH 3 CH\ 5-7 6
HA£ -- F8 L
-- C=CH -- --CH;---CH,-- 5-8 7
H3C -- C -- -
L YCH--CH< 08 7 HC--NT ------ PE: ee R-- CH, --NT -- 4 CCHCHX 4-11 6 R-- CH, --C-- -- We de | Fe C=CH----CH=C \ 6-13 118 H3C-- 0 -- alu R-- --0-- --- YSCH--CHO 0-3 2 R-- OH ©c=cH + _-- & , C=CH--CHO 5-8 7 -- CH--=CH-- >" L = cis-CH--CH-- 0-12 8
EN --!
_ trans-CH=CK-- 12-18 15
R--C--0O --
4
R--C-- OH Constantes de couplage entre protons portés par des
À È 7 : | È | { carbones vicinaux (en Herti)
TMS :tétraméthysilane CRT (source: Constantes des spectres RMN par Nicole
Platzer -- banque documentaire « Techniques de
déplacements chimiques en fonction de la nature | l'Ingénieur »)
chimique du groupement fonctionnel (en ppm par
rapport au TMS)
Pour comprendre la régiosélectivité et la stéréosélectivité de la formation de
21, on
s'appuiera sur les données des documents G et H. On ne s'intéresse pas dans un
premier
temps à la stéréochimie des composés obtenus.
18- Proposer un mécanisme pour l'équilibre de tautomérie qu1 s'établit entre
l'imine 19 et
l'énamine 19°. Il est conseillé d'écrire cet équilibre en catalyse basique, la
base étant notée B.
Quelle autre énamine (notée 19°?) est susceptible de se former ?
19- Schématiser le mouvement des électrons au cours de l'acte élémentaire
expliquant la
formation de 21.
20- Proposer une structure pour les régioisomères de 21 susceptibles de se
former en
expliquant les mécanismes correspondants.
Page 11 /30
Chimie 2019 Filière PC
On s'intéresse à présent à la Stéréochimie des composés obtenus. On donne
ci-dessous une
représentation schématique simplifiée de l'énamine 19" dans sa conformation la
plus stable.
7 -- MeO>C ,
Ne NH
RS | /
H 4 N
CéHs
21- En utilisant la représentation ci-dessus et le document H, montrer à l'aide
d'un(de)
schéma(s) clair(s) explicitant l'approche des réactifs et indiquant l'existence
de l'interaction
secondaire mentionnée dans l'extrait de l'article, que la stéréochimie de
l'atome de carbone
de 21 marqué d'un astérisque peut être expliquée.
22- Déduire des questions précédentes la structure du diastéréosiomère de 1
présent dans le
mélange analysé par CPG. Par analogie avec la définition de l'excès
énantiomérique, calculer
l'excès diastéréoisomérique observé au cours de la synthèse du cétoester 1.
Document G : Données relatives à la réaction de formation de l'iminoester 21
AV MeO,C
-- >
N
HN 20
À 19 À 19' 21 N\
Ces Ces À
CéHs
La première étape de la réaction est un équilibre in situ de tautomérie entre
l'imine 19 et
l'énamine 19". Il est équivalent à un équilibre céto-énolique.
La transformation se poursuit par une réaction entre l'énamine 19° et le
crotonate de méthyle
20 qui conduit à l'iminoester 21. Cette étape se déroule en un seul acte
élémentaire au cours
duquel la formation de la liaison entre les atomes de carbone de l'énamine et
du crotonate,
ainsi que le transfert de proton entre ces deux mêmes molécules sont concertés.
Page 12 /30
Chimie 2019 Filière PC
Document H : Régiosélectivité et stéréosélectivité de la formation de
l'iminoester 21
Pour expliquer ces deux aspects de la réaction de formation du composé 21, on
donne un
extrait de l'article de Pfau et collaborateurs paru en 1995 dans Tetrahedron
Asymmetry.
Des calculs théoriques [...] concernant l'addition de la vinylamine sur le
propénal (schéma ci-
dessous) ont montré que l'état de transition possède une structure compacte
(approche syn)
avec des interactions secondaires attractives entre l'atome de carbone de la
fonction
aldhéhyde et l'atome d'azote, et qu'elles sont prépondérantes par rapport aux
interactions
stériques. Dans le cas d'approches syn, l'énergie du complexe de type chaise a
une énergie
inférieure à celle du complexe de type bateau [...]. La formation de la liaison
C-C et le
transfert de H se font de manière concomitante pendant cette réaction.
Pc FES H°, 20 pee :
--+
/ jé + EUR leu
#4 es" H
Type chaise Type Bateau
La géométrie proposée pour ce complexe activé a permis de prédire la
stéréochimie des
produits majoritaires de la réaction [...]. Pour les adduits majoritaires
représentés dans le
schéma suivant, les groupes Ri et R; sont en relation syn, alors que les
substituants R et R2
peuvent être en relation syn ou anti suivant la configuration Z ou Æ de R; avec
le groupe
attracteur COOMe. |... | L'approche de l'alcène s'effectue arbitrairement par
le dessus du plan
de l'énamine.
N-- Ph
Une importante énantiosélectivité est généralement observée lorsque les
énamines obtenues à
partir d' [...] amines chirales réagissent avec des composés éthyléniques
électrophiles non
Page 13 /30
Chimie 2019 Filière PC
substitués. Une étude théorique a montré que la configuration absolue du
nouveau centre
stéréogène résulte de la réaction des conformères de basse énergie des
complexes activés
alcènes-énamine. Certains d'entre eux conduisent à une configuration absolue,
les autres à son
opposée. La configuration absolue favorisée est obtenue sous contrôle
cinétique. Toutefois, en
considérant que l'approche de l'alcène sur l'énamine conserve une géométrie
rigide, une règle
heuristique, en accord avec tous les exemples connus, permet la prédiction de
l'approche
diastéréofaciale favorisée. Elle s'appuie sur la configuration absolue de
l'auxilhiaire chiral qui
induit deux demi-espaces de chaque côté du plan de l'énamine, non équivalents
d'un point de
vue stérique (schéma suivant).
ue
at
H----N NH
H
...sS
EUR
La caféine
La caféine fut découverte en 1819 par le chimiste allemand Friedrich Runge (il
la nomma
kafjein en tant que composé chimique du café) et décrite en 1821 par les
chimistes français
Pierre Joseph Pelletier et Pierre Jean Robiquet. Elle est présente dans les
graines, les fruits
et les feuilles de différentes plantes où elle agit comme un insecticide
naturel. Chez l'homme,
la cafèine est un stimulant des systèmes nerveux central et cardio-vasculaire,
permettant
entre autres de surmonter la fatigue, d'augmenter la vigilance, d'activer la
circulation
sanguine ou encore de dilater les muscles pulmonaires.
La famille des xanthines
La caféine (1,3,7-triméthylxanthine) est un alcaloïde (substance contenant un
ou plusieurs
atomes d'azote basique) de la famille des xanthines. Elle est présente dans de
nombreux
produits de consommation courante : le café, le thé, les boissons à base de
cola, ... On trouve
dans la nature deux autres molécules similaires : la théobromine (alcaloïde
principal des
fèves de cacao) et la théophylline (à l'état de traces dans les feuilles de
thé).
Page 14/30
Chimie 2019 Filière PC
O R:
» |
E. N d
T k,
O7 N° Ne
|
Ro
Noms R; R; R; PKA
Xanthine H H H 0,8 et 9,9
Caféine CH; CH; CH; 0,7
Théobromine H CH; CH; 0,1 et 10,1
Théophylline CH; CH; H 1,5 et 8,8
La xanthine peut être modélisée par l'association de deux molécules
représentées ci-dessous :
| H
/
H
Ne H C:
?
AA, K
H
Uracile (UH) Imidazole (Im)
23- La molécule d'imidazole est plane. Cette constatation est-elle en accord
avec Îles
prévisions de la théorie V.S.E.P.R. ? Justifier la réponse.
24- Représenter l'ensemble des formes mésomères envisageables pour l'imidazole
et
indiquer le nombre d'électrons délocalisés.
25- Le couple ImH'/Im possède un pKA égal à 6,9 à 298 K. En raisonnant sur la
stabilité de
l'ion imidazolinium ImH", déterminer quel atome d'azote constitue le site
préférentiel de
protonation de l'imidazole.
Page 15 /30
Chimie 2019 Filière PC
26- Tracer le diagramme de prédominance des différents couples acido-basiques de
l'imidazole mis en jeu dans l'eau. Le pKA du second couple de l'imidazole est
de 14,2 à 298 K.
L'uracile est une espèce ampholyte intervenant dans deux couples acido-basiques
UH> /UH
et UH/U :
° l'atome d'oxygène du carbonyle situé entre les deux atomes d'azote (N, et N})
est un
site basique impliqué dans le couple UH,'/UH de pK1 = -4,2 à 298K
° le couple UH/U de pK4 = 9,9 à 298 K
27- En raisonnant par analogie avec les composés carbonylés, quel atome
d'hydrogène est le
plus acide dans la molécule d'uracile ?
28- En utilisant la modélisation précédente, interpréter la valeur pKA = 0,7
pour la caféine et
la valeur pKA = 8,8 pour la théophylline.
Formes polymorphes de la caféine
Dans une étude publiée dans The Journal of Thermal Analysis and Calorimetry,
Griesser et
ses collaborateurs ont étudié plusieurs composés organiques dont la caféine.
Leurs propriétés
physico-chimiques, comme la solubilité, la température de fusion et la pression
de
sublimation ont une grande importance industrielle car elles peuvent affecter
les
caractéristiques de la formulation, de la durée de vie ou encore l'effet
thérapeutique d'un
médicament. Ces propriétés ne sont pas les mêmes pour les différentes formes
cristallines
d'un même composé. En complément aux méthodes classiques, comme l'analyse
thermique,
la diffraction des rayons X et la spectroscopie, des données thermodynamiques
importantes
sur les modifications polymorphiques peuvent être obtenues par des mesures de
solubilité ou
de pression de sublimation.
La caféine est connue pour posséder deux formes polymorphiques différentes : on
appellera
la forme basse température forme IT (B-caféine) et la forme cristalline haute
température
forme I (a-caféine). La forme IT est stable entre 25 °C et T,,;, température
dite de transition à
laquelle elle se transforme en forme I. La forme I fond à 236 °C.
L'objectif de cette sous-partie est de déterminer l'enthalpie de transition
entre les deux formes.
Afin d'établir les relations utiles, on considère pour commencer le cas général
de l'équilibre
solide-vapeur d'un corps pur.
Soit un système contenant une quantité de matière n, d'un corps pur sous forme
solide et une
quantité de matière n, de ce même corps pur sous forme gazeuse. On note n la
quantité de
matière totale. Ce système diphasé est en équilibre thermique et mécanique avec
l'extérieur.
Pour le système étudié, la différentielle totale de l'enthalpie libre G s'écrit
:
dG = VdP -- SaT + D u:dn,
i
où ui; est le potentiel chimique ou enthalpie libre molaire partielle de
l'espèce chimique i.
Le potentiel chimique s'écrit de manière générale, en fonction de l'activité a;
de l'espèce
chimique i, sous la forme :
u;(T,P,composition) = u;(T) + RTin a;
Page 16 /30
Chimie 2019 Filière PC
Notations à utiliser pour la résolution de cette partie
Us ; Ug Potentiel chimique du corps pur dans la phase solide ; potentiel
chimique
du corps pur dans la phase vapeur
Us: Ug Potentiels chimiques des formes I et II de la caféine dans la phase
vapeur
ul ; ul Potentiels chimiques des formes I et II de la caféine dans la phase
solide
hs; h Enthalpie molaire de la phase solide ; enthalpie molaire de la phase
gazeuse.
Ss > Sg Entropie molaire de la phase solide ; entropie molaire de la phase
gazeuse.
Vs ; Vy Volume molaire de la phase solide ; volume molaire de la phase gazeuse.
P, ; Py Pressions de sublimation relatives aux équilibres solide -- vapeur des
formes I et II de la caféine.
AsupH=h, --h; Enthalpie de sublimation
AsupS = Sy --Ss Entropie de sublimation
À up) ; Asp H(D) Enthalpie de sublimation de la forme IT; enthalpie de
sublimation de la
forme II
À,,.H Enthalpie de transition (forme II --> forme I)
A;jetAyr Coefficients relatifs à l'équilibre solide -- vapeur de la forme I
B;etBy Coefficients relatifs à l'équilibre solide -- vapeur de la forme II
29- Donner les expressions du potentiel chimique u,, d'un gaz parfait pur en
fonction de la
pression totale P et le potentiel chimique 4, d'une phase condensée solide pure
(pour laquelle
on négligera les effets de la pression). On précisera dans ces deux cas la
sigmification de la
grandeur u;(T).
30- Montrer, à partir de la définition de l'enthalpie libre G et des deux
principes de
la thermodynamique, que :
> kidn, -- --TO;,S
i
où Ô,S correspond à la création d'entropie interne du système.
31- Déterminer la condition d'évolution spontanée du système. Justifier alors
que la phase
solide est la plus stable lorsque le système est soumis à une pression P
supérieure à la pression
de vapeur saturante P. dont on donnera l'expression.
Page 17 /30
Chimie 2019 Filière PC
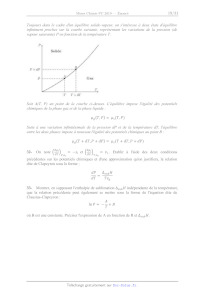
Toujours dans le cadre d'un équilibre solide-vapeur, on s'intéresse à deux
états d'équilibre
infiniment proches sur la courbe suivante, représentant les variations de la
pression (de
vapeur saturante) P en fonction de la température T.
P,
Solide
porte LES eu
jf? Eee --
bel mm ...--
ms
cn
EL
(ss
Soit A(T, P) un point de la courbe ci-dessus. L'équilibre impose l'égalité des
potentiels
chimiques de la phase gaz et de la phase liquide :
UT, P) = Us(T,P)
Suite à une variation infinitésimale de la pression dP et de la température dT,
l'équilibre
entre les deux phases impose à nouveau l'égalité des potentiels chimiques au
point B :
UG(T + dT,P + dP) = u,(T + dT,P + dP)
ui ui .......
32- On note (#) -- --S;, et (Si) -- V,. Etablir à l'aide des deux conditions
OT /pn; dP/rn.
précédentes sur les potentiels chimiques et d'une approximation qu'on
justifiera, la relation
dite de Clapeyron sous la forme :
dP h A cubH
dT Tv,
33- Montrer, en supposant l'enthalpie de sublimation À.,,, H indépendante de la
température,
que la relation précédente peut également se mettre sous la forme de l'équation
dite de
Clausius-Clapeyron :
nP=-1+8p
DT
où B est une constante. Préciser l'expression de A en fonction de R et AÀ.,, H.
Page 18 /30
Chimie 2019 Filière PC
On considère désormais les équilibres solide-vapeur de chaque forme solide de
la caféine
avec leur vapeur selon :
Solide (Forme I) -- Vapeur et Solide (Forme IT) = Vapeur
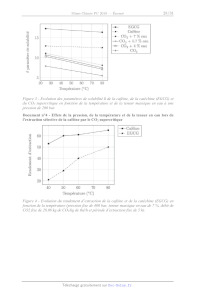
34- Vérifier que la forme la plus stable est celle qui possède la pression de
sublimation la
plus faible.
35- Etablir l'expression de la température de transition T., entre les deux
formes cristallines
de la caféine en fonction des coefficients À et B respectifs (qu'on notera avec
les indices
correspondant à chaque forme).
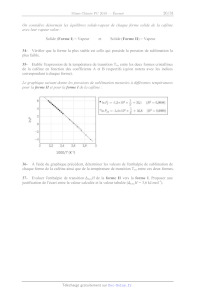
Le graphique suivant donne les pressions de sublimation mesurées à différentes
températures
pour la forme IT et pour la forme I de la caféine :
6 NS 1 | |
. 'NP, =-1,3x10 x Ù 33,1 (R? -- 0,9998)
ä l j
"InP,, =-1,4x10 x 7 + 35,8 (R< = 0,9999) 2 Q. © Q _9 NN 4 K 2 32 2,4 2,6 2,8 3 1000/T (K°1) 36- À l'aide du graphique précédent, déterminer les valeurs de l'enthalpie de sublimation de chaque forme de la caféine ainsi que de la température de transition T., entre ces deux formes. 37- Evaluer l'enthalpie de transition AÀ,,.H de la forme IT vers la forme [L. Proposer une justification de l'écart entre la valeur calculée et la valeur tabulée (A;,.H = 3,6 kJ.mol"). Page 19 /30 Chimie 2019 Filière PC Dans la sous-partie suivante nous nous intéressons à la structure cristallographique de la forme I. Une première structure cristallographique a été proposée en 2005 : la forme I cristallise dans le système hexagonal. La maille est caractérisée par deux paramètres : le côté de l'hexagone a = b = 1494 pm et la hauteur c = 690 pm. On précise également que «a = f -- 90° et y = 120°. Dans la suite du problème on ne s'intéressera qu'à 1/3 de la maille hexagonale (prisme à base losange) dont on donne la projection suivant l'axe c. Figure 1 - Projection suivant l'axe c d'un tiers de la maille hexagonale (la notation (2c) indique qu'il y a 2 molécules de caféine sur l'axe c (sommets exclus) et la notation (2i) indique qu'il y a 2 molécules de caféine au sein de la maille). 38- À quel type de cristal appartient la forme I de la caféine ? Quels types d'interactions sont responsables de la cohésion de la structure cristalline ? 39- Exprimer la masse volumique p, de la forme I de la caféine en fonction de sa masse molaire et des paramètres de la maille, puis en calculer une valeur approchée raisonnable. Complexation de la caféine à un indicateur coloré Les indicateurs colorés, tels que le bleu de méthylène, sont des molécules ioniques solubles dans l'eau. La présence de charges rend aussi ces entités capables de se complexer avec un grand nombre de molécules polaires organiques comme la caféine (moment dipolaire proche de 3,7 D). O | / N TT re o7 N A Y N G CI Bleu de méthylène (BM ; CI°) Caféine Page 20 /30 Chimie 2019 Filière PC Cette complexation modifie légèrement les propriétés des deux constituants, en particulier, l'absorption UV-visible du colorant. On se propose de déterminer par spectrophotométrie UV-Visible la valeur de la constante de complexation K entre la caféine (L) et le bleu de méthylène (BM°). On supposera la formation d'un seul complexe de formule BML* modélisée par la réaction de complexation d'équation : BM'+L=-BML où K est la constante de complexation 40- Rappeler le type de transition énergétique générée par l'absorption de lumière UV- visible et expliquer à partir de la structure des molécules pourquoi le bleu de méthylène est coloré en solution tandis que la caféine ne l'est pas. Une série de mesures a êté effectuée à partir des solutions numérotées 1 à 7 préparées par mélange des volumes Vi, V;, et V; respectivement de trois solutions de référence (bleu de méthylène, caféine et tampon phosphate). Ces mélanges sont réalisés dans des fioles jaugées de 50 mL, puis leur volume est complété à 50 mL avec de l'eau distillée. Les spectres des sept solutions ont été alors enregistrés entre 550 et 750 nm (cuves en verre, © = 1cm, blanc : eau distillée). Solution 1 2 3 4 5 6 Volume V, (en mL) de la solution de bleu de / \ _3 _] 1 1 1 Î Î 1 méthylène Crespm+ = 1,0.107 mol.L Volume V, (en mL, de la solution ; ; 0 1 2 5 10 20 40 de caféine c = 5,0.10° mol.L Volume V; (en ml) de la solution tampon _] 5 5 5 5 5 5 phosphate (pH = 6,6) ; Crampon = 0,1 mol.L Pour simplifier, seuls les spectres d'absorption des solutions 1, 3 et 7 sont présentés ci-après : -- V = 40 mL Lure V = 0 mL --- V = 2 mL Absorbance 250 600 650 700 750 Longueur d'onde À (nm) Page 21 /30 Chimie 2019 Filière PC 41- Définir l'absorbance A et rappeler la loi de Lambert-Beer ainsi que son domaine de validité. 42- À partir de la structure de la caféine, quel site peut raisonnablement se complexer au bleu de méthylène ? Justifier la réponse. 43- Comment se manifeste la complexation sur le spectre d'absorption ? Quelle hypothèse concernant la force de l'interaction entre le bleu de méthylène et la caféine peut-on avancer ? 44- Quelle longueur d'onde de travail 1- faut-1l alors choisir pour étudier la complexation ? À la longueur d'onde Àr, le bleu de méthylène (BM°) et le complexe (BML') absorbent la lumière (la caféine L absorbe uniquement dans l'UV). Juste après mélange, on note cz la concentration initiale en ligand (L) et cgm+ la concentration initiale en bleu de méthylène (BM°), avant complexation. On considère que dans les expériences la concentration en caféine libre est toujours très supérieure à celle de la caféine complexée et peut donc être considérée comme constante. On note Epm+ et Egmi+ les coefficients d'extinction molaire de l'indicateur coloré et du complexe à la longueur d'onde À7 et c° la concentration de référence égale à 1 mol.L'. Enfin À désigne l'absorbance des solutions à Àr avec À l'absorbance pour une concentration en cafëine nulle (solution n°1 dans le tableau suivant). Solution 1 2 3 4 5 6 7 Volume V; (en mL) de la solution de caféine 0 l 2 5 10 20 40 (ce = 5,0.10* mol.L'") Absorbance 0,2593 0,3596 0,4531 0,5532 0,7109 0,7910 0,8419 45- Exprimer les concentrations à l'équilibre [BM°] et [BML'] en fonction de K, c°, cr et CBM+ 46- Etablir la relation: 1 1 + 1 A -- À) : (Egmi+ -- Egm+)lCem+ KC; Le tracé de 1/(4 -- À) en fonction de 1/C; conduit à une droite d'équation (R étant le coefficient de corrélation): 1 -- 8,59.10-3x -- +1,45 avec R = 0,99667 L _ 410 47- Déterminer la valeur de la constante de formation K du complexe. Le résultat trouvé confirme-t-1l l'hypothèse émise sur la force de l'interaction entre le bleu de méthylène et la caféine ? Page 22 /30 Chimie 2019 Filière PC Extraction de la caféine du thé vert. Depuis la mise en oeuvre de la directive REACH (visant à assurer un niveau élevé de protection de la santé humaine et de l'environnement contre les risques que peut poser l'utilisation des solvants organiques chimiques), l'utilisation du CO; supercritique a été introduite comme alternative fiable aux procédés d'extraction par solvants organiques. À l'aide des documents en annexe ci-après, l'objectif est de déterminer les conditions expérimentales optimales pour extraire sélectivement la caféine présente dans la variété de thé vert choisie à l'aide du CO; supercritique. 48- Justifier le choix du CO; supercritique par rapport aux solvants classiques (eau, éthanol, chloroforme, ...) 49- Justifier la détermination des conditions expérimentales optimales utilisées pour extraire sélectivement la caféine du thé vert et préserver la teneur en catéchine EGCG dans le thé vert. 50- Expliquer l'influence de l'ajout d'eau lors de l'extraction au CO, supercritique. 51- Evaluer les quantités de caféine et d'épigallocatéchine-3-gallate (EGCG) obtenues lors de l'extraction CO; supercritique dans les conditions expérimentales optimales. ANNEXE Document n°1 -- Présentation d'une variété de thé vert Le thé vert est issu d'une variété de plante Camelia Sinensis dont l'oxydation des feuilles est immédiatement interrompue après la cueillette. Il en résulte une teneur importante en catéchines mais également en caféine. + Les catéchines : ingrédient précieux du thé vert - Responsable de l'amertume et de l'astringence du thé vert, les catéchines possèdent des effets bénéfiques pour l'organisme (propriétés antioxydantes, anti-inflammatoires, ...) en synergie avec les autres constituants du thé vert. Bien que la plupart des recherches scientifiques se focalisent sur l'épigallocatéchine-3-gallate (EGCG), catéchine principale du thé vert, d'autres sont présentes dans le thé en proportions moindres). ° La caféine - Le thé vert contient également de la caféine dont la teneur varie en fonction de la variété choisie. Cette espèce chimique peut être à l'origine d'effets indésirables ou de symptômes en cas de forte consommation (nervosité, agitation, insomnie, ...). Page 23 /30 Chimie 2019 Filière PC Espèces chimiques étudiées Caféine EGCG Moment dipolaire (D) 3,6 Non connu Structure Ô O | J N Y Lo OH OH Teneur dans la variété de thé vert étudié (mg/g de thé) 32,9 122,8 Ainsi 1l semble très important d'extraire sélectivement la caféine du thé vert tout en conservant les catéchines afin d'obtenir une production plus saine. Document n°2 -- Quelques caractéristiques du dioxyde de carbone CO; Etats physiques et propriétés - Le dioxyde de carbone CO; est une molécule qui ne présente pas de moment dipolaire. P (bar), Diagramme de phases du CO, Solide | Liquide A 1 EUR Fluide supercritique T(°C) Le diagramme de phase (ci-dessus) indique les différents états physiques : solide, liquide, gaz et supercritique dont les domaines d'existence dépendent de la pression P et de la température T imposées. Page 24 /30 Chimie 2019 Filière PC Etat physique Masse volumique (kg.L'") Viscosité (uPa.s) Diffusivité (em".s ") Gaz 0,0006 -- 0,002 10 - 30 0,1 -- 0,4 Fluide supercritique 0,2 -- 0,5 10 - 30 0,0001 -- 0,1 Liquide 0,6 -- 1,6 200 - 3000 0,00002 -- 0,0002 La diffusivité mesure la capacité d'une espèce chimique à se déplacer dans un milieu donné où 1l existe un gradient de concentration de cette espèce. Le CO; supercritique et l'extraction végétale - Le CO; supercritique est très rapidement apparu comme un candidat particulièrement approprié à l'extraction végétale, et ce notamment comme alternative aux solvants organiques chlorés. Non toxique, non polluant, non inflammable, largement disponible à de très hauts degrés de pureté (jusqu'à 99,99999 %) et à des coûts modérés (de l'ordre de 1 euros/kg), ce solvant vert possède des paramètres critiques accessibles. Les procédés supercritiques s'acquittent des opérations d'élimination des résidus de solvant (extraction, imprégnation, formulation), opérations indispensables lorsque ce solvant est un composé organique (chloroforme, dichlorométhane...). De plus, les faibles températures mises en oeuvre (en général de l'ordre de 40 à 60°C) permettent de conserver l'intégrité chimique des molécules thermosensibles traitées et de minimiser les coûts opératoires. Capacité de solvatation CO); supercritique - Dans une phase supercritique, les molécules ne sont pas uniformément distribuées. Les agrégats formés autour des molécules de soluté montrent que la densité locale est élevée avec une solvatation relative. En influant sur les conditions de température et de pression, on parvient à adapter le pouvoir solvant ou la capacité de solvatation du fluide supercritique en fonction de l'opération envisagée. CO, solide CO, liquide CO, état supercritique CO, gaz CXXXXXIS,Q @ D co, RTE 2e O 9 "a 22000000 @ @ » . @ Souté (2 , C) Q XL IIOO © Densité, pouvoir solvant si - Diffusivité Page 25 /30 Chimie 2019 Filière PC Le pouvoir solvant à géométrie variable du fluide supercritique peut être mis à profit en faisant varier la pression et la température des conditions opératoires. Ainsi : ° une augmentation de la pression influence le pouvoir solvant du fluide par accroissement de sa densité ; ° une augmentation de la température à pression élevée permet à la fois d'augmenter la pression de vapeur saturante de la substance et de diminuer les interactions soluté- soluté. Document n°3 - Utilisation des paramètres de solubilité Ô dans le cadre de l'extraction sélective de la caféine par CO; supercritique C'est Joël Hildebrand, chimiste américain (1881 - 1983), qui a introduit le premier le paramètre de solubilité Ô dans le but de prévoir la solubilité entre un soluté et un solvant. Sa théorie, initialement basée sur les lois de la thermodynamique, permet donc de déterminer le bon solvant pour un soluté donné. Bonne solubilité si Ô (solvant) = à (soluté) D'autres scientifiques (Crowley ou encore Hansen) ont contribué à améliorer le système créé par Hildebrand. e-- --e-- EGCG ----e - *- Caféine 15 ++: CO; (400 bar + 7 % eau) --8- CO, (200 bar + 7 % eau) ( --#-- CO, (300 bar + 7 % eau) ( --+-- CO, (100 bar + 7 % eau) 10 Ô paramètre de solubilité 20 30 40 50 60 70 80 Température (°C) Figure 2 - Evolution des paramètres de solubilité Ô de la caféine, de la catéchine (EGCG) et du mélange (CO) supercritique + teneur massique de 7 % eau) en fonction la température et de la pression. Page 26 /30 Ô paramètre de solubilité Figure 3 - Evolution des paramètres de solubilité Ô de la caféine, de la catéchine (EGCG) et du CO; supercritique en fonction de la température et de la teneur massique en eau à une Chimie 2019 Filière PC 15 | 10 40 50 60 Température (°C) pression de 200 bar. Document n°4 - Effets de la pression, de la température et de la teneur en eau lors de --E-- _-- @- EGCG Caféine "+ CO, + 7 eau --#-- CO, + 5.7 % eau --8-- CO, + 4 % eau ---- CO; l'extraction sélective de la caféine par le CO; supercritique Rendement d'extraction Figure 4 - Evolution du rendement d'extraction de la caféine et de la catéchine (EGCG) en fonction de la température (pression fixe de 400 bar, teneur massique en eau de 7 %, débit de 60 OÙ 40 30 20 --e-- Caféine -e- EGCG 50 60 70 Température (°C) 40 80 CO2 fixe de 26,08 kg de CO;/kg de thé/h et période d'extraction fixe de 5 h). Page 27 /30 Chimie 2019 Filière PC 60 --+-- Caféine ci -e- EGCG .Q © Ë 40 Dé 2 T E D S 20 D D A D m (0 LE =} 4 45 5 9,9 6 695 7 Teneur massique en eau Figure 5 - Evolution du rendement d'extraction de la caféine et de la catéchine (EGCG) en fonction de teneur massique en eau (température fixe de 50 C, pression fixe de 400 bar, débit de CO; fixe de 28,08 kg de CO;/kg de thé/h et période d'extraction fixe de 5 h). 60 --e-- Caféine » -e- EGCG .Q © S 40 & 2 TD E D S 20 D TD Q D Ce ( : 200 250 300 30 400 Pression (bar) Figure 6 - Evolution du rendement d'extraction de la caféine et de la catéchine (EGCG) en fonction de la pression (température fixe de 50°C, teneur massique en eau de 7 %, débit de CO2 fixe de 26,08 kg de CO:/kg de thé/h et période d'extraction fixe de 5 h). Page 28 /30 Chimie 2019 Filière PC Document n°5 - Extraction de la caféine à l'aide de solvants classiques Des extractions classiques ont été réalisées en utilisant de l'eau ou de l'éthanol afin de pourvoir comparer les résultats avec ceux obtenus lors d'une extraction au CO; supercritique dans les conditions optimales. La caféine et l'épigallocatéchine-3-gallate (EGCG) ont été extraites en utilisant 30 g de thé vert moulu dans un ballon à fond rond contenant 600 mL d'eau ou d'éthanol. L'extraction a été menée à une température constante (40 ou 50°C) pendant 5h sous agitation. Rendement d'extraction Température (°C) Solvant (pression) Sélectivité Caféine EGCG Eau (1 bar) 81 92 81/92 = 0,88 40 Ethanol (1 bar) 15 63 15/63 = 0,24 Eau (1 bar) 83 92 83/92 = 0,90 50 Ethanol (1 bar) 21 54 21/54 = 0,39 Page 29 /30 Chimie 2019 Filière PC Données: Constante d'Avogadro : Na= 6,0.107 mol" Constante des gaz parfaits :R= 8,3 J.K''.mol" RT Constante de Nernst à 298 K : m0 = 0,06V Constante de Faraday : 96500 C.mol ! Produit ionique de l'eau à 298 K: K. = 10°" Masse molaire de la caféine M = 194 g.mol" Approximations numériques : 2 = T V3 = - V5 = 2 Fin de l'épreuve Page 30 /30
