Mines Chimie PC 2017
| Thème de l'épreuve | L'I.T.O. Synthèse du tétrahydrogestrinone (THG). |
| Principaux outils utilisés | cristallographie, diagrammes E-pH, thermodynamique, courbes courant-potentiel, chimie organique |
| Mots clefs | I.T.O., ITO, tétrahydrogestrinone, THG, lixiviation, extraction |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)

















Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
A2017 CHIMIE PC
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT Atlantique (ex Télécom Bretagne),
ENSAE PARISTECH.
Concours Centrale-Supelec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVP.
CONCOURS 2017
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 4 heures
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - PC
L'énoncé de cette épreuve comporte 19 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
A 2017 Chimie PC
DEBUT DE L'ENONCE
Des données utiles à la résolution du problème sont fournies à la fin de
l'énoncé.
Cette épreuve est constituée de deux parties indépendantes.
l'I.T.O.
L'indium est le 49ème élément de la classification périodique des éléments,
découvert en
1863 par F. Reich et H.T. Richter. Sa production a progressivement augmenté
tout au long
du 20ème siècle. De nos jours, la demande en indium est très forte en raison de
son
utilisation massive pour l'élaboration de couches minces d'I.T.O. (Indium Tin
Oxide, oxyde
d'indium dopé à l'étain) qui assurent la fonction d'électrode transparente dans
des
dispositifs tels que les écrans LCD.
L'I.T.O. est typiquement composé de 90% en masse d'oxyde d'indium In2O3 et 10%
d'oxyde
d'étain SnO2.
Ce sujet se propose d'aborder la chimie de l'indium et des I.T.O. ainsi que
l'aspect essentiel
du recyclage des déchets électroniques, sachant que les ressources primaires en
indium
seront selon plusieurs estimations épuisées d'ici 50 ans.
A- Structure
1En expliquant la démarche, donner les numéros des période et colonne de la
classification périodique auxquelles appartient l'élément indium.
2-
Déterminer la teneur massique en indium dans l'I.T.O. .
3Déterminer la coordinence des atomes d'oxygène dans la structure représentée
dans le
Document n°1 donné à la fin de cette partie.
4Déterminer le nombre d'atomes d'oxygène présents dans la maille complète. En
déduire la population en indium dans cette même maille.
5-
Calculer la distance entre un atome d'oxygène et un atome d'indium.
6Les rayons ioniques de l'indium et de l'oxygène valent respectivement 80 pm et
140
pm. Qu'en concluez-vous ?
Page 1/19
Chimie 2017 Filière PC
document n°1: structure de l'oxyde d'indium. Seul un huitième de la maille
cubique est
représenté par souci de lisibilité. Les atomes d'indium occupent les centres
des faces et les
sommets du cube, les atomes d'oxygène occupent les sites tétraédriques en en
laissant 1/4
vacant. La structure de l'I.T.O. découle de celle-ci en substituant des atomes
d'indium par des
atomes d'étain.
B- Lixiviat de "e-déchets".
Le traitement des e-déchets est une source potentielle importante d'indium.
Après un
démontage manuel, les écrans LCD sont séparés puis broyés. Des procédés de
séparation
(aimants, séparateurs à hautes capacité, tamis) permettent d'obtenir diverses
fractions qui
sont recyclées séparément. Pour les métaux, le procédé hydrométallurgique est
le plus
étudié et repose sur la lixiviation acide des matériaux solides.
Page 2/19
Chimie 2016 Filière PC
!
!"#$%&'()*)+!"#$%&$''(!)*+(,+#(-.)/!0#')-#1#2!3(!-4#,3#5'!+&$62!)*5&!5,(!6*,6(,+&$+#*,!(,!(0)76(!
3#00*5+(!3(!89.:!'*-;<.8;! ./0" '()" !(*" !"%*&+,() !(+" !"#$%&'() !('" ,!()"" ,!(-"" !"&'() ,'('"" 12" ,'(+"" &" !" '!" #" $" %" ! =,!)*#,+#--20!!0*,+!&()&20(,+2(0!-(0!3&*#+(0!3(0!6*5)-(0!3(!-4($5!>/?@/:!(+!A:@/:AB!
!
'#"
'$" !
7Rappeler la valeur de la pente des courbes en pointillés. Déterminer la pente
de la
frontière entre les espèces In2O3(s) et In(s) et vérifier la cohérence avec le
diagramme.
8-
Discuter de la stabilité de l'indium métallique dans l'eau en fonction du pH.
9Ecrire l'équation (1) de la réaction qui se produit quand l'oxyde d'indium est
en
milieu acide. On normalisera l'écriture de l'équation en considérant 1 (seul)
atome d'indium
impliqué.
10Calculer la constante d'équilibre thermodynamique (à 298 K) de la réaction
(1) à
l'aide du diagramme.
11En utilisant les données, montrer qu'on peut séparer l'indium et l'étain au
degré
d'oxydation +IV lors de la lixiviation de l'I.T.O.. Choisiriez-vous plutôt
l'acide chlorhydrique
ou l'acide sulfurique (justifier) ?
12Montrer à l'aide des données que la lixiviation n'est pas sélective si
l'étain est réduit au
degré d'oxydation +II.
Page 3/19
Chimie 2017 Filière PC
C- Extraction par solvant
Comme la matière première est rarement de l'I.T.O. pur mais contient d'autres
parties des
écrans LCD, et qu'en outre l'étain de l'I.T.O. est partiellement réduit, les
solutions obtenues
après lixiviation contiennent de nombreux éléments métalliques autres que
l'indium (Zn, Fe,
Pb, Cu, As, Sb, Sn, Tl, Ga, ...). Ces lixiviats peuvent subir divers
traitements mais les voies
actuelles privilégient l'utilisation de techniques d'extraction par solvant qui
sont adaptées
aux solutions diluées et qui permettent une meilleure sélectivité. Nous
reprenons ici une étude
tirée de la publication de J.Yang et al.,!International Journal of Chemical
Engineering, 2014,
Article ID 186768.
Pour simplifier les écritures , pour une espèce M, on notera ! la concentration
molaire
volumique en M dans la phase aqueuse et ! la concentration molaire volumique en
M dans
la phase organique. Au contact d'une solution organique de D2EHPA (extractant
noté H2A)
dans le kérosène (non miscible à l'eau), les espèces métalliques dissoutes en
solution aqueuse
sont susceptibles d'être transférées de la phase aqueuse vers la phase
organique ou vice
versa. On peut quantifier ce transfert par le rapport noté D entre la quantité
totale de M en
phase organique et celle en phase aqueuse. Nous considérerons dans la suite des
volumes
identiques de phase aqueuse et de phase organique (rapport =1), ce qui permet
d'écrire D
= !/!.
La réaction notée (2) qui a lieu lors du contact entre la solution organique et
la solution
aqueuse contenant l'indium acidifiée par de l'acide sulfurique peut s'écrire:
In3+(aq) + 3 H2A(org) ! In(HA)3(org) + 3H +(aq)
(2)
A 300 K : rH°2 = - 29 !"#$%&'( et rS°2 = - 49 J.K-1.mol-1.
13-
Qualifier la réaction (2) pour l'indium concernant son effet thermique.
14Calculer l'enthalpie libre standard rG°2 à 300 K de la réaction (2).
Commenter la
valeur obtenue.
Nous envisageons à présent le cas de solutions d'acide chlorhydrique plutôt que
sulfurique.
15En détaillant le raisonnement, affecter aux différents domaines du diagramme
suivant
les espèces en solution aqueuse: In3+, In(OH)2+, In(OH)2+, In(OH)3, In(OH)4 ,
In(OH)Cl+,
InCl2+, InCl2+ et InCl3.
Page 4/19
Chimie 2016 Filière PC
!"
'"
#"
$"
%"
("
)"
*"
"
&"
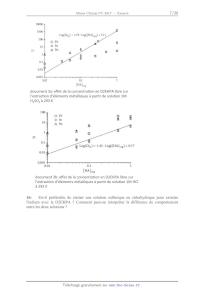
On donne dans les figures suivantes (document 3) l'évolution du coefficient D
en fonction de
la concentration en extractant dans le cas de solutions d'acide sulfurique et
d'acide
chlorhydrique.
Page 5/19
Chimie 2017 Filière PC
!"#$%&'()*+,)&-&()!&).+)#"'#&'(/+0"')&')123456).78/&)9$/)
.:&;(/+#0"')!:<.<%&'(9)%<(+..7=$&9)>)?+/0/)!&)9".$0"')@A)
42BCD)>)2E*)F)
!"#$%&'()*+,)&-&()!&)./)#"'#&'(0/1"')&')234567).8+0&)9$0)
.:&;(0/#1"')!:<.<%&'(9)%<(/..8=$&9)>)?/010)!&)9".$1"')@A)5B.)
>)3C*)D)
16Est-il préférable de choisir une solution sulfurique ou chlorhydrique pour
extraire
l'indium avec la D2EHPA ? Comment peut-on interpréter la différence de
comportement
entre les deux solutions ?
Page 6/19
Chimie 2016 Filière PC
Une étude cinétique de l'extraction par la D2EHPA d'une solution d'indium
acidifiée à
l'acide sulfurique, contenant aussi du fer et de l'étain, a donné le résultat
suivant.
!"#$%&'()*+)#,'-./$&)!0&1(23#."')!&4)%-(3$1)&')$.5,43'()
$'&)4"5$."')6789):;<=*)&()6789)>;?:@A)!3'4)5&)B-2"4C'&)
17Que concluez-vous de cette étude quant à la sélectivité de l'extraction de
l'indium visà-vis du fer et de l'étain ?
Une autre étude cinétique a été menée sur l'opération inverse ("back
extraction" ou
stripping), consistant à traiter la solution de D2EHPA chargée par une solution
d'acide
chlorhydrique. Le coefficient D se réfère donc dans ce cas au transfert vers la
phase aqueuse
chlorhydrique.
!"#$%&'()*+)#,'-./$&)!&)0)12#34&5(62#."')7)826)$'&)9":$."');<=>)
?@:)!&):2)9":$."')#A26B-&);<=>)CDE?FG)!2'9):&)3-6"9H'&)
18-
Que concluez-vous de cette étude quant à la sélectivité de la "back extraction"
?
Page 7/19
Chimie 2017 Filière PC
19A partir des résultats et données relatives aux parties B et C, proposer un
procédé
d'extraction sélective de l'indium à partir d'I.T.O. .
D-Récupération de l'indium métallique
La solution d'indium récupérée après plusieurs extractions contient 95,7 % en
masse
d'indium, les autres métaux étant essentiellement du fer et du cuivre. Elle
peut alors être
traitée en vue de récupérer l'indium métallique. Une première électrolyse
permet d'obtenir le
métal avec une pureté de l'ordre de 95 %. Une étape d'électro-raffinage est
alors nécessaire
pour atteindre une pureté en indium proche de 99,99%.
L'anode est constituée d'indium impur, la cathode est en titane et l'écartement
entre les deux
électrodes est de l'ordre de 25 à 30 mm. Un panier anodique permet de récupérer
les boues
formées par les impuretés, il est constitué d'une toile en polypropylène dont
les pores sont de
2µm. On évite ainsi la dissémination de ces boues dans l'électrolyte.
L'électrolyte est
constitué par une solution aqueuse de chlorure de sodium à 100g.L-1 dont le pH
est ajusté à 2
par ajout d'acide chlorhydrique.
Dans la suite, on considèrera pour simplifier que les seules impuretés
présentes avec
l'indium sont le cuivre et le fer.
!
!"
"#$%&'()!*!+!"#$%&'(!"#$%)*+,-#+'*+.'/!
!
!"#
0#$%&'(!"#$%)*+,-#+'*+.'/!
1'*!#%2#**3'!2'*(.+3!2'!"#$%)*+4!'*!)&(".(('!-#+'*+.'/!2'!/53/'"+%#2'!2'!+%)6)./7!
8)!23(.9*'!/'!-#+'*+.'/!)$:$'/!'(+!-#%+3!/5)*#2'!'+!8"4!"'/$.!2'!/)!")+;#2'!
!
!
!
20-
Evaluer la surtension cathodique c du couple H+/H2(g) sur l'électrode de titane.
Page 8/19
Chimie 2016 Filière PC
21Quel(s) phénomène(s) cause(nt) la différence d'allure des branches anodique et
cathodique pour l'indium (présence ou non d'un palier) ?
22Compte tenu de la composition de l'anode et de la valeur du potentiel imposé,
indiquer les réactions envisageables à cette électrode.
23-
On constate un léger dégagement gazeux à la cathode, identifier le gaz dégagé.
24Indiquer, en justifiant, sous quelle(s) forme(s) le cuivre et le fer,
présents initialement
avec l'indium, sont récupérés.
E-Procédé pyrométallurgique.
Les figures suivantes sont extraites de l'article de S.Itoh et K.Maruyama, High
Temp. Mater.
Proc., Vol. 30 (2011), pp. 317322. Sur le document 7, le %CO se réfère à un
mélange
CO/CO2.
5,"11211&%&'()!&)-.)
E"'&)0"2'(8&)0.,)-.)
F6#7&)
!"#$%&'()*+),&-./"')&'(,&)-.)0,&112"')0.,/&--&)&')
!2"3456'&)&()-.)#"%0"12/"')!&)-.)07.1&)#"'!&'18&)9)
::*;)<=)>?')&()>@?')#",,&10"'!&'(),&10&#/A&%&'()9)-.)
B,.#/"')%"-.2,&)!.'1)-@.--2.5&)%8(.--2C$&)&()!.'1)-.)
07.1&)"34!&D)
Page 9/19
!"#$%&'()#**+,-.(/#0&"+*1.(
Chimie 2017 Filière PC
!"#$%&'() *+) ,-&../"'.) !&) 01,&$-) !&)
2&$-).'3(45(!"#$%&'()#**+,-.(/#0&"+*1.(.'(!&'$%&'(
23/'!/$%) &() !&) 234(1/') ,"$-) !&.)
2-(3.)0*(0&-"(2.*(3.)01"#3-".*(.'3".(6789(:(.3(
6;69(:<(=$>#'%??&'5(#??+#@.(A'BC'("12-+3(0#"(DE(F(
122/15&.)6'78')
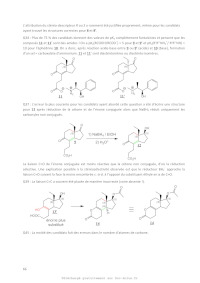
0#"%"(2GAHE<( 25A partir de ces documents, proposer un procédé pyrométallurgique de récupération d'indium à partir d'I.T.O. en indiquant les réactions impliquées et leurs conditions expérimentales. Synthèse du tétrahydrogestrinone (THG) Le tétrahydrogestrinone (THG) est un stéroïde anabolisant de synthèse, qui a été la molécule vedette d'un scandale de dopage qui toucha le sport américain, mettant en cause un grand nombre d'athlètes mondialement célèbres, et aboutissant à l'incarcération pour 6 mois et au retrait des 5 médailles olympiques et de 2 titres mondiaux de la sprinteuse Marion Jones. Le terme stéroïde est utilisé depuis 1936 pour décrire les molécules qui possèdent une structure de type perhydrocyclopentaphénanthrénique : 17 13 C A B Page 10/19 D Chimie 2016 Filière PC La dénomination A, B, C et D des 4 cycles du squelette stéroïdien ainsi que la numérotation des 17 atomes de carbone de ce squelette sont universelles. Certaines questions feront référence aux atomes de carbone 13 et 17 de ce squelette. La molécule de THG est représentée ci-dessous. Bien que l'atome de carbone 13 du squelette stéroïdien du THG ait une configuration absolue bien définie, la stéréochimie de ce centre asymétrique n'est ici pas précisée. HO O Préambule : annélation de Robinson L'annélation de Robinson est une méthode très efficace de construction des cycles à 6 atomes de carbone. Il n'est dès lors pas surprenant que ce procédé ait été largement employé pour la synthèse de stéroïdes. On s'intéresse à la réaction suivante : Le composé 1, de formule C5H8O, présente une bande intense à 1745 cm-1 en spectroscopie IR et son spectre RMN présente les caractéristiques suivantes: 26- A l'aide des informations obtenues par RMN et IR, donner la structure de 1. Page 11/19 Chimie 2017 Filière PC 27A l'aide de l'écriture de 2 formules mésomères, mettre en évidence les 2 sites électrophiles de la but-3-én-2-one. On étudie tout d'abord la réactivité de la but-3-èn-2-one vis-à-vis d'une addition nucléophile. On adoptera la numérotation suivante pour les atomes de cette molécule. 1O 4 5 2 5 3 On donne ci-dessous les orbitales HO et BV obtenues selon un calcul de Hückel simple sur le système de la but-3-èn-2-one. Les coefficients Cij correspondent à l'orbitale atomique 2p centrée sur l'atome j dans l'orbitale moléculaire i . On rappelle que <0. OM i 3 4 Coefficients Cij Ci1 Ci2 Ci3 Ci4 Ci5 + 1,000 0,58 0,00 -0,58 -0,58 0,00 - 0,413 0,39 -0,55 -0,27 0,67 0,16 Ei 28Par laquelle de ces 2 orbitales frontalières la but-3-én-2-one réagira-t-elle lors de la réaction d'un ion énolate sur cette molécule ? Quel sera alors le site d'attaque privilégié lors d'une addition nucléophile, supposée sous contrôle exclusivement orbitalaire, sur la but-3-èn2-one ? 29En utilisant les résultats précédents, déterminer la formule de la di-cétone 3. Ecrire le mécanisme complet de sa formation à partir de 1 et de la but-3-èn-2-one. A basse température en milieu basique dans l'éthanol, le composé 3 se cyclise en 4 , qui chauffé (toujours en présence de base) aboutit au produit 5. 30- Représenter la structure de 4 et donner le mécanisme de sa formation. 31- Ecrire le mécanisme de la formation de la molécule 5. Application de l'annélation de Robinson à la synthèse du THG. La synthèse du THG débute par une annélation de Robinson entre les composés 6 et 7, permettant la formation du cycle C. On obtient un mélange racémique, le descripteur stéréochimique du carbone n°13 (cf introduction du sujet) pouvant être S (composé 8) ou R (composé 8'). Page 12/19 Chimie 2016 Filière PC O Et CO2Me O annelation de Robinson + mélange racémique 8 + 8' 7 6 O On donne les pKa suivants: 32Donner les structures des produits 8 et 8' , en justifiant le descripteur stéréochimique de chacun. Formation des cycles A et B du THG. Une saponification permet d'obtenir, après acidification, les composés 9 et 9' en mélange racémique. Ce mélange est mis à réagir avec la (-)-éphédrine 10 pour donner les composés 11 et 11'. L'opération effectuée est qualifiée de salification. Après une cristallisation fractionnée, on isole le composé 11 qui est aisément transformé en composé 9 (descripteur stéréochimique S pour le carbone n°13). OH H N 10 1) saponification 8 + 8' 9 + 9' 11 + 11' 2) acidification 11 + 11' cristallisation fractionnée 9 11 9 33- Donner la structure des composés 9 et 9'. 34Donner l'ordre de grandeur du pKa attendu pour 9 et 9' d'une part, et pour l'éphédrine d'autre part. Pourquoi parle-t-on de "salification" pour la réaction entre la (-)-éphédrine et Page 13/19 Chimie 2017 Filière PC l'un ou l'autre des énantiomères 9 et 9' ? Représenter les composés correspondants 11 et 11' , par quelle relation de stéréochimie sont-ils reliés ? 35Expliquer les difficultés pour séparer deux énantiomères et le principe utilisé ici pour y parvenir. 36- Comment le composé 9 est-il régénéré à partir de 11 ? La synthèse se poursuit selon le schéma suivant : 1) 2) hydrolyse acide 37L'atome de carbone n°17 a dans le composé 12 une configuration bien définie, induite par l'atome de carbone n°13 qui joue le rôle de centre d'induction asymétrique. Représenter le composé 12, en justifiant le fait que l'atome de carbone n°17 prenne une configuration particulière que l'on représentera, sans toutefois déterminer la nature R ou S du descripteur stéréochimique de cet atome de carbone. Le composé 12 obtenu subit une hydrogénation catalytique dans des conditions de pression relativement douces. 38- Donner la structure du composé 13 obtenu. La réaction du composé 13 avec l'anhydride acétique permet la protection de la fonction alcool de 13 en un ester. En outre, dans ces conditions (on considérera le milieu comme acide et anhydre), on assiste à une cyclisation spontanée par réaction entre l'acide carboxylique de 13 et la forme énol de la cétone, aboutissant à une lactone (ester cyclique). 39- En suivant les indications de l'énoncé, proposer une structure pour le composé 14. Le composé 14 est mis à réagir avec l'organomagnésien 15. O MgBr O 15 Ce composé 15 est préparé à partir de la 5-bromopentan-2-one par acétalisation puis synthèse magnésienne. Page 14/19 Chimie 2016 Filière PC 40Décrire en environ une page des conditions expérimentales pour transformer 28g de 5-bromopentan-2-one en acétal. On détaillera notamment le dispositif expérimental à mettre en oeuvre à l'aide d'un schéma et on justifiera les choix du solvant, des réactifs à utiliser et de leur quantité, de la température de travail. Expliquer comment garantir la conversion complète du réactif. On utilisera les données suivantes: Produits 5-bromopentan2-one éthane-1,2-diol APTS HCl 5 mol/L eau cyclohexane toluène dichlorométhane M (g/mol) densité 165 1,36 62 172 1,11 18 84 92 85 1,19 1 0,78 0,87 1,33 fusion /°C vap/°C 191 -13 103 -30 0 6 -95 -95 197 48 100 81 111 40 température et composition (pourcentage massique en eau) de différents hétéroazéotropes: cyclohexane: 70°C , 9% ; toluène: 85°C, 20% ; dichlorométhane: 38°C, 1% 41Donner le mécanisme de l'acétalisation de l'acétone par l'éthane-1,2-diol en milieu acide. 42Quelle différence notable observera-t-on entre le spectre IR de la 5-bromopentan-2one et celui du produit obtenu après acétalisation ? Le produit obtenu est caractérisé par ses spectres infra-rouge et RMN 1H. Ce dernier fait apparaître un multiplet vers 3,89 ppm, un triplet à 3,15 ppm (2H), un multiplet à 1,88 ppm (2H), un triplet à 1,5 ppm (2H) et un singulet à 1,27 ppm (3H). 43Attribuer à l'aide des déplacements chimiques et des intégrations les signaux aux atomes d'hydrogène du produit final. Justifier ensuite les multiplicités observées pour les triplets et le singulet. 44Donner brièvement les conditions opératoires à respecter pour une synthèse magnésienne. L'addition de l'organomagnésien 15 sur le composé 14 s'effectue dans des conditions particulières : dans ces conditions, seule la lactone est attaquée et on arrive à contrôler la réaction afin de s'arrêter à la cétone qui est impliquée dans la formation du cycle B. On obtient alors le composé 16. Aucune explication n'est demandée sur le passage du composé 14 au composé 16. La notation OAc représente ici la fonction acétate. Page 15/19 Chimie 2017 Filière PC OAc O 1) 15 14 2) hydrolyse et cyclisation spontanée 16 O 45Donner la structure du produit formé par réaction entre l'organomagnésien 15 (2 équivalents) et la lactone 17 représentée ci-dessous, avant hydrolyse acide et dans les conditions usuelles ne permettant pas de s'arrêter à la cétone. O O 46- 17 Que devient ce produit après hydrolyse acide ? Le composé 16 est aisément transformé en composé 19 via l'intermédiaire 18. OAc 19 O 47- Représenter l'intermédiaire 18 . Fin de la synthèse du THG. Une série de réactions permet d'aboutir à partir du composé 19 au composé 20 dont la fonction cétone conjuguée est protégée par une fonction oxime par action de l'hydroxylamine H2NOH en présence d'un catalyseur acide, selon le schéma suivant : Page 16/19 Chimie 2016 Filière PC OH OH 1) H2N-OH cat H+ (- H2O) 20 2) milieu basique O 21 HO N 48Proposer alors une voie de synthèse du THG à partir du composé 21, sans se soucier de la stéréochimie. Pourquoi était-il nécessaire de protéger la cétone conjuguée du composé 20 ? On précise qu'une simple hydrolyse acide permet de régénérer la cétone. Page 17/19 Chimie 2017 Filière PC Données: Numéros atomiques : !! ! ! ! , !! ! ! ! , !! ! ! ! , !"!!! ! !"! Constante d'Avogadro : NA= 6,0.1023 mol-1 Constante des gaz parfaits :R= 8,3 J.K-1.mol-1 RT Constante de Nernst à 298 K : ln10 = 0,06V F Constante de Faraday : 96500 C.mol-1 Produit ionique de l'eau à 298 K: Ke = 10-14 Masses molaires en g.mol-1 : In 115 Sn 119 O 16 Potentiels standard par rapport à l'électrode standard à hydrogène, à 25°C et pH = 0, en Volt: H+/H2(g) O2(g)/H2O In2O3(s)/In(s) Fe2+/Fe(s) 0 1,23 -0,19 -0,44 Cu2+/Cu(s) In3+/In(s) 0,34 -0,34 Equilibres chimiques à 298 K: SnO(s)+2H+aq = Sn2+ + H2O logKs,II = 2,1 SnO2(s)+3H+aq = Sn(OH)3+aq + H2O logKs,IV = -6,5 3+ 2+ Sn(OH) aq + Cl = Sn(OH)Cl logKc= 5,5 La complexation de l'étain au degré d'oxydation +IV par les espèces sulfates est trop faible pour être mesurée expérimentalement. Page 18/19 Chimie 2016 Filière PC Table de déplacements chimiques: Type de protons R-CH3 Alkyle R-CH2-R' RR'R''CH Alcènes (ppm) ~1 à 2 C=C-CHn (allylique) ~1.5 à 2 C=C-Hn ~5à7 Ph-CHn (benzylique) Aromatique Ph-H (aromatique) RO-CHn et Alcool et HO-CHn éther HO Type de protons I-CHn HalogénoBr-CHn alcane Cl-CHn -C(O)-CHn C=O ~ 2 à 2.5 ~7 ~3à4 Amine 0.5 à 10 (ppm) ~3 à 4 ~2 à 2.5 -C(O)H (aldéhyde) ~ 9.5 à 10 C(O)OH (acide carboxylique) ~10 à 13 RR'N-CHn ~3 à 4 R-NHn 1à5 2,5 f(x)=lnx 2 1,5 1 0,5 0 1 2 3 Approximations numériques : Fin de l'énoncé Fin de l'épreuve 4 !!!! 5 !" ! 6 ! !! ! ! ! ! Page 19/19 7 ! ! !!! 8 9 10
