Mines Chimie PC 2015
| Thème de l'épreuve | Chimie atmosphérique. Bétadine. Synthèse totale du (-)-FR182877. |
| Principaux outils utilisés | solutions aqueuses, cinétique chimique, oxydoréduction, diagrammes E-pH, chimie organique |
| Mots clefs | chimie atmosphérique, bétadine, FR1828277 |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - -
Énoncé complet
(télécharger le PDF)















Rapport du jury
(télécharger le PDF)




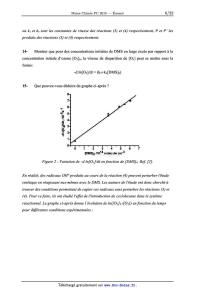
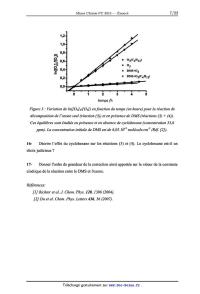
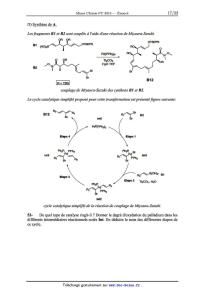
Énoncé obtenu par reconnaissance optique des caractères
A 2015 Chimie PC
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2015
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, Ecoles des Mines, TELECOM INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2015 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'e'n0nce' de cette épreuve, particulière aux candidats de la filière PC,
comporte 22 pages.
Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
Les candidats ne devront pas hésiter à formuler des commentaires succincts qui
leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
Le barème tiendra compte de la longueur de l'énoncé.
Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une erreur
d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/22 Tournez la page S.V.P.
Chimie 2015 Filière PC
DEBUT DE L'ENONCE
Des données utiles à la résolution du problème sont fournies à la fin de
l'énoncé.
Cette épreuve est constituée de trois parties indépendantes.
CHIMIE ATMOSPHERIQUE
La composition de l'atmosphère terrestre a changé de manière très significative
depuis l'ère
industrielle. Les conséquences sur la biosphère sont ressenties aujourd'hui
plus que jamais.
Ce changement est dû aux émissions de polluants principalement d'origine
anthropogénique.
Les polluants peuvent être regroupés en deux grandes classes : polluants
classiques (CO2,
CH4, HONO, H2O2, Composés Organiques Volatils, O3, ...) et des polluants non
classiques
(métaux lourds tels que Pb, Zn, Hg, Cd, ...). On s'intéresse ici à la structure
et à la réactivité
de quelques polluants atmosphériques tels que HONO, O3, ... Les réactions, les
réactifs et les
produits issus de ces réactions jouent un rôle très important dans
l'environnement. Ce sujet
traite de quelques réactions impliquant l'ozone. Ces réactions se produisent
dans la basse
atmosphère. Elles modifient les concentrations globales et locales de composés
chimiques
atmosphériques. La température est supposée constante dans ce milieu.
A) Structure
La molécule d'ozone (O3) possède deux isomères : l'un coudé, l'autre cyclique
dont
l'existence reste douteuse.
1-
Proposer une structure de Lewis pour chacun de ces isomères.
2En utilisant la méthode VSEPR, justifier la géométrie coudée du premier
isomère et
montrer que la structure cyclique est fortement déstabilisée.
3-
Proposer une structure de Lewis pour la molécule H2O2.
La molécule H2O2 n'est pas plane. Elle possède deux conformations : une
`droite' et une
`gauche'.
4Dessiner ces 2 conformations en représentation de Newman. Peut-on parler de
chiralité pour la molécule H2O2 ?
La molécule HONO possède deux conformères favorisés : le cis et le trans. Le
schéma
suivant définit les paramètres géométriques (hormis !) permettant de décrire la
molécule.
Page 2/22
Chimie 2015 Filière PC
Les distances R,- sont dans l'ordre O--N--O--H.' R; correspond a la distance ON
terminale, R; a
NO centrale, R3 à OH. De même 6; correspond à l'angle ONO et 62 a NOH.
5- Proposer une structure de Lewis pour chacun des conforméres (cis et trans) de
HONO.
Le tableau ci--après donne la géométrie d 'équilibre de chacune des formes.
R1 / pm R2 / pm R3 / pm 01 / degré 02 / degré 17/ degré
Trans 116,7 142,8 95,7 110,7 102,1 180
Cis 118,5 139,1 97,8 113,6 104,0 0
Tableau I : Géométries d 'équilibre des formes trans et cis de HONO. Ref. [ l ]
.
6- Comment l'angle de torsion r est-il défini ? Dessiner les deux confonnères
les plus stables
en faisant figurer les doublets non liants des hétéroatomes. Les données du
tableau 1 sont--elles
conformes à celles prédites par les théories de Lewis et Gillespie ? Commenter
en détail les
éventuelles différences.
7- Donner, en fournissant les justifications nécessaires, l'allure du diagramme
énergétique
correspondant à la transformation cis % trans en fonction de l'angle de torsion
1:.
8- Le confonnère trans est un peu plus stable que le cis. En s'aidant d'une
projection de
Newman le long de la liaison NO centrale, proposer une explication.
9- Proposer une interprétation des différences des Ri et Gi entre les 2
conformères.
Page 3/22 Tournez la page S.V.P.
Chimie 2015 Filière PC
On considère à présent l'évolution des R,- et 6,- tout au long de la
transformation cis--trans.
L'évolution des angles 6,- selon un calcul ab initio est représentée dans la
figure suivante sous
forme de la diflérence A6;=6;--6;,,...m avec 6,-,...... correspondant à l'angle
6,- du conformère
trans.(NB: les valeurs calculées peuvent diflérer légèrement des valeurs
expérimentales du
tableau l).
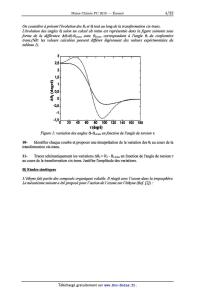
15% (degré)
. ? :=
--ï O! o C'
'1'50 20 40 60 80 100 120 140 160 100
1" (degré)
Figure ]: variation des angles 6,---6,;,...M en fonction de l'angle de torsion
r.
10- Identifier chaque courbe et proposer une interprétation de la variation des
Si au cours de la
transformation cis-trans.
11- Tracer schématiquement les variations ARi = Ri - R...... en fonction de
l'angle de torsion I
au cours de la transformation cis-trans. Justifier l'amplitude des variations.
B) Etudes cinétiques
L 'éthyne fait partie des composés organiques volatils. Il réagit avec l 'ozone
dans la troposphère.
Le mécanisme suivant a été proposé pour l 'action de l 'ozone sur l 'éthyne
(Ref. [ 2] ) :
Page 4/22
Chimie 2015 Filière PC
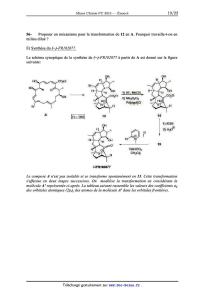
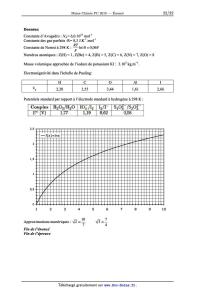
0
k] 9/ \)
Û3 + C2H2 <--------' "' l 3 (l) k_1 1' : 1 2 /C=C\ 0 H H / \ 0 9 ? ET4 0/ \0 '=. s"? \ /5(2) H/C=C\H HC:CH ] ,2,3--trioxclène ou k; et k--; sont les constantes de vitesse de l équilibre rapide ( l ) de constante d'équilibre K 1 et kg est la constante de vitesse de la réaction (2). ET est un état de transition. Le tableau ci--dessous donne les enthalpies libres a 298 K des composés 1 a 5 1+2 3 ET4 5 -10,8 0 66,7 -205,8 Tableau 2 : Enthalpies libres des composés 1 a 5 en lalmoll. Ref. [2]. 12- Donner le profil énergétique de la réaction entre l'ozone et l'éthyne. Préciser le rôle joué par 3 sur le chemin réactionnel. Quelle structure peut-on attendre pour ET4 ? 13- Déterminer l'expression de la vitesse de la réaction de formation de l,2,3-trioxoléne. Le diméthylsulfure (DMS) est majoritairement émis par les océans dans l 'atmosphère terrestre. Il réagit avec l'ozone dans la troposphère selon le mécanisme suivant: 03 9 P k3 (3) 03 + DMS % P' k4 (4) Page 5/22 Tournez la page S.V.P. Chimie 2015 Filière PC où k3 et k4 sont les constantes de vitesse des réactions (3) et (4) respectivement, P et P' les produits des réactions (3) et (4) respectivement. 14- Montrer que pour des concentrations initiales de DMS en large excès par rapport à la concentration initiale d'ozone [O3]0, la vitesse de disparition de [O3] peut se mettre sous la forme: -d ln[O3]/dt = (k3+k4[DMS]0) 15- Que pouvez-vous déduire du graphe ci-après ? Figure 2 : Variation de d ln[O3]/dt en fonction de [DMS]0. Ref. [2]. En réalité, des radicaux OH° produits au cours de la réaction (4) peuvent perturber l'étude cinétique en réagissant eux-mêmes avec le DMS. Les auteurs de l'étude ont donc cherché à trouver des conditions permettant de capter ces radicaux sans perturber les réactions (3) et (4). Pour ce faire, ils ont étudié l'effet de l'introduction de cyclohexane dans le système réactionnel. Le graphe ci-après donne l'évolution de ln([O3]0 /[O3]) en fonction du temps pour différentes conditions expérimentales : Page 6/22 Chimie 2015 Filière PC 1,2 1,0 A 0,8 % 0,6 03(('a"12) F; 0 9 04 ' ' È , A DMS+03 0,2 DMS+O_;(('6lII2) 0,0 0 1 2 3 4 5 temps/h Figure 3 : Variation de ln([ 03] g/[ 03] ) en fonction du temps (en heure) pour la réaction de décomposition de ! 'ozone seul (réaction (3 )) et en présence de DMS (réactions (3 ) + (4)). Ces équilibres sont étudiés en présence et en absence de cyclohexane (concentration 33,6 ppm). La concentration initiale de DMS est de 6, 05.1 014 molécule.cm'3 (Réf. [2] ). 16- Décrire l'effet du cyclohexane sur les réactions (3) et (4). Le cyclohexane est-il un choix judicieux ? 17- Donner l'ordre de grandeur de la correction ainsi apportée sur la valeur de la constante cinétique de la réaction entre le DMS et l'ozone. Références: [1] Richter et al. J. Chem. Phys. 120, 1306 (2004). [2] Du et al. Chem. Phys. Letters 436, 36 (2007). Page 7/22 Tournez la page S.V.P. Chimie 2015 Filière PC LA BETADINE ® Le diiode possède des propriétés redox (et électrophiles) avec pour conséquence une activité antibactérienne. Différents antiseptiques iodés existent : · la teinture d'iode (solution alcoolique de diiode) ou la solution de Lugol (ions I3- dans l'eau) ; · les molécules iodées organiques (par exemple, le iodoforme CHI3) ; · les iodophores. La solubilité s du diiode I2 à 298 K dans l'eau et divers solvants organiques est donnée dans le tableau suivant: solvant s(g.L-1) eau 0,33 éthanol 210 éther 250 cyclohexane 27 heptane 15 18L'élément iode a pour structure électronique [I]=[Kr]5s24d105p5. Interpréter cette écriture. Quel est le numéro atomique de l'élément iode ? 19- Pourquoi le diiode est-il si peu soluble dans l'eau ? Un iodophore est un complexe formé de diiode (sous forme de I2, I3- ou I5-) et d'une molécule polymérique transporteuse qui augmente la solubilité des molécules de diiode dans la phase aqueuse tout en permettant leur libération lente, prolongeant ainsi l'effet antibactérien. Ces iodophores ne présentent pas les inconvénients thérapeutiques des solutions classiques d'iode à savoir : irritation, brûlures et coloration de la peau. La polyvinylpyrrolidone iodée (PVP-I, polyvidone ou povidone iodée) présente dans la Bétadine® est un complexe de polyvinylpyrrolidone et de diiode. Ce polymère de synthèse est le transporteur de diiode le plus utilisé depuis 1952. En fait, suivant la méthode de préparation du complexe, l'iode est lié à la polyvinylpyrrolidone sous forme de molécule I2 ou d'ions I3-. Dans les deux cas, seule une faible quantité de diiode n'est pas complexée et est présente dans la solution sous forme libre (0,04%). Page 8/22 Chimie 2015 Filière PC Figure 4: Représentation simplifiée de la PVP--1. Entre parenthèses, on retrouve une entité monomérique de masse molaire égale à 111 g/mol. La povidone iodée peut être considérée comme un réservoir de diiode. L'étiquette d 'un flacon de Bétadine® dermique a 10% donne la composition suivante : ' povidone iodée 10 g/100 mL, ' nonoxinol 9 (tensioactif non ionique, stabilise la solution}, ' acide citrique monohydraté, hydroxyde de sodium, phosphate disodique dihydraté fixe la valeur du pH autour de 5,5). Un brevet récent propose la synthèse suivante de la polyvinylpyrrolidone iodée. On prépare dans 1,00 L d'eau distillée une solution contenant 100 g de polyvinylpyrrolidone (Mm/p = 58000 g.mol"), 15,26 g d'iodure de potassium KI (91,9 mmol) et 3,93 g d'iodate de potassium KlO3 (18,4 mmol), puis on acidifle le mélange avec de l'acide chlorhydrique jusqu 'a obtenir pH = 4. À la fin de la réaction, la solution aqueuse donne un test négatif aux ions iodure. La solution est laissée 24 h au repos, puis l'eau est partiellement évaporée et le complexe rouge est filtré. On donne ci--après le diagramme potentiel standard apparent en fonction du pH (diagramme E °app -- pH) de l 'iode dans lequel les espèces physico--chimiques prises en compte sont : 1 _(aq,), 103_(aq,) et 12(aq,). Toute espèce a une activité égale à l'unité, à l'exception des ions + . . . . . ! H3O . Dans un souci de lisibilité, on notera : couples 103712 12/1 _ 10371 _ notation potentiel standard apparent E °app, ,- E °app, ; E °app, ; E °app, 3 notation potentiel standard E °,- E ° 1 E °2 E % Page 9/22 Tournez la page S.V.P. Chimie 2015 Filière PC pH 0 2 4 6 8 10 12 14 Figure 5 : Diagramme potentiel standard apparent de l 'iode en fonction du pH. 20- Affecter aux lettres de ce diagramme les espèces iodées prédominantes des domaines considérés en justifiant votre réponse. 21- Ecrire les demi-équations électroniques pour chaque couple redox en milieu acide et préciser les expressions de leur potentiel standard apparent E °app,i en fonction du pH. 22- Calculer la valeur du potentiel standard du couple IO3_(aq4)/1_(Bq4) noté E °3. 23- Interpréter le protocole expérimental à l'aide du diagramme fourni et indiquer la nature et l'équation de la réaction mise en jeu. 24- Calculer la valeur du pH à partir duquel le mélange d'ions iodate et iodure considéré ici devient thermodynamiquement instable. 25- Quelle(s) opération(s) expérimentale(s) faut-il réaliser pour obtenir le complexe PVPH+-I3_ ? Nous allons à présent chercher a titrer le diiode total dans la Be'tadine® commerciale. Le protocole est le suivant: Dans un bécher de 100 mL, prélever un volume V; = 10,0 mL de solution de Be'tadine® commerciale et titrer a l'aide d'une solution aqueuse de thiosulfate de sodium de concentration molaire c; = 5,00.10'2 mol.L'l (quelques gouttes d'empois d'amidon seront Page 10/22 Chimie 2015 Filière PC ajoutées vers la fin du titrage}. L'équivalence est obtenue pour un volume de solution aqueuse de thiosulfate de sodium égal à 16,4 mL. 26- Quel est le rôle de l'empois d'amidon ? Ecrire l'équation de réaction du titrage réalisé. Déterminer sa constante d'équilibre a 298 K. 27- Quelle est la concentration molaire en diiode dans la solution commerciale de Bétadine® ? 28- En supposant que la Bétadine® contient exactement 10,0 g de PVP-l pour 100 mL de solution, estimer le nombre d'entités monomériques par molécule de diiode 12. 29- Proposer un protocole expérimental permettant d'extraire sélectivement le diiode de la solution de Bétadine®. Synthèse totale du (--)-FR18287 7 Le FR182877 a été isolé d'une souche de Streptomyces en 1998 par des scientifiques du laboratoire pharmaceutique japonais Fujisawa au cours d'un programme de criblage de nouveaux agents antimitotiques d'origine microbienne. Ce composé présente une activité antitumorale contre plusieurs types de lignées cellulaires cancéreuses comme MGF-7, A549 et HT -29. On s'intéresse dans ce problème a l 'élaboration du (--)-FR1 828 77, en particulier a la voie de synthèse proposée par l 'équzpe de David A. Evans de l 'université d'Harvard et publiée dans la revue J Am. Chem. Soc. 2003, 125, 1353]. L'analyse rétrosynthétique de (--)-FR182877 est présentée dans la figure ci-après. Page 11/22 Tournez la page S.V.P. Chimie 2015 Filière PC DFI DH ÛTBDPS E" {HÜÈE a" "f =} D en D _.H'H "'-\. 52 ""' A =--... El: +4ÆR1333?? ' ' Er Fi=TES ._. Ü DFI Figure 6: Analyse rétrosynthétique du (--)-FR182877 Le schéma rétrosynthétique fait apparaître un premier intermédiaire macroeyclique A. Ce composé est issu des molécules B] et BZ, elles-mêmes issues du composé C. A) Préliminaires. 30- La molécule de (--)-FR182877 (représentée sur la figure 6) est-elle chirale ? Justifier. 31- Que signifie (--) dans le nom de la molécule ? Comment peut-on mesurer expérimentalement la grandeur physique correspondante ? 32- Donner le descripteur stéréochimique (configuration absolue) de l'atome de carbone numéroté 1 du (--)-FR182877 (cf figure 6), en détaillant le raisonnement. B) Synthèse de C. Nous considérons & présent la synthèse du précurseur C. Le composé C est préparé à partir du but--3-én-I-ol, noté 1, selon la séquence représentée sur la figure 7. Page 12/22 Chimie 2015 Filière PC TEEC1 Ûsü.-, 3 331434 NüH --* Mmes ' 3 [JF--EF dimanetH3ü 1} ?: JL 1 ;» NH 2 HQE! -:_'J " 1} HI--hü 4 ?." q\ 3\ 113331: 7<3'--'Ç" nm.-u: ... Ü EL"D oa | f}{\ D D DOEËL EÜ'JL'N }\'/v-ÜTBE HMVÏ/\ EHgOE: _-?3°E' L......raÜms PPF/Ü ÜTE--S ÜEE Pïëcm5em E E _ b....-- "|" 5 _ 11cm imié Figure 7: Préparation de l 'aldélzyde C. Le composé 2 est solubilise' dans un mélange d'eau et de dioxane. Celui-ci est traité, a la température 9 = --20°C, par du tétraoxyde d'osmium OsO4. Lorsque la solution devient sombre, de l'iodate de sodium NaIO4 est ajouté. Le milieu est laissé sous agitation a température ambiante. Après traitement le composé 3 est obtenu avec un rendement de 83%. Le spectre d 'absorption [R du composé 3 présente une bande intense vers 1 720 cm]. A une solution de bromure d 'isopropénylmagnésium (composé X sur la figure 7), sous une atmosphère d 'argon et a une température 6 = 00EUR, on ajoute goutte a goutte une solution du composé 3. Le composé 4 est obtenu, après traitement, sous la forme d 'une huile incolore. Ce composé est utilisé sans purification dans l 'e'tape suivante. Le spectre d'absorption [R du composé 4 présente notamment une bande large vers 3400 cm]. 33- Quel est l'intérêt du passage de 1 à 2 ? Proposer un autre réactif qui aurait permis de réaliser cette étape, en précisant les conditions expérimentales appropriées. 34- Donner la formule topologique de la molécule 3. 35- Préciser la structure du composé 4. 36- Pourquoi la synthèse a-t-elle été réalisée sous argon ? 37- Proposer un mécanisme schématique pour expliquer la formation de 4. La transformation mise en jeu est-elle stéréosélective ? Justifier. Page 13/22 Tournez la page S.V.P. Chimie 2015 Filière PC L'huile obtenue a l 'étape précédente est solubilisée dans du 1 ,] ,] -triéthoxyéthane fraichement distillé contenant une faible quantité d 'acide propanoique. Le mélange obtenu est chauffé a reflux pendant une heure. Après évaporation sous pression réduite, le composé 6 est isolé avec un rendement de 75% après chromatographie sur colonne. 38- Proposer un mécanisme permettant d'expliquer la transformation de 4 en 5. La transformation de 5 en 6 est une transposition de CLAISEN. Cette transformation a fait l 'objet de nombreuses études qui suggèrent un transfert d 'électrons intramoléculaire au sein du composé 5, conduisant a 6 via un état de transition cyclique a 6 centres, en conformation chaise. On supposera par ailleurs que cette transformation est sous contrôle cinétique. 39- A l'aide des représentations de Lewis, schématiser les transferts électroniques conduisant de 5 à 6 en un seul acte élémentaire. Afin de simplifier l 'étude, on ne s'intéresse dans la suite qu a l 'énantiomère (R) de 5. 40- Représenter les états de transition possibles sous forme chaise. 41- Indiquer la structure des composés issus des états de transition précédents. Par quelle relation de stéréochimie sont--ils reliés ? 42- Quel est le produit majoritaire ? Justifier. Le composé 6 en solution dans le dichlorométhane est traité a -78°C par un équivalent molaire d'hydrure de diisobutylaluminium (DIBAL-H). Un composé intermédiaire neutre noté 6 ', possédant 3 atomes d 'oxygène et un atome d 'aluminium, est obtenu. Une fois achevée l'addition de DIBAL-H, une solution aqueuse de sel de Seignette est ajoutée (tartrate de sodium et de potassium, figure ci-après). r'- -L" D DH cl: tl: [jf Ha" ÜH Ü sel de Seignette La solution est agitée a température ambiante pendant 12 heures. Après purification, le précurseur C, dont le spectre RMN IH est présenté dans le tableau suivant, est obtenu avec un rendement de 97%. Le spectre IR fait apparaître notamment des bandes a 0 = 2929 cm'1 et a 0 = 1727 cm]. Page 14/22 Chimie 2015 Filière PC déplacement chimique % en ppm 9,76 5,18 3,57 2,52 2,33 2,22 1,64 0,89 0,05 multiplicité intégration singulet triplet triplet triplet triplet doublet de triplets singulet singulet singulet 1 1 2 2 2 2 3 9 6 J(Hz) 7,6 7,3 7,3 7,3 7,3 ; 7,6 spectre RMN 1H du composé C enregistré à la fréquence de 500 MHz dans CDCl3. 43- Analyser la polarité de la liaison Al-H. En déduire le rôle de DIBAL-H. 44- Proposer un mécanisme permettant d'expliquer la formation de 6'. 45- Quel peut être le rôle du sel de Seignette ? 46Attribuer, dans la mesure du possible, les signaux de RMN aux noyaux qui en sont responsables et commenter leur multiplicité. Indiquer sur un schéma de la molécule les valeurs des déplacements chimiques des noyaux et des constantes de couplage entre noyaux. C) Synthèse de B2. Par souci de simplification nous ne considérerons que B2 et pas B1. Le fragment B2 est préparé à partir du composé C selon la séquence suivante: Page 15/22 Tournez la page S.V.P. u mami. TEA 0 o/'< ° _, & \\/NJ<-- 2)Précqu e / T | k.. on 3) sam... ...e... pH : 7 7 o o \ DMP DMPP l / {o DMP: ,° Nel--{CD, "\ /'ΰAfi CH,ch ÜAC Aco OM 0 mes 01135 /0\ m;,OE:. N 52 ' \ \ a. NÆCO, \ \o \o lnt3 Chimie 2015 Filière PC D) Synthèse de A. Les_ fragments BI et BZ sont couplés à l'aide d'une réaction de Miyaura--Suzuki. OR OR OTBDPS 31 WOTBDPS (Ho)zB Pd(PPh3)4 0 OR '['|2C03 /0\ H20 THF 32 T | \ BI BI B1 2 R = TBS couplage de Miyaura--Suzuki des synthons BI et BZ. Le cycle catalytique simplifié proposé pour cette transformation est présenté figure suivante: R 312 2N"* Ru/YB' 82 B' \ lnt0 / B: / | ___, Pd°(PPh3)z | Ph3Rpden3 Ph3R BI Pd lnt3 \ , R \ mu R'/\g' \,-'\R2 1 er ppn3 u__ _. ;-- /\,B(0Hh ... Elape3 \ // R2 Et 2 __ / aPe le003 , HgO Ph3P\ \ R Pd/\/ 2 n \ » ' PPh3 Br lnt2 cycle catalytique simplifié de la réaction de couplage de Miyaura--Suzuki. 52- De quel type de catalyse s'agit-il ? Donner le degré d'oxydation du palladium dans les différents intermédiaires réactionnels notés Int. En déduire le nom des différentes étapes de ce cycle. Page 17/22 Tournez la page S.V.P. Chimie 2015 Filière PC La synthèse de A est présentée figure suivante: 512 DIEÈAL ÜH3Ûl3 ÛTEDP$ üTBDP5 E] D NgHÛ_|Ï,ÜEt [] 11 DE: G H DFI SHC!g DE !?".| En anN', F AçüH DMF :: Ü Erü3 Û52ÛÜ3 DE: 12 A mes 1_. _ N THF ' \ f GHEÜIË Synthèse de A. 312 est réduit par le DIBAL-H, l 'aldéhyde obtenu est alors ajouté a une solution de chlorure d'étain (en quantité catalytique) et de diazoacétate d'éthyle dans le dichlorométhane. On laisse agiter pendant deux heures. Après extraction et purification, on obtient le composé ]] avec un rendement de 70%. 53- Ecrire les formules mésomères de la molécule de diazoacétate d'éthyle. 54- Proposer un mécanisme expliquant la formation de 11. On précise que ce mécanisme se déroule en deux étapes et qu'un gaz se dégage au cours de la seconde. Préciser le rôle du dichlorure d'étain. La déprotection sélective de ]] suivie de l 'oxydation par le réactif de Sarett permet d 'obtenir l 'aldéhyde 12. Ce dernier est ensuite solubilisé dans une grande quantité de T HF . Du carbonate de césium est alors ajouté. La solution est agitée pendant 5 heures puis on ajoute ] mL d'acide chlorhydrique a ] mol.L'l. Une fois le dégagement gazeux fini, la solution est lavée par de l 'eau et de la saumure. La purification donne le composé A avec un rendement de 77%. 55- Donner la structure de 12. Page 18/22 Chimie 2015 Filière PC 56- Proposer un mécanisme pour la transformation de 12 en A. Pourquoi travaille-t-on en milieu dilué '? E) Synthèse du (--)-FR1828 77. Le schéma synoptique de la synthèse de (--)-FR1828 77 a partir de A est donné sur la figure suivante: 1} HF, MEEN É} "183 53Ü3 Pfi{dppüül " 1?- l[-1'FFI'I 5235"? Le composé A n'est pas isolable et se transforme spontanément en 13. Cette transformation s'effectue en deux étapes successives. On modélise la transformation en considérant la molécule A ' représentée ci-après. La tableau suivant rassemble les valeurs des coefficients ai]-- des orbitales atomiques (2pZ j des atomes de la molécule A ' dans les orbitales frontières. Page 19/22 Tournez la page S.V.P. Chimie 2015 Filière PC Modélisation de la transformation de A en 13 HO BV atome aÿ- atome ai]- C9 0,38 C5 0,51 C12 -0, 48 C4 -0, 25 C14 -0,07 C3 -0,56 C15 0, 03 01 -0,29 Coefficients de l 'orbitale (2pz j sur les atomes numérotés dans les orbitales frontières du système a de la molécule A '. 57- De quelle réaction s'agit-il ? 58- On admet que la réaction est sous contrôle orbitalaire. Identifier le cycle qui se forme le premier. Détailler le raisonnement. 59- Ce résultat était-il prévisible ? Justifier. Le composé 13 subit une suite de transformations non étudiées ici pour aboutir a 14. Ce dernier composé est mis en présence d 'hydroxyde de potassium dans le THF. Après hydrolyse, le composé 15 est isolé et utilisé sans purification dans l 'étape suivante. 15 est solubilisé dans 2 mL de dichlorométhane puis on ajoute de l'hydrogénocarbonate. La solution est dégazée et on ajoute le réactif de Mukaiyama. Le mélange réactionnel est agité pendant 24h. Après purification, (--)-FR182877 est obtenu avec un rendement de 62%. 60- Donner la structure de 15. 61- Proposer un mécanisme pour la transformation de 14 à 15. Page 20/22 Chimie 2015 Filière PC 62Le réactif de Mukaiyama réagit avec un acide carboxylique RCOOH pour conduire à une paire d'ions. L'espèce chargée positivement a pour formule RC7O2H7N+. Proposer un mécanisme permettant d'expliquer la formation de cette espèce ionique. 63- Quel est le rôle du réactif de Mukaiyama ? 64- Proposer un mécanisme pour la dernière étape. Page 21/22 Tournez la page S.V.P. Chimie 2015 Filière PC Données: Constante d'Avogadro : NA= 6,0.1023 mol"1 Constante des gaz parfaits :R= 8,3 ] .K'1.mol'1 Constante de Nemst à 298 K : %lnlO = 0,06V Numéros atomiques : Z(H) = l, Z(Be) = 4, Z(B) = 5, Z(C) = 6, Z(N) = 7, Z(O) = 8 Masse volumique approchée de l'iodure de potassium KI : 3.103 kg.m_3 . Electronégativité dans l'échelle de Pauling: H C 0 Al 1 XP 2,20 2,55 3,44 1,61 2,66 Potentiels standard par rapport à l'électrode standard à hydrogène à 298 K : Cüllp1E5 H2ÙËÏHËÜ IOS--fl2 12fl-- 840Ë_ÏSQÜË_ EÜ (TV) LT"? 1,19 0,52 038 Approximations numériques : { z % ( "% Fin de l'énoncé Fin de l'épreuve Page 22/22
