Mines Chimie PC 2011
| Thème de l'épreuve | L'hydroxylamine. Synthèse d'un clérodane de type jodrelline à activité antiappétente. |
| Principaux outils utilisés | solutions aqueuses, cinétique, oxydoréduction, courbes intensité-potentiel, chimie organique |
| Mots clefs | hydroxylamine, dihydroclérodine, clérodane, antiappétent |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
A 2011 Chimie PC
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2011
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2011 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'e'nonce' de cette épreuve, particulière aux candidats de la filière PC,
comporte 20 pages.
' Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
' Les candidats ne devront pas hésiter à formuler des commentaires succincts
qui leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
' Le barème tiendra compte de la longueur de l'énoncé.
' Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une
erreur d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
DEBUT DE L'ENONCE
Partie A
L'hydroxylamine
L'hydroxylamine NH 20H joue un rôle important dans l 'industrie chimique. Plus
de 95 % de
la production mondiale d 'hydroxylamine, estimée a 800 000 tonnes / an, est
utilisée pour la
synthèse de l 'oxime de la cyclohexanone, précurseur de l 'e--caprolactame.
Plusieurs procédés
industriels ont été mis au point pour permettre sa synthèse. Parmi les plus
utilisés on peut
citer le procédé Raschig (réaction du carbonate d 'ammonium avec le dioxyde de
soufre) ou
encore l 'hydrogénation catalytique de l 'acide nitrique en hydroxylamine. Ils
présentent
cependant plusieurs désavantages : les synthèses sont peu sélectives et une
grande quantité
de sous-produits est obtenue, il est ainsi difficile de produire de l
'hydroxylamine en grande
quantité. Les recherches ont donc été orientées vers la mise au point d 'un
procédé sélectif
permettant d'obtenir de l 'hydroxylamine en grande quantité. Nous allons
étudier dans la
première partie l 'électrosynthèse de l 'hydroxylamine.
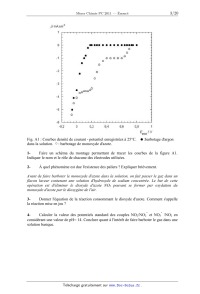
Tracé d'une courbe densité de courant - potentiel
La Figure A] représente les courbes de densité de courant j en fonction du
potentiel, EESH,
d 'une électrode de platine, exprimée par rapport a l 'électrode standard a
hydrogène (ESH).
L'électrode de platine est au contact d'une solution d'acide sulfurique (4, 7
mol . L'I) dans
laquelle on fait barboter un gaz (monoxyde d 'azote ou argon}, a la pression d
'un bar.
Page 2/20
Chimie 2011 Filière PC
jtmä.cm'2
1 _ | | | | | _
III--- IIIIIIIIIIIIIIIII ---
: ' ü :
- Ü _
' . I:I -
-1 -- | E! D C! E! E! --
- ü -
: ' .:. :
-Ë -_ | Ü __
: .:. Z
-3 _ _
- ü -
_ .üüüfiüü -
'4 _" Iü "_
-5 '_ _'
- ü -
_E _ l l l l | l l l l | l l l l | l l l l | l l l l | l l l l _
-El,2 |] El,2 El,4 III,E DE 1
IlËESH _.""-._.-"
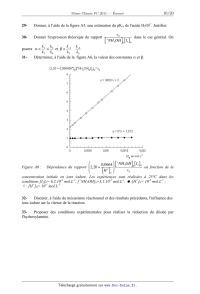
Fig. A1 : Courbes densité de courant - potentiel enregistrées à 25°C. .
:barbotage d'argon
dans la solution. {? : barbotage de monoxyde d'azote.
1- Faire un schéma du montage permettant de tracer les courbes de la figure A1.
Indiquer le nom et le rôle de chacune des électrodes utilisées.
2- À quel phénomène est due l'existence des paliers ? Expliquer brièvement.
Avant de faire barboter le monoxyde d 'azote dans la solution, on fait passer
le gaz dans un
flacon laveur contenant une solution d'hydroxyde de sodium concentrée. Le but
de cette
opération est d'éliminer le dioxyde d'azote N02 pouvant se former par oxydation
du
monoxyde d 'azote par le dioxygène de l 'air.
3- Donner l'équation de la réaction consommant le dioxyde d'azote. Comment
s'appelle
la réaction mise en jeu ?
4- Calculer la valeur des potentiels standard des couples NOg/NOJ et NO! /N02 en
considérant une valeur de pH= 14. Conclure quant à l'intérêt de faire barboter
le gaz dans une
solution basique.
Page 3/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
On souhaite maintenant identifier les réactions électrochimiques mises en jeu
lorsque l 'on
fait barboter du monoxyde d 'azote dans une solution acide ( 53, figure A1 ).
Expérimentalement, lorsque l 'on fixe la valeur du potentiel de l 'électrode de
travail a un
potentiel inférieur a EESH = 0, 73 V on observe un dégagement gazeux au
voisinage de
l 'électrode. Le gaz est analysé par spectroscopie d 'absorption infrarouge. Le
spectre présente
plusieurs bandes dont une vers 2250 cm'1 et une autre a 1200 cm].
Dans les conditions de l 'expérience, seuls le diazote et le protoxyde d 'azote
sont gazeux.
5- Donner la structure de Lewis du diazote N2 et du protoxyde d'azote N20.
6- Quel est le gaz formé ? Justifier simplement le raisonnement.
7- Écrire la demi-équation redox correspondante.
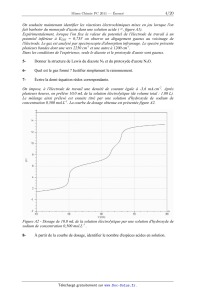
On impose, a l'électrode de travail une densité de courant égale a -3,6
mA.cm'2. Après
plusieurs heures, on prélève 10,0 mL de la solution électrolytique (de volume
total : 1,00 L).
Le mélange ainsi prélevé est ensuite titré par une solution d'hydroxyde de
sodium de
concentration 0,500 mol.L'l. La courbe de dosage obtenue est présentée figure
A2.
pH
_3 _r ......... r ......... |..-.-.-.-.__ ......... _| ......... | ........ _ |
.| _| ......... | | | | .......... | r I | | ......... fi
4D 5D EÜ ÎÜ EiÜ
Figure A2 - Dosage de 10,0 mL de la solution électrolytique par une solution d
'hydroxyde de
sodium de concentration 0,5 00 mol.LJ .
8- À partir de la courbe de dosage, identifier le nombre d'espèces acides en
solution.
Page 4/20
Chimie 2011 Filière PC
9- En utilisant les données, conclure quant aux réactions électrochimiques
mises en jeu a
un potentiel inférieur à 0,35 V et supérieur a 0,08 V.
10- Identifier les réactions associées à chacun des sauts de pH et calculer
leurs constantes
d'équilibre.
11- Déterminer la concentration des espèces formées au cours de l'électrolyse à
courant
imposé. Quelle est la proportion en hydroxylamine ? Conclure.
12- Calculer le pH a la première et a la seconde équivalence.
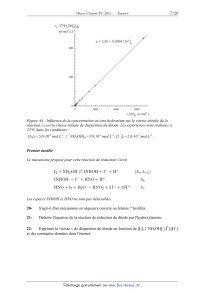
Synthèse en pile à combustible.
L 'idée consiste a produire de l 'hydroxylamine au sein d'une pile a
combustible. Le système
{simplifié} étudié est présenté figure A3 (le circuit extérieur permettant la
circulation du
courant n'est pas représenté}. L'électrolyte est constitué d'une solution
concentrée d'acide
sulfurique (4, 7 mol.L'1). Les électrodes poreuses sont en platine et on
supposera que les ions
sulfates sont électro-inactifs.
Les zones anodiques et cathodiques sont séparées par une membrane sélective qui
ne laisse
passer que les ions H +(aq).
Gaa 1 Gaï 1
_} HESÜÆI «n'.--
l
l
l
'
Membrane sélective H* Ft
Figure A3 : Schéma de la pile à combustible
13- Choisir les gaz 1 et 2 de façon a réaliser un générateur d'électricité de
type pile à
combustible pouvant produire de l'hydroxylamine. Justifier.
14- Identifier l'anode et la cathode. Ecrire les réactions pouvant se dérouler
aux
électrodes.
Page 5/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
15- Quel est l'intérêt principal de cette méthode pour produire de
l'hydroxylamine ?
Quels sont ses inconvénients ?
16- Avant de faire fonctionner le système, on fait barboter de l'argon pendant
une heure
dans l'électrolyte. Expliquer la raison de cette procédure.
17- Pourquoi séparer les deux compartiments à l'aide d'une membrane sélective
aux ions
H+f... + 2
«,s=51a+ 1,D12
1....I--I----I--I--Ü_Ü
|:l _ l l l l | l l l l | l l l l | l l l l |
El Û,ÛÛÛ5 Û,ÛÛ1 Û,ÛÛ15 Û,ÛÛË
[|']Ù en mu|.L"
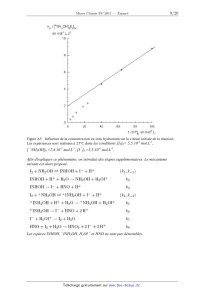
() 0664 WH OH !
Figure A6 : Dépendance du rapport 2,20+ ' [ 3 ]0[ 2]0 en fonction de la
[H*l
O
concentration initiale en ions iodure. Les expériences sont réalisées a 25°C
dans les
conditions [12]0= 6,2.10'4 mol.L'l, ÏNH3OH]O=3J.IÛZ mol.L'l, 0:[H+]0= ]0'3
mol.LJ ;
@: [H%= 10'1 mol.L'1
V0
32- Discuter, à l'aide du mécanisme réactionnel et des résultats précédents,
l'influence des
ions iodure sur la vitesse de la réaction.
33- Proposer des conditions expérimentales pour réaliser la réduction du diiode
par
l'hydroxylamine.
Page 10/20
Chimie 2011 Filière PC
Partie B
Synthèse d'un clérodane de type jodrelline à activité
antiappétente.
Depuis de nombreuses années, les chercheurs ont tenté de développer des méthodes
permettant de lutter contre les insectes ravageurs de cultures. Une de ces
méthodes consiste
a utiliser les capacités propres a certaines plantes de se protéger des
insectes phytophages.
Ces plantes se protègent de ces insectes en produisant des métabolites
secondaires ayant
pour effet d inhiber le processus de prise alimentaire chez l'insecte, sans le
tuer directement.
Cette propriété se nomme l'antiappétence.
L 'étude de telles plantes a permis d'isoler et de caractériser différentes
familles de composés
chimiques présentant ce type d 'activité biologique. Nous allons nous
intéresser dans ce
problème a la synthèse de la dihydroclérodine qui appartient a la famille des
clérodanes
figure BI), selon la procédure publiée par l'équipe du professeur De Groot dans
]. Org.
Chem., 1999, 64, 9178 -- 9188. Les 4 sous--parties de ce probléme sont assez
largement
indépendantes.
Dihydroelérodîne (-)--Carvone
Fig. B1 -- Dihydroelérodine et ses précurseurs : analyse rétrosynthétique
]) Synthèse du 2-méthoxyhexahydrofurofurane E
Le 2-méthoxyhexahydrofurofurane est synthétisé en six étapes a partir de
l'ester A. Le
schéma synoptique de l'élaboration de l 'acétal E est proposé figure BZ.
Page 11/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
OMe ?
1) LiAIH4 () NaCN
A: > E > Q > _
2 H O+ H O _
COZIVIe ) 3 ' 2 \ /N C13H1895S
H3o+,H20
H H
0 É o 0 E 0
1)DiBAL--H
E: OMG 4 E;
: 2) MeOH, BF3
ñ ñ
Fig. B2 -- Synthèse du composé E
L 'ajout de tétrahydruroaluminate de lithium (LiAlH4) a l 'ester 4 en solution
dans
l 'éthoxyéthane conduit, après hydrolyse acide, a la formation d 'un composé ë
présentant en
spectroscopie d'absorption infrarouge une bande large centrée a 0 = 3300 cm].
Ce composé
est ensuite placé en solution dans le chloroforme, puis de la pyridine et du
chlorure de p-
toluènesulfonyle sont ajoutés. Un composé g de formule brute C13H1805S est
obtenu. L 'ajout
au composé g de cyanure de sodium fournit I_) qui présente en infrarouge une
bande fine
centrée a 0 = 2200 cm]. Le traitement de l_) en milieu acide aqueux conduit a
la formation
du composé l_î dont le spectre RMN IH est présenté dans le tableau donné plus
loin. l_î est
réduit dans le toluène par le DiBAL-H. Après une heure de réaction, du méthanol
et un acide
de Lewis sont ajoutés au mélange réactionnel. Le composé E est finalement isolé.
34- Donner la structure du composé E. On admettra que le cycle de A n'est pas
affecté par
les conditions expérimentales.
35- En remarquant l'analogie de structure entre le chlorure de
p-toluènesulfonyle et un
chlorure d'acyle, proposer un mécanisme entre le composé E et le chlorure de p-
toluènesulfonyle. En déduire la structure de Q .
36- Quel est le rôle de la pyridine ? On précise qu'à 298 K le pKA du couple
pyridinium /
pyridine est voisin de 5.
37- Donner la formule topologique de Q.
38- À quel type de mécanisme correspond l'action du cyanure de sodium sur le
composé
Q? Justifier votre réponse
39- Quel est l'intérêt de la transformation de E en g ?
Page 12/20
Chimie 2011 Filière PC
Le traitement de l_) en milieu acide aqueux conduit intermédiairement a la
formation d'un
composé Il de formule brute C6H1004. Le spectre infrarouge d'un tel composé
présente
notamment une bande large entre 2500 cm" et 3200 cm" et une bande fine centrée a
0 =] 665 cm".
40- Indiquer la formule topologique du composé D_'.
41- Discuter la position de la bande à 0 =1665 cm"1 par rapport aux données en
annexe.
42- En déduire le mécanisme de formation de E (à partir de E).
43- Analyser le spectre RMN de E et attribuer chaque signal au(x) noyau(x) qui
en est
(sont) responsable(s).
Spectre RMN 1H du composé E (t=triplet, d=doublet, m=multiplet):
Déplacement Multiplicité Intégration
chimique 8 (en ppm)
2,00 td 2
2,65 d 2
3 , 1 7 m 1
4,00 t 2
6, 1 0 d 1
44- Le DiBAL-H est un réducteur, donneur d'hydrure comme NaBH4 et LiAlH4, de
formule brute (iBu)2AlH. En considérant la formule semi-développée de E,
proposer un
mécanisme permettant d'expliquer sa formation.
Il) Formation du composé !
La synthèse de la dihydroclérodine s'effectue a partir d'un produit naturel :
la (-)-carvone
dont la structure est présentée figure B3. L 'addition de Me2CuLi sur la
(-)-carvone conduit
après hydrolyse a la formation de Q. Le composé Q est ensuite mis en présence
de l 'acétal E
synthétisé préalablement.
Un catalyseur acide est ajouté. On observe la formation du composé I_I. Ce
composé est
ensuite transformé en ! a l'aide d 'une suite de réactions non étudiées ici.
Page 13/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
1 CH CuLi
) ( 3)2 > _
2) (NH4+9C1-) 9 H20
(-)--Carvone
ï
Fig. B3 -- Synthèse du composé !
45- En justifiant la réponse, donner le descripteur stéréochimique
(configuration absolue)
de l'atome de carbone asymétrique de la (-)-carvone.
46- Donner la structure de Q (composé majoritaire).
47- La réaction de formation de Q est stéréosélective. Expliquer l'origine de
cette
sélectivité et dessiner le stéréoisomère majoritaire.
48- Donner, lors de la réaction de Q avec E en milieu acide la structure du
nucléophile et
de l'électrophile mis en jeu ainsi que les mécanismes de leurs formations.
III) Formation des cycles A et B figure BI)
Sous atmosphère inerte, le 5-bromopent--I-ène est placé en solution dans
l'éthoxyéthane
anhydre. Cette solution est ajoutée lentement à une solution d'éthoxyéthane
contenant des
copeaux de magnésium. L'espèce formée en solution est titrée puis ajoutée à une
solution
contenant un demi-équivalent de bromure de cuivre CuBr. Le dialkylcuprate ainsi
formé est
noté ._Ï. ._Ï est additionné au composé !. Après hydrolyse acide modérée
(NH4Cl) le composé I_(
est isolé. Ce composé subit ensuite une ozonolyse suivi d'un traitement
réducteur ce qui
permet d'obtenir le composé L. Ce composé est ensuite placé en solution dans le
toluène en
présence d 'un acide organique faible. On obtient le composé l\_I, de formule
brute C18H2603,
qui présente en infrarouge une bande intense centrée & 0 = 1692 cm" ainsi
qu'une bande
faible centrée & 0 =] 621 cm].
Page 14/20
Chimie 2011 Filière PC
49- Justifier les précautions prises pour la préparation de l'organomagnésien:
"atmosphère
inerte", solvant "anhydre", ajout "lent" sur le magnésium.
Pour justifier la régiosélectivitê observée lors de la formation du composé
I_(, on peut utiliser
la théorie des orbitales frontières en supposant que la réaction est sous
contrôle orbitalaire.
La molécule ! est modélise'e par la pent--3-èn-Z-one. Dans le cadre de
l'approximation de
Hückel simple, chaque substituant méthyle est décrit comme un be'te'roatome a
deux électrons
pour le système J'L' ; seuls les coefficients sur l'atome d 'oxygène et sur les
atomes de carbone
e'tbyle'niques sont fourni ; la numérotation utilisée est celle de la
nomenclature.
Niveaux oc+2,43[3 oc+2,24[3 oc+1,55[3 oc+0,87[3 oc-0,50[3 oc-1,60[3
d'énergie
C2 0,436 -0,133 0,358 -0,068 -0,563 0,584
C3 0,262 0,074 0,304 -0,624 -0,203 -0,633
C4 0,201 0,299 0,114 -0,477 0,664 0,431
0 0,304 -0,107 0,646 0,535 0,375 -0,224
Coefficients et énergies des orbitales moléculaires de type tu: de la
pent-3-èn--2-one
50- Identifier les orbitales frontières de la pent-3-èn-2-one. Pour cela
détailler le calcul du
nombre d'électrons de type 313.
51- Lors de la réaction de la pent-3-èn-2-one avec un nucléophile, quelles
orbitales faut-il
considérer ? Justifier.
52- Sur quel atome de la pent-3-èn-2-one l'attaque nucléophile se fait-elle ?
Justifier et
conclure quant à la régiosélectivité de la réaction donnant E.
53- Donner la structure des composés E, L et M .
54- Proposer en milieu acide, un mécanisme permettant d'expliquer la formation
de M.
55- Commenter le spectre infrarouge de &
Page 15/20 Tournez la page S.V.P.
Chimie 2011 Filière PC
IV) F onctionnalisation de M et synthèse de la dihydroclérodine
O
1) (%?CuMgBr 1) LiAIH4 )i\
M > E
_ +
2) CHZO 2) H3O , H2O APTS
3) (NH4+, Cl"), H20
1) 03
2) PPh3
1 NaBH
& : R 4 ) 4
2) H3O+, H2O
Fig. B4 -- Synthèse du composé &
l\_I est mis en présence de (CH2=CH)2CuMgBr L'intermédiaire anionique formé est
piégé
par du méthanal ce qui permet la formation, après hydrolyse acide, de E. E est
ensuite traité
par le tétrahydruroaluminate de lithium (LiAlH4). Le diol Q formé après
hydrolyse acide
réagit avec la propanone en milieu acide (APT S) pour conduire au composé I_'.
L 'ozonolyse
de I_) suivi d 'un traitement réducteur a l 'aide de PPh3 conduit a la
formation de Q qui réagit
avec le borohydrure de sodium (NaBH4) dans le méthanol pour conduire, après
hydrolyse
acide modérée, a E. Ce composé est ensuite transformé en 5 a l'aide d 'une
suite de réactions
non étudiées ici.
5 est ensuite traité par un excès d 'anhydride éthanoi'que en présence de 4-
diméthylaminopyridine (DM/IP) en quantité catalytique et de pyridine. Le
composé ! formé
est ensuite transformé en dihydroclérodine.
56- Donner la structure des composés E et E.
57- Proposer un mécanisme pour la transformation de Q en E.
58- Indiquer les conditions opératoires précises permettant d'obtenir le
composé £ avec
un bon rendement.
59- Donner la structure des composés Q et B.
Page 16/20
Chimie 2011 Filière PC
60- En en décrivant les inconvénients éventuels, proposer une méthode pour
transformer
le composé B en composé &.
61- Donner la structure de I.
62- Proposer un mécanisme pour expliquer la formation de I.
63- Quel réactif proposeriez-vous pour réaliser la dernière étape transformant
1 en
dihydroclérodine ? À quel type de réaction correspond cette dernière étape ?
Page 17/20 Tournez la page S.V.P.
Données:
Constante d'Avogadro : NA= 6,0.1023 mol'l.
Constante des gaz parfaits :R= 8,3 J.K'l.mol'1
Constante de Nernst à 298 K : Æln10 = 0,06V
F
Numero atomique : Z(N) = 7 ; Z(O) = 8.
Potentiels standard des espèces dissoutes à pH= 0 :
Constante d'autoprotolyse de l'eau : KEUR = 10'14
Constantes d'acidité : K,OENH30H/NH20H) = 10'6 ; KA(NH4+ /NH3) = 109"2
2,5
--f(x)=lnx
2
1,5
1
0,5
0
1 2 3 4 5 6 7 8 9 10
Approximations numériques : w/_ » % w/_ ... --
(1)
(Z)
(3)
Chimie 2011 Filière PC
ANNEXE I
Table des nombres d'onde de vibrations de valence et de déformation.
Liaison... Nature Nombre d'onde (cm--1) Intensitém
O--H alcool libre Valence 35 80--3 670 111 ; fine
O--H alcool lié Valence 3200--3400 F ; large
N--H amine primaire : 2 bandes Valence 3 100--3 500 m
amine secondaire : 1 bande
influe
N--H amide Valence % 100--3 500 F
Cdig--H Valence 3300--33 10 111 ou f
C...g--H Valence 3000--3 100 m
C...g--H (composé aromatique) Valence 3030--3080 111
Ci...--H Valence 2800--3000 F
C...g--H (aldéhyde) Valence 2750--2900 111 ; 2 bandes
O--H (acide carboxylique) Valence 2500--3200 F à 111 ; large
CEC Valence 2100--2250 f
CEN Valence 2120--2260 F ou 111
C=O (anhyd1'ide) Valence 1700--1 840 F ; 2 bandes
C=O (chlorure d' acide) Valence 1770--1820 F
C=O (ester) Valence 1700--1740 F
C=O (aldéhyde et cétone) Valence 1650--1730m F
C=O (acide) Valence 1680--1 710 F
C=O (amide) Valence 1650--1700 F
C=C Valence 1625--1685 111
C=C (aromatique) Valence 1450--1600 variable ; 3 ou 4 bandes
N=O Valence 1510--1580 et 1325--1365 F ; 2 bandes
C=N Valence 1600--1680 F
N--H (amine ou amide) Deformaîion 1560--1640 F 011111
Ctéu--H Déformation 1415--1470 F
Créa--H (CH3) Déformaï1'on 1365--1385 F ; 2 bandes
P=O Valence 12 50--1 110 F
C--O Valence 1050--1450 F
C--N Valence 1020--1220 111
C--C Valence 1000--1250 F
C--F Valence 1000--1040 F
tétr : térragonal ; trig : trigonal ; dig : digonal
F =f0rï ; m : moyen ; f : faible
abaissement de 20 à 30 cm"1 si conjugaison
Page 19/20
Tournez la page S.V.P.
ANNEXE II
Table de valeurs de déplacements chimiques en RMN IH.
Déplacements chimiques moyens de quelques types de protons
(5 est exprimé en ppm par rapport au TMS pris comme référence)
R est un groupe aliphatique saturé ; Ar est un groupe aromatique.
Protons C H 5
Protons CHZ
Proteus CH
Lié à un C AX3 :
CHyC
CHyC:NH3 (ou NR3)
CHyCA1'
CHy(ËOH(OU OR)
Lie' à un C AX3 :
CHyC
CH3foNH3 (ou NR3)
CHyCA1'
CHyGOH(OU OR)
Lié à un C AX3 :
(:ch
CHÏCf0H(OH OR)
CH('('1
En (1 d'une insaturation:
En 0! d'une insaturation:
En (1 d'une
insaturation:
CHyC:C
CH3COOR
CHyCOOH
CHYCOfNHE(OU NRJ)
cnfl:cc:o
CHyCOR
emm--
CHyCOAI
CHyC:C
CHyCEC
CH3--COÏOR
('H3--CO--OH
CH5CONH; (ou NRJ)
cmc=cc=o
CHg--COR
CHyA1'
CHyCOAI
CHC:C
CHCEN
CH£'O--OH
CHCOR
CHfA1'
CH(ÏOfo
Lié à un hétéroatome
CHyNH3(011 NRJ)
CHyNH('OR
CHyOR
CHyOH
CH3--OCOR
CHyOA1'
CHyNO;
Protons liés à un C insaturé:
--CECH
,Ç:CH,
ArH
133,1
4560
658,2
(beuzène :
7.27)
95400
91105
Lié %: un hétéroatolne
CHyNH;(
