Mines Chimie PC 2010
| Thème de l'épreuve | Zircon et zirconium |
| Principaux outils utilisés | atomistique, solutions aqueuses, cristallographie, cinétique, thermochimie, chimie organique, polymères |
| Mots clefs | zircon, zirconium, fluviricine, PMAM, polyméthacrylate de méthyle |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
A 2010 Chimie PC
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIERE TSI)
CONCOURS D'ADMISSION 2010
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2010 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
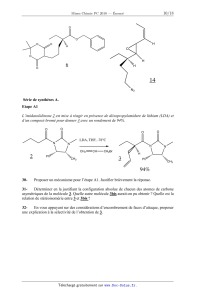
L'énoncé de cette épreuve, particulière aux candidats de la filière PC,
comporte 18 pages.
·
·
·
·
Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
Les candidats ne devront pas hésiter à formuler des commentaires succincts qui
leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
Le barème tiendra compte de la longueur de l'énoncé.
Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une erreur
d'énoncé, il
est invité à le signaler sur sa copie et à poursuivre sa composition en
expliquant les raisons
des initiatives qu'il aura été amené à prendre.
Page 1/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
DEBUT DE L'ENONCE
ZIRCON ET ZIRCONIUM
Remarque: Dans la plupart des cas, on s'intéresse aux ordres de grandeur des
quantités
impliquées. Si cela est nécessaire, le candidat fera donc des approximations
raisonnables
permettant une simplification des calculs.
Le zircon est un minéral commun de composition chimique nominale ZrSiO4 qui
cristallise le plus souvent lors de la formation des roches terrestres, à
partir d'un liquide
silicaté à haute température. Principal minerai de zirconium, le zircon
présente quelques
propriétés remarquables qui en font un minéral particulièrement utile en
géologie.
Structure du zircon
Le zircon cristallise dans le système quadratique, c'est-à-dire que la maille
est un
parallèlépipède rectangle à base carrée. On donne a=b= 6,6·10
-10
m, c= 6,0·10
-10
m. La
population de la maille est de 4 unités de formule.
1-
Donner la structure électronique dans l'état fondamental des atomes de Zr et Si.
Enoncer les règles utilisées (ZZr = 40 et ZSi=14).
2-
Les charges formelles des ions dans le zircon sont respectivement -2, +4 et +4
pour
l'oxygène, le silicium et le zirconium. Expliquer pourquoi ces états de valence
sont favorisés.
3-
Définir le rayon ionique.
4-
Dans le zircon, les distances Zr-O et Si-O sont respectivement d(Zr-O) = 2,2·10
10 m
-
-
-
et d(Si-O) = 1,6·10 10 m. Le rayon ionique de l'ion Zr4+ est de 0,85·10 10 m.
Calculer le rayon
ionique de l'ion Si4+. La coordinence du silicium dans le zircon est de 4 :
qu'est-ce que cela
signifie?
Page 2/18
Chimie 2010 Filière PC
5-
Rappeler ce qu'est un réseau cristallin. Définir ses éléments constitutifs
(noeud,
maille).
6-
La maille conventionnelle du zircon est centrée. Qu'est-ce que cela signifie?
Combien
de noeuds cette maille contient-elle?
7-
Les minéraux "lourds" dont la densité est supérieure à celle du quartz (SiO2,
densité :
2,65) se concentrent naturellement sur certaines plages, formant des gisements
exploitables
("placers"). Est-ce le cas du zircon? (MZr= 91 et MSi=28).
Enthalpie libre de formation du zircon à partir des oxydes: mesure de solubilité
La mesure de l'enthalpie libre de formation du zircon peut se faire précisément
à partir d'une
mesure de sa solubilité dans l'eau à haute température (800°C) et haute
pression. Cependant,
on négligera ici l'effet de la pression. Du fait de la solubilité très faible
de l'oxyde de
zirconium cristallin (ZrO2(s)), celui-ci précipite et dans ces conditions il
est possible de
considérer que la seule espèce existant en solution est la silice (SiO2(aq)).
NB : Les conditions physico-chimiques dans cette partie sont telles qu'une
description
réaliste des équilibres fait appel à « l'activité » des espèces. Il suffira de
remplacer, terme
pour terme, concentration par activité dans les expressions des constantes des
équilibres pour
répondre aux questions.
8-
Ecrire la réaction de formation du zircon à partir des deux oxydes simples
correspondants. Montrer que l'enthalpie libre de formation du zircon à partir
des oxydes à
800°C peut être déduite d'une part d'une mesure de l'activité de SiO2(aq) d'une
solution en
équilibre avec un mélange de zircon ZrSiO4(s) et d'oxyde de zirconium ZrO2(s),
et d'autre part
de celle d'une solution en équilibre avec le solide SiO2 (s).
9-
A partir des données ci-dessous, calculer à 800°C l'enthalpie libre de
formation du
zircon à partir des oxydes simples. A cette température le zircon est-il plus
stable ou moins
stable qu'un mélange d'oxyde de zirconium et de silice en proportions
stoechiométriques?
Page 3/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
activité de SiO2(aq)
-
équilibre avec SiO2 (s)
7,5·10 3
équilibre avec ZrO2 (s) et ZrSiO4(s)
1,0·10 3
-
Incorporation d'impuretés dans les zircons naturels
Le zircon, comme les autres minéraux naturels, est susceptible d'incorporer
lors de sa
cristallisation des cations en faibles concentrations qui fournissent des
informations sur le
milieu de croissance et l'histoire géologique du minéral. Ces cations vont
occuper un site
cristallographique de la structure hôte en se substituant à un de ses cations
majeurs (Zr4+ ou
Si4+ dans le cas du zircon). Leur incorporation peut être modélisée à l'aide
d'un coefficient de
partage Di défini comme le rapport entre la concentration de l'élément i dans
le minéral et
celle dans le milieu de croissance, en considérant que le solide et le liquide
sont en équilibre
thermodynamique. Ces concentrations sont exprimées en mg/kg.
Pour une série d'ions de même charge, leurs coefficients de partage sont
modélisés par la
relation suivante :
Di=D0 exp (-2! NA Em r0(ri-r0)2/RT)
où r0 correspond au rayon ionique optimal du site, D0 est le coefficient de
partage maximal,
Em est le module d'Young du minéral (Em est proportionnel à l'inverse de la
compressibilité,
pour le zircon on prendra Em=2.1011 Pa), NA le nombre d'Avogadro, ri le rayon
ionique du
cation en trace, R la constante des gaz parfaits et T la température.
10-
Montrer que l'argument de l'exponentielle est bien sans dimension.
11-
Les cations susceptibles de s'incorporer de façon significative dans la
structure du
zircon sont notamment les cations tétravalents tels que :
-
-
-
Hf4+ (r=0,81·10 10 m), U4+ (r=1,00·10 10 m), Th4+ (r=1,05·10 10 m).
Page 4/18
Chimie 2010 Filière PC
Vont-ils se substituer plus facilement au silicium ou au zirconium? Justifier
votre réponse
sans calcul. Classer les trois ions en fonction de la facilité avec laquelle
ils s'incorporent au
zircon.
12-
-
En considérant que D0=3000 et ro=0,85·10 10m, calculer le coefficient de
partage de
l'uranium tétravalent à 930°C. L'uranium tétravalent aura-t-il tendance à se
concentrer dans le
zircon ou dans le milieu de croissance? En considérant qu'un liquide silicaté
naturel typique
contient environ 1 mg/kg d'uranium sous forme tétravalente, quelle sera la
concentration en
uranium d'un zircon en équilibre avec ce liquide? Pour simplifier le calcul on
prendra les
-
valeurs approchées 2!NA=4·1024 mol 1 et RT=10 kJ/mol.
Désintégrations radioactives de l'uranium et datation du zircon
Lors de sa croissance, le zircon incorpore de l'uranium. Celui-ci possède
naturellement deux
isotopes (238U et
235
U). Les chaines de décroissance radioactive de ces différents isotopes
conduisent respectivement à la formation de 206Pb et 207Pb.
13-
Rappeler ce qu'est un isotope. Quel est l'ordre d'une décroissance radioactive?
Dans ce
cas, la constante de vitesse " dépend-elle de la température?
14-
Ecrire l'équation décrivant l'évolution du rapport
235
U/238U des abondances en
235
U et
238
U en fonction du temps et des constantes de vitesse respectives "235 et "238.
Actuellement, le
-
rapport des abondances entre isotopes 235 et 238 (235U/238U) est d'environ 10
2. Montrer qu'il
y a deux milliards d'années, de l'uranium enrichi (235U/238U > 3%) était
naturellement
-
-
disponible ("235=0,98·10-9 an 1, "238=0,14·10-9 an 1).
15-
En considérant que la concentration initiale en plomb du zircon est nulle,
exprimer
l'évolution du rapport
207
Pb/206Pb des concentrations en
207
Pb et 206Pb dans un grain de zircon
en fonction du temps. On considérera ce grain comme un système fermé.
Page 5/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
16-
Connaissant la composition isotopique actuelle de l'uranium et les constantes de
vitesses de désintégration radioactives de l'uranium 235 et 238, montrer qu'une
mesure de la
composition isotopique du plomb actuellement présent dans ce grain de zircon
permet de
déterminer l'intervalle de temps entre sa formation et la période actuelle,
c'est-à-dire de dater
le minéral.
Amorphisation du zircon par auto-irradiation: aspects thermodynamiques
En raison des désintégrations radioactives de l'uranium U et du thorium Th
piégés dans sa
structure, le zircon est soumis à une irradiation interne permanente qui est
susceptible de
conduire à son amorphisation. Ce processus est analogue à celui que subirait
une matrice de
stockage de déchets nucléaires et fait donc l'objet de nombreuses études.
La dose d'irradiation reçue par le zircon s'exprime généralement en nombre de
désintégrations alpha par mg. Elle est fonction du temps et de la concentration
initiale en U
et Th du zircon. L'amorphisation du zircon est donc progressive et la plupart
des échantillons
naturels contiennent une certaine fraction de matériau amorphe. On s'intéresse
ici à la
variation d'enthalpie correspondant à l'amorphisation du zircon à température
ambiante.
17-
Définir ce qu'est un solide amorphe et citer un exemple courant de solide
amorphe.
18-
Définir l'enthalpie d'un système. Montrer qu'à pression constante, une mesure
calorimétrique correspond à une mesure de variation d'enthalpie.
On réalise l'expérience suivante: sur quatre échantillons naturels de zircon,
notés A,B,C,D,
ayant été exposés à des doses variables d'irradiation, on mesure la variation
d'enthalpie de
l'échantillon lors de sa chute dans un calorimètre placé à 1000°C.
L'échantillon est
initialement à température ambiante (23 °C). L'expérience est réalisée deux
fois de suite sur
le même échantillon et les valeurs obtenues sont notées "H1 et "H2 (Tableau ).
La précision
sur la valeur mesurée est de ± 4 kJ/mol. Une analyse des échantillons par
diffraction des
rayons X après expérience montre qu'ils sont tous totalement cristallins.
Page 6/18
Chimie 2010 Filière PC
#H1 (kJ/mol)
#H2 (kJ/mol)
0
129,4
128,1
2,1 x 1015
40
94,1
126,2
C
4 x 1015
65
72,6
125,6
D
5,8 x 1015
75
64,2
126,6
Ech.
dose (désintégrations
fraction amorphe xa
alpha/mg)
(%)
A
0,06 x 1015
B
19-
Ecrire le cycle enthalpique correspondant à l'expérience réalisée. A quelle
partie du
cycle correspond la variation d'enthalpie mesurée lors de la deuxième série de
mesures (#H2)?
Quelle grandeur caractéristique du zircon permet-elle de déterminer?
20-
Montrer que cette expérience permet de déterminer la différence d'enthalpie
entre un
zircon partiellement amorphe et un zircon cristallin à température ambiante.
Calculer
l'enthalpie d'amorphisation (passage de l'état cristallin à l'état amorphe) du
zircon à
température ambiante (on pourra s'appuyer sur un graphique). La
recristallisation du zircon
est-elle une réaction endothermique ou exothermique?
On s'intéresse à présent à la solubilité s du zirconium en solution aqueuse à
température
ambiante. Nous considérons le système simplifié où les seules espèces en
présence sont Zr4+,
Zr(OH)4(s) et Zr(OH)"5 , vérifiant les équations en solution :
(1)
Zr(OH) 4( s) = Zr 4+ + 4OH "
(2)
Zr(OH) 4( s) + H 2O = Zr(OH)"5 + H + de constante Ks2 =10
de constante Ks1 =10
-52
-18
Initialement, la solution est de concentration [Zr4+]= 10-4 mol.L-1 à pH=0. On
augmente
alors progressivement le pH par ajout de base.
21-
Définir la solubilité s du zirconium dans le système considéré.
22-
Calculer le pH de début de précipitation
Page 7/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
23-
Donner l'expression de la solubilité s en fonction de h=[H3O+aq].
24-
Déduire de la question précédente des valeurs approchées raisonnables de pHmin
et
(log(s))min, coordonnées du minimum de solubilité.
25-
Tracer log(s) en fonction du pH. On prendra une échelle de pH allant de 0 à 14.
Les
coordonnées des points remarquables seront indiquées, et les phénomènes
associés seront
brièvement décrits.
Des études ont montré que des espèces polynucléaires pouvaient exister dans le
système
8+
zirconium, notamment [ Zr4 (OH) 8 (H 2O)16 ] .
26-
A votre avis, cette espèce existe-t-elle en milieu acide ou en milieu basique ?
Justifier
simplement.
27-
La proportion de cette espèce par rapport à toutes les espèces en solution
est-elle plus
grande ou plus petite lorsque le système est plus dilué ? Justifier simplement.
28-
En sachant que les 4 ions zirconium sont placés sur les coins d'un carré,
proposer une
structure spatiale raisonnable pour cette espèce.
Page 8/18
Chimie 2010 Filière PC
SYNTHESE DE LA FLUVIRICINE B1
La Fluviricine B1 (1) est un antibiotique appartenant à la famille des
macrolactames. Nous
abordons dans ce sujet quelques étapes clés de sa synthèse, parue dans la
communication de
B.M. Trost et al., dans Angew. Chem. Int. Ed. Engl. 1997, 36, 1486-1488.
O
HN
1
29Combien d'atomes de carbone asymétriques la fluviricine B1 comporte-t-elle ?
En
déduire le nombre de stéréoisomères possibles de cette molécule. Est-il facile
d'en faire une
synthèse totale (justifier) ?
La molécule à l'origine de la synthèse est l'auxiliaire chiral imidazolidinone
2, utilisé car il
est facilement obtenu à partir de l'éphédrine, un composé naturel.
O
O
N
2
N
Ph
CH3
L'imidazolidinone 2 est utilisée dans deux séries de synthèses, A et B, menant
aux molécules
6 et 14, qui, mises à réagir en présence d'un complexe de palladium(0), donnent
la fluviricine
B1 recherchée.
Page 9/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
O
O
O
H
O
H
O
O
H
6
H
O
14
N3
Série de synthèses A.
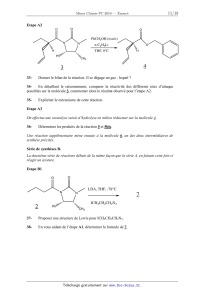
Etape A1
L'imidazolidinone 2 est mise à réagir en présence de diisopropylamidure de
lithium (LDA) et
d'un composé bromé pour donner 3 avec un rendement de 94%.
O
O
O
O
LDA, THF, -78°C
N
N
N
CH2
2
CH
CH2Br
Ph
H
3
CH3
N
Ph
CH3
94%
30-
Proposer un mécanisme pour l'étape A1. Justifier brièvement la réponse.
31Déterminer en la justifiant la configuration absolue de chacun des atomes de
carbone
asymétriques de la molécule 3. Quelle autre molécule 3bis aurait-on pu obtenir
? Quelle est la
relation de stéréoisomérie entre 3 et 3bis ?
32En vous appuyant sur des considérations d'encombrement de faces d'attaque,
proposer
une explication à la sélectivité de l'obtention de 3.
Page 10/18
Chimie 2010 Filière PC
Etape A2
O
O
O
PhCH2OH (excès)
N
N
n-C4H9Li
THF, 0°C
H
O
H
Ph
CH3
4
3
Donner le bilan de la réaction. Il se dégage un gaz : lequel ?
33-
34En détaillant le raisonnement, comparer la réactivité des différents sites
d'attaque
possibles sur la molécule 3, commenter alors le résultat observé pour l'étape
A2.
Expliciter le mécanisme de cette réaction.
35-
Etape A3
On effectue une ozonolyse suivie d'hydrolyse en milieu réducteur sur la
molécule 4.
Déterminer les produits de la réaction 5 et 5bis.
36-
Une réaction supplémentaire mène ensuite à la molécule 6, un des deux
intermédiaires de
synthèse précités.
Série de synthèses B.
La deuxième série de réactions débute de la même façon que la série A, en
faisant cette fois-ci
réagir un azoture.
Etape B1
O
O
LDA, THF, -78°C
N
2
N
7
ICH2CH2CH2N3
Ph
CH3
37-
Proposer une structure de Lewis pour ICH2CH2CH2N3.
38-
En vous aidant de l'étape A1, déterminer la formule de 7.
Page 11/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
Etape B2
LiAlH4, THF, 0°C
8
7
39-
+
8'
Donner l'équation bilan de la réduction de l'éthanoate de propyle par LiAlH4.
40Sachant que l'amide 7 réagit de façon analogue à un ester, donnant ainsi une
amine et
un alcool au lieu de deux alcools, déterminer l'alcool 8 et l'amine 8'.
Etapes B3 et B4
L'alcool 8 est oxydé en aldéhyde 9.
41en 9.
Donner des conditions opératoires permettant d'effectuer la réaction
d'oxydation de 8
On effectue ensuite la réaction suivante :
CO2C2H5
(C2H5O)2P(O)CH2CO2C2H5
9
H
NaH
H
10
N3
Etapes B5 et B6
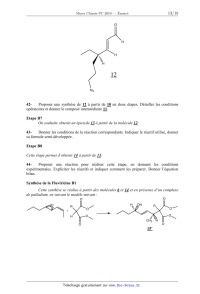
Ces étapes mènent à la molécule 12.
Page 12/18
Chimie 2010 Filière PC
O
H
H
H
12
N3
42Proposer une synthèse de 12 à partir de 10 en deux étapes. Détailler les
conditions
opératoires et donner le composé intermédiaire 11.
Etape B7
On souhaite obtenir un époxyde 13 à partir de la molécule 12.
43Donner les conditions de la réaction correspondante. Indiquer le réactif
utilisé, donner
sa formule semi-développée.
Etape B8
Cette étape permet d'obtenir 14 à partir de 13.
44Proposer une réaction pour réaliser cette étape, en donnant les conditions
expérimentales. Expliciter les réactifs et indiquer comment les préparer.
Donner l'équation
bilan.
Synthèse de la Fluviricine B1
Cette synthèse se réalise à partir des molécules 6 et 14 et en présence d'un
complexe
de palladium, en suivant le modèle suivant :
O
O
O
H
R
+
H
OH
R
O
O
O
O
CH3
H
O
O
15'
Page 13/18
Tournez la page S.V.P.
Chimie 2010 Filière PC
45La synthèse de la molécule 15' peut être réalisée à partir des mêmes
réactifs, en milieu
basique et en l'absence de complexe de Palladium. 15' n'est alors pas
majoritaire dans ces
conditions. Donner le mécanisme de la réaction en milieu basique, en rendant
compte des
principaux produits pouvant être formés.
46Proposer une interprétation de l'action du complexe de palladium utilisé,
sachant
qu'un alcène peut facilement remplacer un des ligands en formant une liaison
entre Pd(0) et le
système !.
LE POLYMETHACRYLATE DE METHYLE (PMAM)
Le polyméthacrylate de méthyle (PMAM) est le polymère qui constitue le
Plexiglas ou
l'Altuglas. Le monomère correspondant, noté MAM est actuellement de plus en
plus préparé
en présence d'un catalyseur formé d'un complexe de Palladium.
HC C CH3 + CO + CH3OH
[PdL2]
OMe
MAM
O
Cinétique de la polymérisation radicalaire
La polymérisation la plus utilisée industriellement à l'heure actuelle est
celle initiée
par une espèce radicalaire. On note A2 l'amorceur, et M le monomère. Le
mécanisme de la
réaction se présente alors sous la forme :
Phase 1:
A2 ! 2 A!
A! + M ! AM!
Phase 2:
AM!+M!AM2!
AM2!+M!AM3!
--------------------------AMj-1! + M ! AMj!
Phase 3:
AMj! + AMi! ! AMj+iA
k0
k1
(0)
(1)
k2
k3
kj (j"1)
(j)
kt (i#j) et k't=kt/2 (i=j)
La réactivité des intermédiaires réactionnels AMj! étant sensiblement la même
quel que soit j,
on supposera que toutes les constantes de vitesse kj (j!1) sont égales à une
constante notée kp.
On supposera que [AMj!]! 0 lorsque j! $
Page 14/18
Chimie 2010 Filière PC
47Comment appelle-t-on ce type de mécanisme ? Justifier. Quelles en sont les
étapes
caractéristiques ?
Aucun des intermédiaires réactionnels ne s'accumulant au cours de la réaction,
on peut leur
appliquer l'approximation des états quasi-stationnaires (AEQS).
48Déterminer l'expression de la vitesse d'apparition v+(AM!) du radical AM! en
fonction de la concentration en A2 et de la constante de vitesse k0.
49-
$"
'2
·
Démontrer la relation 2k 0 [ A2 ] = k t &&# AM i ))
% i=1
(
[
]
50En déduire l'expression de la vitesse de consommation du monomère M en
fonction
de k0, kp et kt, [M] et [A2].
Etude de la polymérisation anionique
La première étape de la polymérisation anionique est la suivante :
Li+,
O
+
O
O
+ Li+
O
51En écrivant des formules mésomères, mettre en évidence les différents sites
électrophiles du méthacrylate de méthyle.
52Dans l'hypothèse où on peut appliquer l'approximation des orbitales
frontières à la
réaction d'amorçage, et sachant que l'on peut modéliser les orbitales
moléculaires du
méthacrylate de méthyle par celles de l'acroléine (voir les données en annexe),
justifier la
régiosélectivité de la première étape de la polymérisation.
53-
En gardant la même régiosélectivité, donner la formule générale du PMAM.
54Discuter de la stéréorégularité, ou tacticité, du PMAM obtenu par
polymérisation
anionique.
Etude d'un polymère PMAM.
La température de transition vitreuse du PMAM est de 105°C.
55Qu'est-ce que la température de transition vitreuse ? De quoi dépend-elle
principalement ?
56-
Sous quelle forme le PMAM se trouve-t-il à température ambiante ? et à 110°C ?
Page 15/18
Tournez la page S.V.P.
Chimie 2010 -- Filière PC
57- L'indice de polymolécularité atteint pour la synthèse radicalaire du PMAM
vaut
presque 2, alors qu'il est compris entre 1 et 1,1 pour une synthèse anionique.
Définir l'indice
de polymolécularité, proposer une explication pour la différence observée entre
les deux types
de synthèse.
Soit un échantillon de polymolécularité ] : la détermination de la masse
molaire du PMAM
peut se faire par osmométrie.
Deux compartiments A et B sont séparés par une membrane semi splitéable ne
laissant
passer que les molécules de solvant, les polymères demeurant dans le
compartiment dans
lequel ils ont été introduits. Le compartiment A contient ainsi du benzène pur,
et le
compartiment B du benzène et du PMAM
Du solvant passe alors du compartiment A au compartiment B, et lorsque
l'équilibre est
atteint, la dfiérence de niveau de liquide entre les deux compartiments atteint
une hauteur h.
La pression extérieure vaut PO=I bar.
58- Donner l'expression de la dérivée partielle du potentiel chimique d'un
corps i dans un
, , . ôu,
melange, par rapport a la press1on .
ôP T'n_
59- En supposant le mélange idéal, donner l'expression du potentiel chimique du
benzéne
dans le compartiment B, ubenzène (T ,P) en fonction du potentiel chimique
standard du benzène
pur uZenzêne(T,P°), de la fraction molaire du polymère Xp, de la température T,
de R et du
volume molaire du benzéne Vm benzène, supposé indépendant de la pression.
On suppose que la masse volumique est la même dans les compartiments A et B,
égale à celle
du benzène pbenZène = 8800 kg.m". On considèrera que la pression est uniforme
dans chacun
des deux compartiments A et B.
Page 16/18
Chimie 2010 Filière PC
60Ecrire la condition d'équilibre chimique pour le solvant à la température T
entre les
compartiments A et B. En déduire une relation entre R, T, $benzène, g la
constante de
gravitation, h, Vm benzène et xP.
61Soit cP la concentration du polymère en masse par unité de volume et MP sa
masse
molaire. Déduire de la relation précédente, dans l'hypothèse où la solution est
suffisamment
diluée pour que le volume total soit égal à celui du benzène, la relation
donnant la masse
molaire du polymère :
R.T .c P
MP =
! .g.h
62Rappeler ce qu'est le degré de polymérisation n du polymère, et donner la
relation
permettant de le calculer à partir de sa masse molaire MP.
63-
Pourquoi cette méthode ne peut-elle pas être utilisée dans le cas d'un polymère
de
polymolécularité différente de 1 ?
Page 17/18
Tournez la page S.V.P.
Annexes:
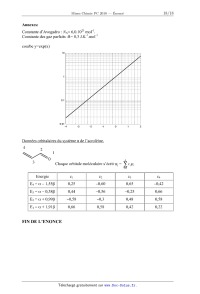
Constante d'Avogadro : NA= 6,0.1023 mol'l.
Constante des gaz parfaits :R= 8,3 J .K'1.rnol'1
courbe y=exp(x)
4
Chaque orbitale moléculaire s'écrit \|Jj = E cirpl.
1
i
| Energie | 01 | 02 | C3
| E4 = oc -- 1,556 | 0,25 | --0,60 | 0,65
| E3 = oc -- 0,386 | 0,44 | --0,56 | --0,25
| E2 = oc + 0,996 | --0,58 | --0,3 | 0,48
| E1= oc + 1,916 | 0,66 | 0,58 | 0,42
FIN DE L'ENONCE
--0,42
0,66
0,58
0,22
