Mines Chimie PC 2007
| Thème de l'épreuve | Étude de l'enzyme flavocytochrome b2. Synthèse d'un inhibiteur enzymatique. |
| Principaux outils utilisés | atomistique, cinétique, oxydoréduction, chimie organique |
| Mots clefs | enzyme, Michaelis, flavocytochrome, théorie de Marcus |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
A 2007 Chimie PC
ECOLE NATIONALE DES PONTS ET CHAUSSÉES,
ECOLES NATIONALES SUPERIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE,
DE TECHNIQUES AVANCÉES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNICATIONS DE BRETAGNE
ECOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2007
CHIÆ
Filière : PC
(Durée de l'épreuve : 4 heures)
Sujet mis à disposition des concours :
ENSTIM, INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2007 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'e'nonce' de cette épreuve, particulière aux candidats de la filière PC,
comporte 14 pages.
' Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
' Les candidats ne devront pas hésiter à formuler des commentaires succincts
qui leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
' Le barème tiendra compte de la longueur de l'énoncé.
' Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une
erreur d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
DEBUT DE L'ENONCE
PARTIE A : Etude de l'enzyme flav0cyt0chrome b2
On s'intéresse a la structure et a quelques propriétés de l'enzyme
flavocytochrome b2 de
Saccharomyces Cerevisiae (levure de boulanger). Aucune connaissance relative a
la chimie
des enzymes n 'est requise a priori pour traiter cette partie.
1. Structure des enzvmes et propriétés
L 'enzymeflavocytochrome b2 montre une activité catalytique en présence de deux
coenzymes
d'oxydoréduction : une flavine mononucléotide (notée FMN sous sa forme oxydée)
et une
métalloporphyrine (cytochrome b). Ces molécules, de faible masse moléculaire
comparée a
celle de l'enzyme, sont représentées ci-a'essous.
OHO
HO \/%O
Cytoehrome b
Figure la
o:P--OH
OH
flavine mononueléotide (FMN)
Figure lb
Etude de la partie protéique de l'enzyme flav0cytochrome b2
Dans cette partie, on s'intéresse a la partie protéique de l'enzyme constituée
par un
enchaînement linéaire d'acides oc--aminés. Ces derniers ont en commun cl 'étre
des molécules
bifonctionnelles portant un groupement -NH2 sur le carbone porteur du groupe
--COOH
(appelé carbone oc).
Page 2/14
Chimie 2007 Filière PC
Leur formule générique est :
O
H2N--(l3H--C--OH
R
Le groupe R est un résidu variable que l 'on nomme chaîne latérale, par exemple
dans le cas
de l'alanine le groupe R est un méthyle, pour la sérine il s 'agit d 'un groupe
--CH20H
1- Lors de la condensation de deux acides aminés, quelle est la fonction
organique créée '?
2- Si on qualifie les protéines de polymères dont les unités de répétition sont
les acides
aminés, quel est alors leur polymolécularité '?
3- Citer et décrire brièvement les différentes forces intermoléculaires a
l'origine de la
structure tridimensionnelle des protéines. La réponse n'excédera pas une
demi--page.
Etude des coenzymes.
Etude du cytochrome !)
4- Citer et énoncer les règles permettant d'établir la structure électronique
d'un atome dans
son état fondamental. En déduire la structure électronique de l'atome de fer
dans son état
fondamental (Z = 26).
5- Préciser la configuration électronique dans l'état fondamental de Fe2+ et de
Fe3+_
6- Préciser en le justifiant le degré d'oxydation du fer dans le cytochrome b.
On donne ci-
dessous la formule de la molécule de cytochrome b non métallé. NB : le
cytochrome b est
électriquement neutre.
Page 3/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
OHO
Etude de la avine mononucléotide FMN
La flavine mononucléotide (FMN) se rencontre sous trois états d'oxydation :
7- Ecrire les demi--équations redox correspondant aux réductions successives de
la FMN.
8- Parmi ces différentes formes de la FMN, existe-t-il des structures
aromatiques dont les
électrons :n: sont délocalisés sur les trois cycles ? Justifier.
II. Cinétique enzymatique
Aggroximation du quasi-équilibre.
La vitesse d 'une réaction en catalyse enzymatique, dans laquelle un substrat S
est converti en
un produit F, dépend de la concentration de l'enzyme E, bien que celle-ci ne
subisse pas
globalement de modification.
Pour la réaction suivante :
catalyseurE
s _» P
on définit la vitesse de la réaction comme étant la vitesse d'apparition du
produit P.
Page 4/14
Chimie 2007 Filière PC
En 1913 (Biochem, Zeitschrift 49, 333 (1913)), Michaelis et Menten ont proposé
un schéma
simplifié en deux étapes. Ces auteurs ont fait l 'hypothèse que dès l'addition
de l 'enzyme il
s'établit un équilibre rapide entre les formes libres de l'enzyme et du
substrat (E et S) et le
complexe enzyme--substrat (ES), appelé complexe de Michaelis et Menten qui
réagit ensuite
avec une constante de vitesse du premier ordre kcal (étape limitante).
L'équilibre de
dissociation du complexe enzyme--substrat est caractérisé par sa constante de
dissociation
K5.2
l) équilibre rapide S+ E :* ES K ); 1 /K 8
kcat
2) étape lente E S --> P + E
9- On note [E ]0 la concentration initiale en enzyme. A l'aide de l'écriture de
la constante
de dissociation et en considérant la conservation de l'enzyme, montrer que l'on
peut
exprimer la vitesse v de la réaction en fonction de la concentration en
substrat :
vmaX [S]
[S]+ K S
V:
Donner l'expression de vmaX en fonction de k..., et de la concentration
initiale en enzyme [E]().
10- Quelle est la limite asymptotique de v lorsque [S] --> oo ? Retrouver par
un raisonnement
physique l'expression de cette limite
11- Tracer l'allure de v = f([S]). Comment peut-on utiliser ce graphe pour
avoir accès
expérimentalement à vmaX et K5 ? Cette méthode est-elle précise ? Pourquoi ?
12- Montrer que le tracé de l/v en fonction de 1/ [S] permet d'accéder plus
précisement à vmaX
et K5.
Approximation de l'état quasi-stationnaire
Briggs et Haldane ont développé un mécanisme plus général (Biochem. J., 19, 338
(1925)),
ils ont montré qu'il ne s'établit pas forcément pour toutes les enzymes un
équilibre rapide
entre les formes libres de l 'enzyme et du substrat (E et S) et le complexe
enzyme-substrat
(ES). Dans leur modèle, après un court délai, c'est la concentration du
complexe enzyme-
substrat ES qui est constante.
k1
S+E 4_' ES
k1
k2
ES --> P+E
Page 5/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
13- Déterminer l'expression de la vitesse globale de ce schéma, l'écrire sous
la forme :
V..., [S]
v = _
[S ]+ K M
14- Expliciter KM (constante de Michaelis relative au substrat) et vmax en
fonction des
constantes de vitesse du modèle de Briggs et Haldane.
15- Dans quel cas les constantes KM et K5 sont--elles égales '?
En pratique, il n'est pas toujours aisé de connaître la concentration en
substrat libre [S]
dans la solution. Afin de déterminer expérimentalement KM et v,,... on effectue
alors une série
de mesures de la vitesse initiale pour différentes concentrations choisies en
substrat.
16- Quelles sont les hypothèses et conditions expérimentales à vérifier pour
que cette
méthode soit valide '?
17- Le produit P est la seule espèce présente à absorber la lumière à une
longueur d'onde ?...
située dans le visible. Proposer un protocole expérimental détaillé permettant
de
déterminer K M et v,,....
Pour le couple enzyme--substrat étudié, c'est--à-dire flavocytocbrome b2 et
pyruvate, on
réalise une série de mesures de vitesse de réaction (initiale) en fonction de
diverses
concentrations initiales choisies en pyruvate :
[pyruvate]o ( umol.L" ) 5 10 50 500 1000
va (mmol.L".s") 11,7 17,5 29,2 34,3 34,7
le tracé de l/v0 en fonction de l/[pyruvate]o est représenté ci-dessous
0,09
0,08
0,07
0,06
0,05
0,04
0,03 .
1/vo (/L.S.mmol'l)
0,02
0,01
0
0 0,05 0,1 0,15 0,2 0,25
1/[pyruvate]o (/ L.umol'l)
18- Déterminer graphiquement vmax et KM.
Page 6/14
Chimie 2007 Filière PC
111. Transfert électronique
On donne ci--a'essous le cycle catalytique de l'enzyme lors de sa réaction sur
le ( +)--lactate
Cette réaction nécessite l'intervention de molécules de cytoclzrome c (noté Cyt
cox sous sa
forme oxyde'e et Cyt cred sous sa forme réduite).
Lactate Cyt cOX
FMN * Cyt b
Pyruvate n1.e Cyt Cred
Étape Cyt Cred Lactate
cinétiquement / FMN
facile __ Etape 1
6008-1
Cyt Co Pyruvate
FMNH2
Cyt bred Cyt box
Etape 4 Etape 2
120 S'1 15005"1
FMNH Etape3 FMNH
Cÿt box /\ Cyt bred
Cyt Cred Cyt Cox
Étape
cinétiquement
facile
Les valeurs des constantes cinétiques ont été obtenues et 25°C et a pH = 7,5.
Toutes les expériences sont réalisées et cette température et a ce pH grâce a
un milieu
tamponne'.
On donne les potentiels standard de certains couples dans l'enzyme :
E2MN (FMN/FMNH) = - 45 mV
E}ïMNH (FMNH/FMNHg) = - 135 mV
E£( Cyt bOX / Cyt boed ) = - 3 mV
Ef (Cyt COX / Cyt cred) = 220 mV
Page 7/ 14 Tournez la page S.V.P.
Chimie 2007 Filière PC
19- Ecrire l'équation chimique de l'oxydation du lactate (C3H503_) en pyruvate
(C3H303_)
catalysée par l'enzyme.
On s intéresse et la cinétique du transfert d électron de l 'étape 4,
c'est-d-dire la réduction de
Cyt box par FMNH que l 'on considèrera indépendamment des autres étapes:
k4
Cyt box + FMNH Î> Cyt b...1 + FMN + H+
L 'ordre global de la réaction directe est 1 ainsi que l'ordre global de la
réaction inverse. On
considère que l'ordre partiel par rapport aux ions hydronium est nul.
On note ca la concentration initiale en enzyme, on a initialement co = [Cyt
box]0 = [FMNH]g
20- Justifier que les concentrations en Cyt bOX et FMNH sont égales durant la
réaction.
Montrer alors que la concentration de FMN peut se mettre sous la forme :
t
[FMN] = [FMNLq 1 -- e_5
21- Exprimer "54 en fonction de la et k_ 4. Déterminer l'expression de [FMN]eq.
. , . l _
Lors de l'étape 4 on détermme exper1mentalement -- = 120 s 1 .
174
22- Dans le cycle catalytique, quelle est l'étape cinétiquement déterminante '?
Justifier.
Les variations de la constante de vitesse la en fonction de A,,Gî de la
réaction de transfert
monoélectronique sont données par l'équation de Rudolph A. Marcus (Prix Nobel
de Chimie
en 1992) :
--(AÏGÏ+À)2
_ 4ÀRT
k4 -- Ce
ou À est une grandeur positive appelée énergie de réorganisation ;
2_"@2 +
n J4nAkT '
® est un facteur électronique qui ne dépend que de la nature des centres d
'oxydoréduction
en présence.
Cette relation présente l'intérêt de relier une grandeur cinétique (k4) et une
grandeur
C est un facteur dont l 'expression est la suivante : C =
thermodynamique (A ,,Gî).
23- Donner l'expression de A,,GÏ en fonction des potentiels standard des
couples concernés
par la réaction.
Page 8/14
Chimie 2007 Filière PC
24- Déterminer l'expression de la constante de vitesse k_4 en fonction de A,,Gî
et 7». Donner
l'expression de la constante thermodynamique K 2 de la réaction de l'étape 4 a
partir de
A,,Gî puis en fonction des potentiels standard des couples concernés par la
réaction et de
la constante VT.
VT =Æz 26 mV.
F
25- Application numérique : calculer K 2 . En déduire k_4 et la. Pour
simplifier les calculs on
prendra ln 5 »-- Æ
1 3
26- Représenter ln k4 en fonction de -A,,Gî. Déterminer la valeur de -A,,Gî
pour laquelle
ln k4 est maximum. Montrer qu'on peut décrire cette courbe en termes de région
<< normale >> et de région << inverse >>.
A l'aide de manipulations biologiques on peut modifier l 'environnement en
acides aminés du
Cyt b, et donc son potentiel standard. Pour une valeur E0b,modif = -- 45 mV, on
observe que la
dépendance en température de la est de type Arrhe'nius avec E A = 24, ]
lclmol'l.
27- En déduire la valeur de ?» en eV (Donnée : 1 eV correspond a 96,5 k]
.mol'1).
28- Estimer numériquement la constante C en vous aidant d'un développement
limité
Donnée: e9 z 8.103.
La constante C dans l'expression de la dépend fortement de l'interaction entre
les deux
centres redox, son expression est du type :
C = C0e_/3d
d représente la distance entre les centres redox.
29- Sachant que CO = 8.107 s'1 et [J' = 4.109 m'1 , déterminer d. Commenter.
Donnée : lnlO z 2,3
Page 9/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
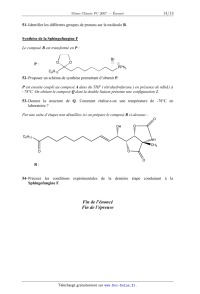
PARTIE B : Synthèse organique d'un inhibiteur enzymatique
La Sphingofungine F est un inhibiteur de l'enzyme Serinepalmitolyl transferase
qui joue un
rôle essentiel dans la biosynthèse des sphingolipides précurseurs des céramides
de la peau
qui restructurent la couche cornée comme un ciment et stimulent la fabrication
naturelle des
lipides. La Sphingofungine F dont la structure est précisée ci-dessous est un
dérivé oc--
substitué de l'alanine. Une synthèse stéréosélective a partir de l'acide
tartrique en a été
récemment publiée ( G. Q. Lin et coll., J. Org. Chem. 2000, 65, 9114) ; elle
est basée sur une
réaction de Wittig entre les deux fragments [ C1 --C6 ] et [ C 7--C20].
Sphingofungin F
B I [ C7-C20] A : [C1-C6]
Les deux séquences réactionnelles suivantes (indépendantes) décrivent la
synthèse
préliminaire des deux précurseurs de A (un époxyaldéhyde) et B (un alcool
primaire)
correspondant respectivement aux fragments [ C1 --C6 ] et [ C 7--C20 ].
Svnthèse du précurseur de A
Cette synthèse est effectuée a partir du ( + )--tartrate de diéthyle C
énantiomériquement pur :
EtO
OEt
30- Que signifie << synthèse stéréoséleetive >> ?
Page 10/14
Chimie 2007 Filière PC
31- Donner la configuration absolue des carbones asymétriques de la molécule C.
Combien
existe-t-il de stéréoisomères de configuration de C '? Les représenter à l'aide
de la
représentation de Cram et préciser les relations de stéréochimie qui les lient.
C est mis en présence d 'ace'tone avec une catalyse acide réalisée par l'acide
paratoluènesulfonique (noté T sOH), on obtient alors le composé D.
32- Quel est le nom de cette réaction '? Quel est a priori son intérêt '? Quels
sont les avantages
de TsOH par rapport a HCl '?
Préciser le mécanisme de cette réaction et donner une représentation développée
spatiale
de D.
D est traité par de l 'aluminohydrure de lithium en excès pour conduire au
composé E. Cette
réaction permet de réduire les fonctions ester en fonction alcool.
33- En considérant LiAlH4 comme un donneur d'ions hydrures H", proposer un
mécanisme
pour cette réaction. Donner la formule développée de E.
34- Comment peut-on passer de E àla molécule F représentée ci-dessous '?
\ \\\\""
O H
La fonction alcool de F est ensuite oxyde'e pour obtenir G selon une oxydation
de Swern. Il
s'agit d'une oxydation douce des alcools primaires et secondaires
respectivement en
aldéhyde et en ce'tone dans un milieu contenant du chlorure d 'oxalyle dans le
DMSO
(dimétbylesulfoxide) et de la trie'thylamine.
35- Citer un autre réactif possible pour cette oxydation. Représenter G.
Le composé G est ensuite dissous dans le dichlorométhane a 00EUR puis opposé au
composé Z
ci-dessous pour conduire et la molécule H obtenue majoritairement avec une
configuration
E. H est alors traité par LiAlH4 qui donne le composé 1.
COO Et
Z : où Ph représente le groupe phényl C6H5.
Ph3P--
36- Proposer une synthèse de Z a partir de l'acide 2-bromopropanoïque.
Page 11/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
37- Comment appelle-t-on la réaction menant à H '? Représenter la molécule H.
38- Représenter le produit 1.
L 'équipe de Sharpless, prix Nobel de chimie 2001, a mis au point une technique
d 'époxydation énantiosélective des alcènes , utilisant un complexe chiral du
titane. En
appliquant cette méthode au composé 1 on obtient un produit J dont la
configuration absolue
des deux nouveaux atomes de carbone asymétriques est S.
39- Citer un réactif classique d'époxydation des alcènes.
40- Représenter le produit J.
J est traité par le tert-butylchlorodimétbylsilyle ( T BDMSCI) en solution dans
le
dicblorométhane, en présence d 'imidazole. Il se forme alors le composé K.
/
TBDMSCI : /Cl Imidazole : N/\
3 w
NH
"-
41- Montrer que l'imidazole est un ampholyte et identifier les couples
acido-basiques
correspondant aux valeurs de pKA de 7,0 et 14,5 ; justifier. Montrer que les
deux atomes
d'azote sont en fait équivalents.
42- Où se trouve le silicium dans la classification périodique '? Quel est le
type de réaction
mise en jeu dans la formation du composé K '? Représenter K.
Le groupe protecteur --OBn (Bn=benzyle) est ensuite ôté pour rétablir la
liaison --OH, ce qui
donne le composé L ( C 16H3205Si). Le composé L est alors opposé au trioxyde de
chrome
dans la pyridine pour finalement conduire et la molécule A.
43- Représenter A. Quel est l'intérêt du groupe TBDMS '?
Svnthèse du précurseur de B
La synthèse de l'intermédiaire B nécessite l'intervention du
6--iodohexan--I--ol. Ce dernier est
transformé en M La préparation du composé M fait intervenir la réaction entre
le groupe
caractéristique OH d 'un alcool et le 3, 4-dihydro-2H--pyrane (dont le nom
systématique est 3--
oxacyclohéxène) noté DHP. On étudie la réaction modèle entre le méthanol et le
DHP, qui
conduit a la formation d'un produit d'addition du méthanol sur la double
liaison du DHP,
que l'on note H 3C--OT HP.
Page 12/14
Chimie 2007 Filière PC
H--l--
H3C-OH+ o _; H3C-OTHP Réaction(l)
DHP
44- Donner la structure de l'espèce cationique majoritairement obtenue quand le
DHP est
placé au contact d'un milieu acide, si l'évolution du système est sous contrôle
thermodynamique.
Par action du méthanol en excès, en solution dans l'éthoxyéthane anhydre et en
présence
d 'acide para--toluènesulfonique, le DHP est transformé en un composé H3C--OTHP
de
formule brute C6H1202.
45- Proposer un mécanisme pour la formation de H3C-OTHP.
46- La réaction (1) constitue une étape de protection de la fonction alcool.
Justifier cette remarque. Quels sont les produits obtenus lors de la
déprotection '?
47- Combien de stéréoisomères sont obtenus lors de la réaction (1) '? Les
représenter.
En quelles proportions les trouve-t-on '? Justifier le raisonnement...
48- En déduire la structure de M.
Le composé M est opposé au 3--oxononanoate de méthyle dans un mélange DMF
(diméthylformamide) et acétone en présence de K2CO3, l'ensemble est porté a
reflux pour
obtenir le composé N. Ce dernier est ensuite mis a reflux dans un mélange de
potasse
alcoolique pour former 0, on observe un dégagement gazeux.
49- Donner la formule topologique de N et proposer un mécanisme pour sa
formation.
50- Quel est le gaz formé lors de l'obtention de O '? Justifier les conditions
utilisées pour cette
étape au lieu des conditions classiques [(l) HO'aq./ MeOH, 25°. (2) H3O+ /
reflux)].
0 est ensuite déprotégé en milieu acide pour donner B.
L 'analyse RMN du composé B fournit les résultats suivants :
Déplacement chimique du spectre RMN du proton {dans CDCl3, 300 MHZ) :
N° Déplacement (ppm) intégration Allure du Couplage
signal (Hz)
(a) 0,87 3 H t 7,0
(b) 1,26-1,60 18 H m
(c) 2,37 4 H t 7,3
(d) 3,62 2 H t 6
Page 13/14 Tournez la page S.V.P.
Chimie 2007 Filière PC
51- Identifier les différents groupes de protons sur la molécule B.
Svnthèse de la Sphingofungine F
Le composé B est transformé en P :
/î Br
P : O 0 ©
@
>
