Mines Chimie PC 2006
| Thème de l'épreuve | Propriétés des alcalins. Synthèse de l'androstérone. |
| Principaux outils utilisés | atomistique, cristallographie, oxydoréduction, thermochimie, mélange binaire, chimie organique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
ECOLE NATIONALE DES PONTS ET CHAUSSEES.
ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE,
DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNICATIONS DE BRETAGNE.
ECOLE POLYTECHNIQUE ( Filière TSI ).
CONCOURS D'ADMISSION 2006
EPREUVE DE CHIMIE
Filière : PC .
Durée de l'épreuve : 4 heures
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis à la disposition des concours : Cycle International, ENSTIM, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2006 - PC
Cet énoncé comporte 15 pages de texte. Il est constitué de deux parties
indépendantes.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
DEBUT DE L'ENONCE
PARTIE A : STRUCTURE, REACTIVITE ET PROPRIETES DE
QUELQUES ALCALINS
Les éléments alcalins occupent la première colonne de la classification
périodique. Certains
d'entre eux sont relativement abondants puisque le sodium et le potassium
représentent
environ 5 % de la croûte terrestre.
Les éléments alcalins sont présents dans de nombreux domaines de la chimie et
on se
propose, ici d'en étudier certains aspects.
Les différentes sous--parties de la partie A sont indépendantes. Les données
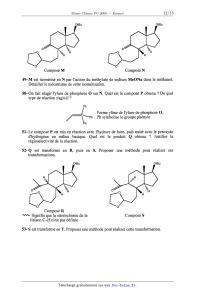
nécessaires à
la résolution des questions sont regroupées à la fin de l'énoncé de la partie
A. Les
valeurs numériques fournies ont été volontairement arrondies.
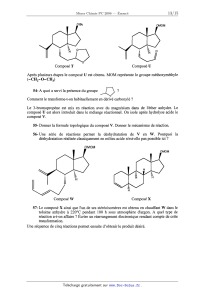
1. Structure et propriétés atomiques
l-Citer trois propriétés caractéristiques des métaux.
2-A l'état naturel, on ne trouve pas d'alcalin sous forme métallique :
justifier.
3--Quel est le degré d'oxydation courant des alcalins '? Justifier.
4-Comment évolue l'électronégativité d'un élément avec sa position dans la
classification
' périodique ? Quel est l'élément le plus électronégatif '?
5-Donner la structure électronique complète de l'atome de césium dans son état
fondamental et énoncer les différentes règles permettant de l'établir.
Il. Structures cristallines
Les métaux alcalins cristallisent en structure cubique centrée.
6--Décrire la structure cubique centrée en représentant la maille
conventionnelle du réseau
et calculer sa compacité (on prendra : Jt.\Æ == 5,6).
En chauffant le lithium dans l'air vers 200°C, on obtient de l'oxyde de lithium.
7-Quelle est la formule de l'oxyde de lithium '?
L'oxyde de lithium cristallise selon une structure de type « antifluorine >> :
il s'agit d'une
structure analogue à celle de la fluorine, mais les positions des anions et des
cations sont
interverties.
& Donner une description de la structure de l'oxyde de lithium.
9-- Indiquer le nombre et l'emplacement des différents sites de la maille
conventionnelle
associée au sous--réseau des anions. Exprimer leur dimension en fonction du
rayon
. . . 2- .
1omque de l'1on O . On admettra, pour cela, que les amons sont tangents.
10- En utilisant les données fournies à la fin de l'énoncé de la partie A,
déterminer la
valeur du rapport des rayons ioniques des ions lithium et oxygène. Où devraient
se
trouver les ions lithium et pourquoi ? Est-ce le cas ? Proposer une
justification simple.
11- Exprimer la masse volumique de l'oxyde de lithium en fonction du paramètre
a de la
maille et des masses molaires atomiques du lithium et de l'oxygène. Faire
. . , . 3 -22 3
l'application numer1que en prenant a = 1,0.10 cm .
III. Aspect thermodynamique
,A. Préparation du titane
Dans cette partie, les phases condensées sont supposées pures et les phases gaz
supposées
gaz parfaits. --
Les métaux alcalins étant très réducteurs, il est difficile de les obtenir par
des méthodes
classiques. En revanche ils permettent la préparation d'autres métaux à partir
de la forme
oxydée correspondante.
On s'intéresse àla préparation du titane métal à partir de son chlorure TiCl4 :
12-- Ecrire l'équation--bilan de la réaction de formation du chlorure de sodium
dans
l'intervalle de température [400 K, 1073 K] (notée réaction (l)), à partir de
sodium
(liquide) et de dichlore (gazeux).
13- En quoi consiste l'approximation d'Ellingham ?
14-- Donner, dans le cadre de cette approximation, l'expression numérique de
l'enthalpie
libre standard ArG°1(T) de la réaction (1) en fonction de la température, entre
400 K et
1073 K.
On considère de plus l'équation de réaction suivante :
Ti(s) + 2 Cl2(g) = TiCl4oe) (Réaction (Z))
pour laquelle : ArG°2(T) = - 800 + 0,120 T (en kJ.mol-l) sur l'intervalle de
température :
[409 K, 1933 K].
15- Ecrire l'équation--bilan de la réaction de réduction du chlorure de titane
par le sodium
à TO = 800 K (réaction (3)). On prendra pour le coefficient stoechiométrique de
TiCl4
la valeur 1. Déterminer la valeur du logarithme décimal de la constante
thermodynamique d'équilibre K°3 de cette réaction à la température TO = 800 K.
On
prendra : R lnlO = 20 avec R en unités S.1.
16- Industriellement, cette réaction est effectuée sous atmosphère d'argon.
Quelle est la
valeur minimale de la pression partielle en chlorure de titane qu'il faut
maintenir dans
le réacteur pour que la réduction de TiCl4 soit possible à TO = 800 K '?
B- Etude d'un mélange binaire
On considère le diagramme binaire eau--chlorure de lithium qui sera étudié sous
forme très
simplifiée sous la pression P = P° = 1 bar, dans le domaine de fraction molaire
x1 en chlorure
de lithium [O, 1/6]. Eau et chlorure de lithium sont miscibles à l'état liquide
et non miscibles à
l'état solide.
Pour la composition x1 = 1/6, il se forme un composé défini (à fusion
congruente) dont la
température de fusion vaut : T3 = - 64°C.
Le diagramme comporte un point eutectique de coordonnées : x15 = XE = 1/8 et T5
= - 75°C.
Les notations suivantes seront utilisées :
température de
fusion
Chaleur latente
en standard
hase li - uide de fusion molaire
-----_ '
--- _
défini
17- Quelle est la formule du composé défini ? Représenter schématiquement le
diagramme
binaire : préciser le nom des courbes ainsi que la composition qualitative de
chaque
domaine.
F raction molaire
Composé
On souhaite déterminer une valeur approchée de l'enthalpie standard de fusion
L°3 du
composé défini, supposée indépendante de la température dans le domaine
considéré, à partir
de l'étude de l'équilibre entre celui-ci et la solution.
18- En admettant que la solution est idéale, démontrer la relation suivante :
l l 1 l
lnxl+51n(l--xl)=a(î--î)+fi pour -8-SXIS"6'.
Donner l'expression littérale de a et calculer la valeur de [3.
T -- T
En déduire la valeur de L°3 (on prendra : '"3------E'= 3,0.10'5 mol.J").
R.TE.T3
19- En supposant que LiCl soit inoffensif, serait--il intéressant d'en déposer
sur les routes
en hiver ? Justifier.
20-- Représenter les courbes d'analyse thermique pour les compositions
suivantes :
l 1 l
X1="1'"0' ;X1='g etx1='6" .
IV- Oxyde-réduction
Les piles au lithium sont d'un usage courant pour les applications nécessitant
peu de
puissance, mais une grande longévité, par exemple pour les stimulateurs
cardiaques.
Les batteries soufre--sodium ont été développées en vue d'une utilisation pour
les véhicules
électriques: elles présentent les avantages suivants: une grande densité de
courant, une
longue durée de vie et un coût modéré.
Nous allons dans un premier temps déterminer s'il est possible de constituer
cette pile en
milieu aqueux, à 25°C.
21-Qu'advient-il du sodium solide placé dans l'eau ? Ecrire l'équation-bilan de
la
réaction correspondante, équilibrée en milieu basique et exprimer sa constante
thermodynamique d'équilibre. Faire l'application numérique et conclure.
On place du soufre solide ainsi que 0,10 mol de pentasulfure de sodium NaZS5
dans un litre
d'une solution aqueuse de pH constant (pH = 10) dans laquelle la concentration
en ion
hydrogénosulfure HS' vaut initialement 0,10 mol.L'l . Le pentasulfure se
dissocie totalement
dans l'eau en ses ions constitutifs. '
22- Exprimer le potentiel standard E°5 du couple S(S) / S52' en fonction des
potentiels
standard E°4 et E°5 définis dans les données, puis calculer sa valeur numérique.
23- Ecrire, en justifiant la réponse, l'équation--bilan de la réaction la plus
favorisée qui
peut se produire dans le mélange ainsi constitué. Conclure.
La batterie soufre--sodium fonctionne, en réalité, à haute température (T = 600
K) : à une telle
température, tous les réactifs et tous les produits de réaction sont à l'état
liquide. Elle
comporte deux compartiments C1 et C2 séparés par un électrolyte solide : C1
contient du
soufre liquide et C2 du sodium liquide. L'électrolyte est une solution solide
d'alumine B et
d'aluminate de sodium contenant 5 à 10 % d'oxyde de sodium. A T= 600K, cette
paroi est
splitéable aux seuls ions sodium.
Lors de la décharge de la pile, il y a d'abord formation de pentasulfure de
sodium, non
miscible avec le soufre liquide.
L'équation-bilan de la réaction de fonctionnement de la batterie s'écrit :
2 Na... + 5 s... = Nazssa) (4)
pour laquelle, à T= 600 K :
ArH°4 = -540 kJ.mol'1 et ArS°4 = - 250 J.K".mo1".
24-- Préciser laquelle des deux électrodes correspond au pôle positif de la
pile et écrire les
deux demi-équations redox rendant compte du fonctionnement de la batterie en
phase
de décharge.
25-- La f. e. m. standard de la pile2 vaut e° =1,98 V. Quelle est la valeur de
la f.e.m. lorsque
[Na ] 0,.50molL1 et [85 ] O,.40molL 1?
26- Déterminer la valeur du logarithme décimal de la constante d'équilibre
correspondant
à la transformation suivante dans l'électrolyte (on prendra R.ln10 = 20) :
.Na285 = 2 Na+ + 852"
Données :
L'activité d'un composé liquide pur ou solide pur est égale à un.
Numéro atomique du césium Z = 55 ;
Rayons ioniques: R(Li*)= 70 pm; R(O2 ) -- 140 pm;
Masses molaires. M... ---- 7,0 g. mol ' ;MO --- 16 g. mol ';
- Températures de fusion et d'ébullition :
Température
Composé Température de
fusion d'ébullition
801°C 1465°C
97,8°C 882°C
- Enthalpies standard de formation et entropies standard (à 298 K) (grandeurs
supposées
indépendantes de la température):
-- valeurs arrondies à adopter dans le problème :
---------__
\/î z1,41;xlî z1,73; %«1,22
_ Constante des gaz parfaits : R = &? J.K".r1nol'1 ;
Nombre d'Avogadro : Na == 6,0.10 3 mol_ ;
2,3RT
àT=298K: F z0,060V;
àT=6OOK: 2'3FRTÆO,IZOV;
- En solution aqueuse à 298 K :
Potentiels standard (à pH = O) :
02 / H20(1) Na+ / Na(s) S(S)/ HS- S52-/ HS- S(S)/ 852-
E°1 = 0,00 V E°2 = 1,23 V E°3 = - 2,70 V E°4 = - 0,06 V E°5 = 0,00 V
- pKA1 (st / HS" ) = 7 et pKA2 (HS' / sz' ) = 13
- Pour l'accumulateur soufre-sodium à 600 K :
Couple 80) / S5Z-Z E°7
Couple Na+ / Na... : E°g
B SYNTHESE DE L'ANDROSTERONE
Ce problème a été conçu d'après la synthèse de cette hormone réalisée par K.
Fukumoto, en
1986
(J. Chem. Soc. P], 1986, 117).
H O\\\\\" . .
H
Formule topologique de l'androstérone
Cette synthèse utilise l'intermédiaire A qui contient déjà les cycles @ et @ du
squelette de ce
stéroïde (voir ci-après).
@@
@ @ Q.
Squelette stéroïdien Intermédiaire A.
27- Établir la configuration des atomes de carbone asymétriques du cycle @ de
l'androstérone. Expliquer le raisonnement.
Synthèse de l'intermédiaire A.
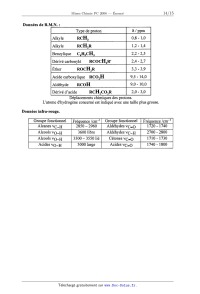
On utilise un composé B de formule C6H...O2
Le spectre de RMN du proton du composé B présente les signaux suivants : un
triplet à 1,1
ppm (J = 6 Hz), d'intensité relative 3;' un quadruplet à 2,5 ppm (J = 6 Hz)
d'intensité relative
2, un multiplet mal résolu, d'intensité relative 4, vers 2,75 ppm, et un
singulet d'intensité
relative 1 à 9,6 ppm. B ne présente pas d'absorption infra-rouge significative
au--dessus de
3000 cm"', et possède entre autres une bande d'absorption anormalement large et
intense à
1750 cm"1 et une bande vers 2750 cm"'.
28- Déterminer la formule développée de B, en indiquant le raisonnement
complet, et en
interprétant toutes les données spectroscopiques fournies relatives à B (des
données de
l . . , ,, ,
RMN H et d'1nfra--rouge sont fourn1es a la fin de lenonce).
29-- Proposer une réaction qui permet de former la
3--hydroxy-2-méthy1cyc10pentanone C à
partir de B. Indiquer les conditions expérimentales et le mécanisme de cette
réaction.
C réagit avec le trioxyde de chrome CrO3 en présence de pyridine pour donner D.
O
N
\
/
O
Pyridine Composé D
30-- Donner le nom de D.
31- De quel type de réaction s'agit-il '?
32-- Le composé D présente une tautomérief Qu'est--ce qu'une tautomérie ?
Représenter le
tautomère de D. Pourquoi ce tautomère est-il présent en quantité non
négligeable ?
Le composé D réagit avec une énone E, la but--3-èn-one. Il se forme la trione F.
O
O
Composé F
Pour rendre compte de cette réaction, on étudie les orbitales frontières des
réactifs, la réaction
étant sous contrôle orbitalaire.
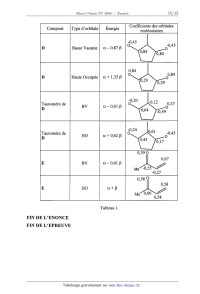
Le tableau 1 situé à la fin de l'énoncé donne les orbitales frontières des
réactifs. D et son
tautomère ont été représentés par leur squelette.
33-- A l'aide de ce tableau, indiquer les orbitales frontières qui ont la
meilleure interaction,
justifier.
34- Quel est l'électrophile, quel est le nucléophile ? Pourquoi ?
35- Justifier la régiosélectivité de la réaction. Proposer un mécanisme pour
cette réaction.
La tricétone F et de la (S)-proline sont agitées pendant 20 h dans du
diméthylformamide sous
atmosphère d'argon. Le composé G est obtenu quantitativement.
H O
N/ 0
/ N °
-- . | | | | Il < . / \/ 0 OH OH (S)-proline diméthylformamide Composé G 36- Quel est le type de réaction réalisée lors de la formation de G '? Quel produit aurait-on vraisemblablement obtenu si la (S)-proline avait été remplacée par son énantiomère '? G est traité par de l'acide paratoluènesulfonique et donne l'intermédiaire A O HO------S O Acide paratoluènesulfonique 37-- Donner le mécanisme de la réaction. Justifier sa régiosélectivité. Construction des cycles A et C. 38-- Le 3--bromopropanal est traité par l'éthane-l,2-diol, en milieu acide, et le produit H est obtenu. Donner la formule du composé H. Donner le mécanisme de la réaction. A est dissous dans l'éthanol à -- 10°C, et une solution de borohydrure de sodium (NaBH4) dans l'éthanol est ajoutée, lentement de façon à ce que la température du milieu réactionnel ne dépasse pas -- 5°C. La quantité de A utilisée (en nombre de moles) est égale à 4 fois celle du borohydrure de sodium. Le mélange réactionnel est traité à ---- 10°C par de l'acide chlorhydrique à 2 mol L'], de façon à ramener le pH entre 5 et 7. On isole alors le composé 1. OH \\\H "' Composé I 39- Donner le mécanisme de la réaction de formation de 1. (On ne demande pas de justifier la stéréochimie de la réaction). 40- Pourquoi l'autre carbonyle n'a-t--il pas réagi ? Que pourrait-il se passer si la réaction était effectuée à température ordinaire ? On fait réagir 1 avec du méthylpropène en présence d'acide dans du dichlorométhane. Le composé J est obtenu (tBu représente le groupement tertiobutyle). OtBu Composé J 41- Proposer un mécanisme plausible pour cette réaction. A une suspension de 900 mg d'hydrure de sodium NaH on ajoute goutte à goutte 4,8 g de J. Le mélange réactionnel est agité pendant 3,5 h à température ordinaire jusqu'à ce que le dégagement gazeux cesse. A ce moment, une solution de 4,5 g de H est ajoutée goutte à goutte, et la solution est agitée pendant 14 h. 42-- Quels sont les hydrogènes labiles du composé J '? Quel est le dégagement gazeux observé '? Le milieu réactionnel précédent est acidifié par une solution aqueuse de chlorure - d'ammonium. On obtient une huile après extraction et séchage. Celle-ci est placée dans une colonne contenant du gel de silice. Une première élution avec un mélange hexane-acétate d'éther (proportions 9:1) permet d'obtenir 1,2 g du composé K. Une deuxième élution avec un mélange hexane-acétate d'éther (proportions 73) permet d'obtenir 4,5 g du composé L. 43- Donner, en cinq lignes maximum, le principe de la chromatographie sur colonne. Indiquer, dans cette explication, la signification des termes, élution, éluant. Un schéma peut être utilisé. 44-- Quel est l'ion énolate formé préférentiellement '? Justifier. A l'aide de formes mésomères, montrer les différents centres nucléophiles de cet ion énolate préférentiel. OtBu . OtBu ,-\----o )\/\ O 0 0 Composé K Composé L 45- Expliquer la formation de K. 46- Quel est le composé intermédiaire L' qui se forme lorsque le carbone "a" est centre réactionnel '? L'action du chlorure d'ammonium permet de "replacer" la double liaison carbone--carbone sur le carbone "a". Indiquer comment. 47- Calculer les rendements pour la formation de K et de L. (Le composé J est en léger défaut). _ M(J) _ M(J) 48-- Proposer des conditions expérimentales pour réaliser la transformation de L en M. Discuter la stéréochimie de cette transformation. OtBu OtBu Composé M Composé N 49-- M est isomérisé en N par l'action du méthylate de sodium Me0Na dans le méthanol. Détailler le mécanisme de cette isomérisation. 50- On fait réagir l'ylure de phosphore 0 sur N. Quel est le composé P obtenu ? De quel type de réaction s'agit-il '? Ph '! Forme ylène de l'ylure de phosphore O. / "'" \\Ph Ph symbolise le groupe phéner Ph 51- Le composé P est mis en réaction avec l'hydrure de bore, puis traité avec le peroxyde d'hydrogène en milieu basique. Quel est le produit Q obtenu '? Justifier la régiosélectivité de la réaction. 52-Q est transformé en R, puis en S. Proposer une méthode pour réaliser ces transformations. OtBu OtBu Composé R 'VW Signifie que la stéréochimie de la Composé S liaison C--H n'est pas définie 53-- S est transformé en T. Proposer une méthode pour réaliser cette transformation. Ê\î//O Composé T V Composé U Après plusieurs étapes le composé U est obtenu. MOM représente le groupe méthoxyméther 0 . 54-- A quoi a servi la présence du groupe /Q ? Comment le transforme-t--on habituellement en dérivé carbonylé '? Le 3--bromopropène est mis en réaction avec du magnésium dans de l'éther anhydre. Le composé U est alors introduit dans le mélange réactionnel. On isole après hydrolyse acide le composé V. 55-- Donner la formule topologique du composé V. Donner le mécanisme de réaction. 56- Une série de réactions permet la déshydratation de V en W. Pourquoi la déshydratation réalisée classiquement en milieu acide n'est-elle pas possible ici ? OMOM OMOM Composé W Composé X 57- Le composé X ainsi que l'un de ses stéréoisomères est obtenu en chauffant W dans le toluène anhydre à 220°Ç pendant 100 h sous atmosphère d'argon. A quel type de réaction a--t-on affaire ? Ecrire un réarrangement électronique rendant compte de cette transformation. Une séquence de cinq réactions permet ensuite d'obtenir le produit désiré. Données de RMN. : ô / ppm 0,8 - 1,0 1,2 - 1,4 2,2 -- 2,5 2,4 - 2,7 3,3 -- 3,9 9,5 - 14,0 Type de proton Alker RcH3 Alkyle RCH,R Benzylique C6HSCÎÏ3 Dérivé carbonylé RCOCHZR' Éther ROCH2R Acide carboxylique RCOZH Alde'hyde RCOH 9,0 - 10,0 Dérivé d'acide RCH2COZR 2,0 -- 330 Déplacements chimiques des protons. L'atome d'hydrogène concerné est indiqué avec une taille plus grosse. Données infra-rouge. . Fré- uence /cm'1 Fré- uence /cm'1 2850--2960 1720 - 1740 3600 libre 2700 - 2800 3300-3550 lié 1710 - 1730 3000 large 1740 - 1800 Groupe fonctionnel Alcanes VC--H Alcools VO__H Alcools VO--H Acides VO_H COmposé Type d'orbitale Énergie COEURffiäïêïäïêähltäæ * 0 D Basse Vacante a -- 0,87 [5 D Haute Occupée a + 1,35 [3 äautomère de BV (1 _ 0,61 [3 Ëautomère de HD a + 0,62 [3 E BV (1 - 0,41 {5 E HO a + [3 Tableau 1 FIN DE L'ENONCE FIN DE L'EPREUVE
