Centrale Chimie PC 2010
| Thème de l'épreuve | L'acide oxalique. Thermodynamique de quelques réactions de dissociation d'acides dans l'eau. Aspects de la chimie des composés du furane. |
| Principaux outils utilisés | oxydoréduction, solutions aqueuses, thermochimie, diagramme potentiel-pH, chimie organique, polymères |
| Mots clefs | acide oxalique, furane, Paal et Knorr, aromaticité, furfural, polyesters furaniques, nitration du furane |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
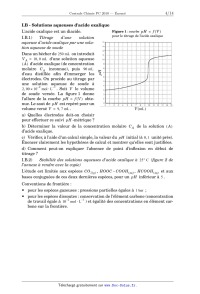
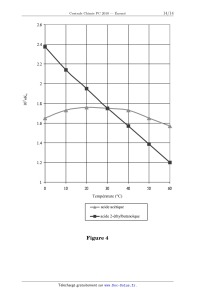
Concours Centrale - Supélec 2010 Épreuve : CHIMIE Filière PC CHIMIE Filière PC CHIMIE Calculatrices autorisées L'annexe, avec les deux figures 2 et 4 à compléter, sera rendue avec la copie. Partie I - L'acide oxalique Les sous-parties I.A et I.B peuvent être traitées de manière indépendante. Données : · · · · · élément H C N O Mg Cl Zn numéro atomique Z 1 6 7 8 12 17 30 électronégativité (échelle de Pauling) 2, 20 2, 55 3, 04 3, 44 1, 31 3, 16 1, 65 1 1 Constante des gaz parfaits R = 8, 314 J K mol . 19 Charge électrique élémentaire e = 1, 6 × 10 C . 23 1 Constante d'Avogadro N A = 6, 0 × 10 mol . On note T la température en Kelvin, 0, 00° C correspond à 273, 15 K . À 25 °C , · Produit ionique de l'eau pK e = 14, 0 · pK a : Acide oxalique pK a1 = 1, 2 , pK a2 = 4, 2 Acide méthanoïque pK a = 3, 8 2+ · Potentiel standard : E° ( MnO 4 ( aq ) / Mn ( aq ) ) = 1, 51 V · ( RT × ln 10 ) / F = 0, 06 V I.A - Électrosynthèses autour du dioxyde de carbone Aucune connaissance sur les électrosynthèses en milieu non aqueux n'est nécessaire pour traiter cette partie. I.A.1) Nombres d'oxydation du carbone a) Rappeler la structure électronique de l'atome de carbone dans son état fondamental. Quelle valeur maximale peut prendre le nombre d'oxydation du carbone ? Proposer une molécule renfermant du carbone à ce nombre d'oxydation maximal. Concours Centrale-Supélec 2010 1/12 CHIMIE Filière PC Filière PC b) Sur un axe gradué en nombre d'oxydation moyen pour le carbone, placer la molécule précédente ainsi que l'ion méthanoate et l'ion oxalate (dibase conjuguée de l'acide oxalique HOOC COOH ). On peut obtenir de l'oxalate de sodium à partir de méthanoate de sodium par chauffage en milieu sel fondu selon le bilan : NaOH 2 NaHCO 2 = Na 2 C 2 O 4 + H 2 fondu · Donner les couples oxydant/réducteur associés à cette transformation. Quelles seraient les demi-équations électroniques associées à chacun de ces couples en solution aqueuse ? I.A.2) Électrosynthèse d'un sel d'oxalate à partir de dioxyde de carbone a) Écrire l'équation de la réaction électrochimique modélisant la transformation du dioxyde de carbone à la cathode, un électron étant transféré par molécule et conduisant à la formation d'un intermédiaire réactionnel que l'on note (I) . b) Proposer des formules de Lewis acceptables et une géométrie pour l'espèce ( I ) . Montrer que certaines formes limites de ( I ) permettent d'expliquer la formation d'ions oxalate dans la solution. L'intermédiaire réactionnel ( I ) réagit facilement avec l'eau ou avec un composé protique, diminuant grandement le rendement d'obtention de l'oxalate. Une des 2 2+ électrosynthèses de l'oxalate de zinc ( C 2 O 4 , Zn ) a ainsi été proposée en milieu non aqueux en utilisant une électrode en zinc (métal) et une électrode en acier, le bain d'électrolyse étant constitué de dioxyde de carbone et de perchlorate de tétrabutylammonium dissous dans le DMF ( DMF : diméthylformamide, ou N , N -diméthylméthanamide ; perchlorate : ClO 4 ; le perchlorate de tétrabutylammonium ne subit aucune transformation dans le milieu considéré). c) Justifier, par des formules de Lewis adaptées, la forte polarité du DMF . d) Proposer un schéma de la cellule d'électrolyse. Repérer l'anode et la cathode et écrire les équations des réactions électrochimique modélisant les transformations qui ont lieu aux électrodes, ainsi que le bilan global de l'électrolyse. e) Quel est ici le rôle du perchlorate de tétrabutylammonium ? Concours Centrale-Supélec 2010 2/12 CHIMIE Filière PC I.A.3) Électrosynthèse à partir de chloropropanone et de dioxyde de carbone L'électrosynthèse de l'ion 3 -oxobutanoate à partir de la 1 -chloropropan- 2 -one peut être faite dans le même milieu en remplaçant l'électrode de zinc par une électrode de magnésium (Oumar Sock, Michel Troupel et Jacques Périchon, Tetrahedron Lett. 1985, 26, 1509). En début de réaction, le milieu réactionnel renferme, dissous dans le DMF , du dioxyde de carbone en excès, 10 millimoles de 1 -chloropropan- 2 -one et du perchlorate de tétrabutylammonium. En fin d'électrosynthèse, le milieu renferme, dissous dans le DMF , du dioxyde 2+ de carbone, des ions chlorure Cl , des ions magnésium M g , des ions 3 -oxobutanoate et du perchlorate de tétrabutylammonium, ce dernier n'ayant subi aucune transformation. a) En écrivant les formules chimiques des différentes espèces organiques, l'équation de la réaction modélisant la transformation électrochimique ainsi effectuée. 2 b) Pour une densité de courant constante de 30 mA cm (mesurée par rapport à la surface de l'électrode de magnésium), le rendement déterminé par titrage acidobasique est supérieur à 99 % . Estimer la durée d'électrolyse pour un barreau de magnésium cylindrique de 0, 4 cm de diamètre plongeant de 10 cm dans le DMF , en supposant que les dimensions de l'électrode ne varient pas. c) La maille cristalline du magnésium est hexagonale compacte idéale, de paramètre de maille a = 0, 32 nm . i)Représenter la maille et déterminer le volume molaire du magnésium. ii)Estimer la variation relative du diamètre du barreau de magnésium lors de l'électrosynthèse décrite ci-dessus. d) Proposer une synthèse multi-étapes, non électrochimique, de l'acide 3-oxobutanoïque utilisant tous les réactifs écrits dans la question a), ainsi que d'autres réactifs et solvants à préciser. Aucun mécanisme n'est demandé. Concours Centrale-Supélec 2010 3/12 Figure 1 : courbe pH = f ( V ) pour le titrage de l'acide oxalique pH I.B - Solutions aqueuses d'acide oxalique L'acide oxalique est un diacide. I.B.1) Titrage d'une solution aqueuse d'acide oxalique par une solution aqueuse de soude Dans un bécher de 250 mL on introduit V A = 10, 0 mL d'une solution aqueuse ( A ) d'acide oxalique (de concentration molaire C A inconnue), puis 90 mL d'eau distillée afin d'immerger les électrodes. On procède au titrage par une solution aqueuse de soude à 2 1 2, 00 × 10 mol L . Soit V le volume de soude versée. La figure 1 donne l'allure de la courbe pH = f ( V ) obtenue. Le saut de pH est repéré pour un volume versé V = 9, 7 mL . V ( mL ) a) Quelles électrodes doit-on choisir pour effectuer ce suivi pH -métrique ? b) Déterminer la valeur de la concentration molaire C A de la solution ( A ) d'acide oxalique. c) Vérifier, à l'aide d'un calcul simple, la valeur du pH initial (à 0, 1 unité près). Énoncer clairement les hypothèses de calcul et montrer qu'elles sont justifiées. d) Comment peut-on expliquer l'absence de point d'inflexion en début de titrage ? I.B.2) Stabilité des solutions aqueuses d'acide oxalique à 25° C (figure 2 de l'annexe à rendre avec la copie) L'étude est limitée aux espèces CO 2 ( g ) , HOOC COOH ( aq ) , HCOOH ( aq ) et aux bases conjuguées de ces deux dernières espèces, pour un pH inférieur à 5 . Conventions de frontière : · pour les espèces gazeuses : pressions partielles égales à 1 bar ; · pour les espèces dissoutes : conservation de l'élément carbone (concentration 2 1 de travail égale à 10 mol L ) et égalité des concentrations en élément carbone sur la frontière. CHIMIE Filière PC Pour les couples concernés dans cette étude, le handbook ne donne que les deux valeurs suivantes de potentiels standard à 25 °C : · couple CO 2 ( g ) / H 2 C 2 O 4 ( aq ) : E°1 = 0, 49 V ; · couple CO 2 ( g ) / HCO 2 H ( aq ) : E°2 = 0, 20 V . a) Compléter les domaines ( a ) à ( g ) de la figure 2, en indiquant les espèces chimiques correspondant aux différents couples étudiés. b) Couple H 2 C 2 O 4 ( aq ) / HCOOH ( aq ) et espèces conjuguées correspondantes i)Donner l'équation de la frontière correspondant au couple H 2 C 2 O 4 ( aq ) / HCOOH ( aq ) . ii)Quel couple intervient dans l'intervalle de pH compris entre 1, 2 et 3, 8 ? Trouver la valeur de la pente de la frontière associée. Placer sur la figure 2 les résultats du (i) et (ii). iii)Poursuivre le tracé par continuité en précisant uniquement les pentes des différentes frontières à considérer pour pH < 5 , et placer les différentes espèces de manière similaire à la question I.B.2-a. c) Stabilité dans l'eau i)Placer sur le diagramme le tracé relatif à l'un des couples de l'eau compatible avec l'échelle proposée. Écrire l'équation de la réaction thermodynamiquement prévue (selon le diagramme) pour une solution aqueuse d'acide oxalique dont le pH vaut 3. ii)Proposer une explication pour justifier stabilité des solutions aqueuses d'acide oxalique et méthanoïque à 25 °C . I.B.3) Titrage d'une solution aqueuse d'acide oxalique par une solution aqueuse de permanganate de potassium On titre V A = 10, 0 mL de la solution aqueuse ( A ) d'acide oxalique (de concentration C A trouvée en I.B.1-b) par une solution aqueuse acidifiée de permanga3 1 nate de potassium à 2, 50 × 10 mol L . a) Écrire l'équation de la réaction support du titrage avec les plus petits nombres stoechiométriques entiers, et donner la valeur de la constante de réaction associée à 25° C . Comment l'expérimentateur peut-il repérer l'équivalence lors de ce titrage ? b) Donner la valeur du volume attendu à l'équivalence lors du titrage des 10, 0 mL de la solution ( A ) . c) Quelles électrodes proposeriez-vous pour suivre ce titrage ? d) Pour les premiers millilitres versés, le milieu réactionnel garde une coloration violette, qui disparaît après quelques instants. Quel argument, issu de la partie I.B.2, est en accord avec ces observations ? Concours Centrale-Supélec 2010 5/12 CHIMIE Filière PC Partie II - Thermodynamique de quelques réactions de dissociation d'acides dans l'eau II.A - Grandeurs thermodynamiques associées aux réactions Dans le Journal of Chemical Education (vol. 48, mai 1971), G.V. Calder et T.J. Barton ont rassemblé quelques valeurs de grandeurs thermodynamiques relatives à la dissociation de certains acides dans l'eau. Tableau 1 : valeurs relatives à AH ( aq ) + H 2 O = H 3 O r G° acide AH pK a r H° 1 + ( aq ) +A T r S° 1 1 ( kJ mol ) ( kJ mol ) ( kJ mol ) ( aq ) (à 25 °C) r S° ( J mol 1 1 K ) CH 3 COOH 4, 76 27 0, 4 28 94 Cl CH 2 COOH 2, 86 16 4, 6 21 70 Cl 3 CCOOH 0, 65 à calculer 6, 3 à calculer à calculer II.A.1) À l'aide des valeurs du tableau 1, donner avec deux chiffres significatifs les valeurs de r G° , T r S° et r S° à 25 °C pour l'acide trichloroacétique. II.A.2) Pour les acides acétique et 2 -chloroacétique, comparer les contributions relatives de r H° et T r S° dans le calcul du pK a à 25 °C . II.B - Influence de la température II.B.1) Parmi les trois valeurs de pK a du tableau 1, laquelle dépend le plus de la température ? Calculer sa variation pK a pour une élévation de température de 1, 0° C , et en déduire le nombre de décimales que l'on peut afficher pour une valeur de pK a lorsque la température est donnée au degré près. La figure 4 (sur l'annexe à rendre avec la copie), présente l'évolution de la constante d'acidité K a en fonction de la température pour l'acide acétique et pour l'acide 2-éthylbutanoïque. II.B.2) Proposer une séquence réactionnelle permettant d'obtenir l'acide 2éthylbutanoïque à partir d'éthanol, d'acide propanedioïque, de toute espèce minérale et de tout solvant nécessaire. Aucun mécanisme n'est demandé. II.B.3) Chacune des courbes tracées sur la figure 4 délimite deux domaines du plan. Quelle nouvelle ordonnée peut-on placer sur le graphe pour que ces domaines correspondent à des domaines de prédominance ? En utilisant un raisonnement mettant en jeu l'affinité chimique, placer les espèces correspondantes dans les différents domaines du plan. Concours Centrale-Supélec 2010 6/12 CHIMIE Filière PC II.B.4) Montrer que les deux propositions « r C p° est nulle » et « r G° est une fonction affine de la température » sont équivalentes. II.B.5) Montrer que l'étude en température, illustrée à la figure 4, ne suit pas en toute rigueur, l'approximation d'Ellingham. Partie III - Quelques aspects de la chimie des composés du furane Les différentes sous-parties de ce problème sont largement indépendantes. O Le furane présente la formule topologique suivante : Le furane est un composé aromatique très volatil. Sa température d'ébullition vaut 32° C sous pression atmosphérique. Quelques paramètres de Hückel : Atomes Intégrale coulombienne Intégrale de résonance Carbone C = CC = Oxygène à 1 électron O = + CO = Oxygène à 2 électrons O = + 2 CO = 0, 8 Énergies des OM du système du furane : + 2, 63 ; + 1, 31 ; + 0, 62 ; 0, 95 ; 1, 62 . Énergies des OM du système du buta 1, 3 dién 1 ol ( A ) : + 2, 35 ; + 1, 52 ; + 0, 48 ; 0, 71 ; 1, 64 . OH Expression de la HO et de la BV du furane : HO = 0 ( 2 p ZO ) + 0, 60 ( 2 p ZC2 ) + 0, 37 ( 2 p ZC3 ) 0, 37 ( 2 p ZC4 ) 0, 60 ( 2 p ZC5 ) BV = 0, 32 ( 2 p ZO ) + 0, 60 ( 2 p ZC2 ) 0, 31 ( 2 p ZC3 ) 0, 31 ( 2 p ZC4 ) + 0, 60 ( 2 p ZC5 ) Avec O qui désigne l'oxygène et C2 et C5 qui désignent les atomes de carbone voisins de O . Concours Centrale-Supélec 2010 7/12 CHIMIE Filière PC III.A - Aromaticité du furane III.A.1) Justifier que, selon le critère de Hückel, le furane est une molécule aromatique. III.A.2) Confirmation via la théorie de Hückel a) Que représente, en première approximation, l'intégrale coulombienne notée ? Commenter la valeur prise pour cette intégrale coulombienne dans le cas de l'oxygène à un électron par rapport au cas du carbone. b) En théorie de Hückel, suivant qu'un hétéroatome (comme N ou O ) intervient par un ou deux électrons dans le système d'une molécule, les paramétrages diffèrent. Quel type d'hétéroatome faut-il choisir pour le furane ? c) En utilisant les données, calculer en unité l'énergie de délocalisation (ou de conjugaison) du furane notée E del et définie comme la différence entre l'énergie des électrons du furane et celle d'une molécule de furane hypothétique correspondant à un ensemble non conjugué de deux molécules d'éthylène et d'un oxygène. Commenter. d) En utilisant les données, calculer en unité l'énergie de résonance du furane notée E res et définie comme la différence entre l'énergie des électrons du furane et celle des électrons du buta 1, 3 dién 1 ol (molécule ( A ) ). e) Le composé cyclique est dit aromatique si E res est négative. Le résultat obtenu est-il en accord avec le critère de Hückel ? III.B - Quelques synthèses du furane III.B.1) On peut obtenir le furane en cyclisant l'aldéhyde succinique ou butanedial ( F ) en présence de P 4 O 10 (synthèse de Paal et Knorr). On peut mettre en évidence HO dans le milieu réactionnel l'espèce ( G ) . (G) OH a) Donner l'équation de la réaction de synthèse du furane par ce procédé. Quel peut-être le rôle de P 4 O 10 ? b) Quel nom peut-on donner à la réaction ( F ) ( G ) ? Quel(s) facteur(s) peu(ven)t expliquer la relative stabilité de ( G ) ? III.B.2) Une autre voie de synthèse du furane consiste à faire réagir le 1, 2 -dichloroéthane ( B ) avec du cyanure de potassium pour conduire à ( C ) qui subit une longue hydrolyse acide pour donner ( D ) . Le chauffage de ( D ) en présence de P 4 O 10 conduit à ( E ) qui par réduction conduit au furane. a) Compléter la suite réactionnelle en donnant les formules topologiques de ( C ) , ( D ) et ( E ) . b) Quel est le mécanisme de la première réaction ( B ) ( C ) ? Justifier. Concours Centrale-Supélec 2010 8/12 CHIMIE Filière PC III.B.3) Industriellement, le furane est préparé à partir de déchets végétaux riches en furfural ( H ) dont la formule topologique est indiquée ci-contre. Le furfural contenu dans ces déchets est issu de la déshydratation acide d'aldopentoses, stéréoisomères de formule semi-développée HO CH 2 CH ( OH ) CH ( OH ) CH ( OH ) CHO . (H) O O a) Combien de stéréoisomères d'aldopentose correspondent à cette formule semi-développée ? b) Proposer un mécanisme expliquant le passage, en catalyse acide, d'un aldopentose au furfural. c) Le spectre Infra-Rouge du furfural présente une bande caractéristique de la 1 liaison C = O à 1686 cm . Justifier l'écart observé avec les composés carbonylés 1 usuels (nombre d'onde correspondant à des valeurs supérieures à 1700 cm ). d) Le furfural est chauffé à 400 °C et conduit au furane et à un dégagement de monoxyde de carbone. Donner l'équation de la réaction. La réaction est-elle thermodynamiquement favorisée à pression élevée ou à basse pression ? e) Proposer des schémas de Lewis pour le monoxyde de carbone. III.C - Quelques utilisations classiques du furane III.C.1) Synthèse du tétrahydrofurane L'hydrogénation du furane conduit au tétrahydrofurane ( THF ) , solvant très intéressant en chimie organique par exemple pour une synthèse magnésienne. Sa température d'ébullition vaut 67 °C sous pression atmosphérique. a) Comment peut-on réaliser l'hydrogénation de l'éthène ? Comment modifier les conditions opératoires de cette réaction pour hydrogéner le furane ? b) Citer deux propriétés essentielles à la synthèse magnésienne que possède le THF . c) Le THF est souvent préféré à l'éther diéthylique (éthoxyéthane) lors des synthèses magnésiennes en raison de sa plus grande basicité et de sa moins grande volatilité. Pourquoi sa moins grande volatilité est-elle a priori un avantage ? III.C.2) Étude de la nitration du furane a) Quels sont a priori les produits envisageables lors de la réaction de nitration du furane ? Doit-on craindre une polynitration ? b) En utilisant les données figurant en début de la partie III, prévoir quel sera le produit majoritaire pour la réaction précédente. On supposera que l'approximation des orbitales frontières est applicable. Concours Centrale-Supélec 2010 9/12 CHIMIE Filière PC c) Pouvait-on prévoir ce résultat par un raisonnement « classique » impliquant le postulat de Hammond ? III.C.3) Le furane et la réaction de Diels-Alder O O La formule topologique de l'anhydride maléique est donnée ci-contre. a) Le furane peut aisément réagir avec un « diénophile » (comme la molécule d'anhydride maléique par exemple) selon une réaction de O Diels-Alder. Proposer une explication. b) Dans le solvant acétonitrile, à 40 °C , la réaction entre le furane et l'anhydride maléique conduit essentiellement à deux produits stéréoisomères dits « endo » et « exo ». Le produit « endo » est majoritaire dans le cas d'un temps de réaction court (30 minutes) et le produit « exo » est majoritaire si le chauffage est prolongé (48 heures). i)Dessiner en perspective les deux produits « endo » et « exo ». ii)Quelle relation de stéréoisomérie lie ces deux produits ? Ces deux produits sont-ils chiraux ? iii)Que peut-on déduire des observations expérimentales ? c) Une variante de la réaction précédente est indiquée ci-après. Elle permet d'obtenir un dérivé du furane tétrasubstitué. Justifier la réaction observée en représentant les mécanismes de la première et de la troisième étape. Proposer une justification à la sélectivité de l'hydrogénation observée. EtO 2 C O + EtO 2 C CO 2 Et 1 ) chauffage 2 ) H 2, Pd O + EtO 2 C 3 ) chauffage III.D - Synthèse de polyesters furaniques Les polyesters furaniques sont des polymères photosensibles (sensibilité aux radiations UV) utilisés en industrie graphique (plaques d'impression offset). Par ailleurs, comme nous allons le voir dans ce qui suit, ils sont synthétisés à partir de dérivés du furane issus de la biomasse et constituent donc une alternative aux polymères issus de dérivés pétroliers. Concours Centrale-Supélec 2010 10/12 CHIMIE Filière PC III.D.1) La déshydratation acide d'hexoses selon un mécanisme similaire à celui étudié en partie III.B conduit au 5 -hydroxyméthylfurfural dont la formule topologique est repréOH sentée ci-contre. 1 Son spectre RM N H réalisé dans CD 2 Cl 2 présente les signaux O suivants : · Un singulet à 2, 8 ppm d'intégration 1H (aspect de bosse) qui disparaît si on réalise le spectre en présence d'un composé O protique deutéré. · Un singulet à 4, 7 ppm d'intégration 2H . · Un signal à 5, 3 ppm de faible intégration (dont on indique qu'il est dû à CH 2 Cl 2 ). · Deux doublets à 6, 5 et 7, 2 ppm d'intégration 1H chacun. · Un singulet à 9, 6 ppm d'intégration 1H dû au H aldéhydique. a) Pourquoi le signal à 2, 8 ppm disparaît-il en présence d'un composé protique deutéré ? b) Quelle peut-être la raison de la présence de CH 2 Cl 2 ? c) Attribuer les signaux aux différents atomes d'hydrogène présents dans la molécule. d) Justifier le couplage des signaux à 6, 5 et 7, 2 ppm . e) Les atomes d'hydrogène éthylénique (c'est-à-dire portés par les atomes de carbone engagés dans une double liaison) présentent des déplacements chimiques usuellement plus bas. Quelle peut-être l'origine des valeurs élevées observées ici ? III.D.2) Le 5 -hydroxyméthylfurfural est oxydé en furane O O 2, 5 -dicarboxaldéhyde (de formule représentée ci-contre) par O le manganate de baryum. Proposer un autre réactif permettant a priori de réaliser cette transformation. III.D.3) Le furane 2, 5 -dicarboxaldéO O hyde est chauffé à reflux pendant deux O heures en présence de deux équivalents HO OH d'acide malonique (ou acide propanedioïque) et de 1, 2 équivalents de pyridine, Diacide furanacrylique jouant le rôle de base. Après des traitements et lavages acido-basiques, on obtient le diacide furanacrylique représenté ci-cpntre. Concours Centrale-Supélec 2010 11/12 CHIMIE Filière PC a) Proposer un mécanisme pour cette séquence réactionnelle. On ne cherchera 1 pas à justifier la stéréochimie obtenue. La RM N H permet de vérifier que l'isomère obtenu est bien de configuration E . b) Le produit qui se présente sous forme d'une poudre jaune peut être purifié par recristallisation dans l'éthanol. Présenter le principe de cette technique de purification. III.D.4) Le diacide furanacrylique est chauffé à reflux en présence de chlorure de thionyle ( SOCl 2 ) et de diméthylformamide pendant quatre heures. Le produit obtenu ( X ) réagit avec l'éthanol dans le solvant dichlorométhane et en présence de triéthylamine. La phase organique est lavée puis traitée par du sulfate de sodium anhydre. On obtient ( Y ) . a) Donner les formules semi-développées de ( X ) et ( Y ) . b) Quel est le rôle de la triéthylamine ? Quel est le rôle du sulfate de sodium anhydre ? III.D.5) Le composé ( Y ) peut ensuite participer à des polymérisations par trans-estérification en réagissant par exemple avec un diol aliphatique comme l'hexane-1,6-diol. En mettant le même nombre stoechiométrique n pour l'hexane-1,6-diol et pour ( Y ) , donner l'équation de la réaction de polymérisation conduisant à une macromolécule linéaire, en précisant les formules topologiques des produits. ··· FIN ··· Concours Centrale-Supélec 2010 12/12 Annexe du sujet Chimie Filière PC Annexe du sujet Chimie Filière PC Cette annexe doit être rendue avec les autres copies. Il ne pourra pas être délivré d'autres exemplaires de ce document. Concours Centrale-Supélec 2010 1/2 105 Ka Température (°C) acide acétique acide 2-éthylbutanoïque Figure 4
