Centrale Chimie PC 2009
| Thème de l'épreuve | Diagrammes carrés et azéotropie. Synthèse de l'indinavir. |
| Principaux outils utilisés | thermodynamique des équilibres liquide-vapeur, cinétique de la copolymérisation radicalaire, stéréochimie, chimie du carbonyle |
| Mots clefs | diagramme carré, point de Bancroft, polymérisation, synthèse de l'indinavir |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
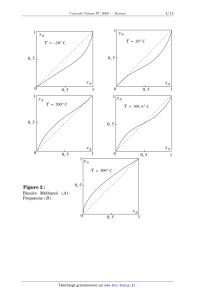
Concours Centrale - Supélec 2009 Épreuve : CHIMIE Filière PC CHIMIE Filière PC CHIMIE Les calculatrices sont autorisées. Partie I - Diagrammes carrés et azéotropie Ce problème met en lumière les analogies fortes qui peuvent exister dans des domaines de la chimie aussi différents que peuvent l'être, la thermodynamique des équilibres liquide-vapeur et la cinétique des réactions de copolymérisation. Ainsi, même si les parties I.A et I.B sont largement indépendantes l'une de l'autre certaines questions de la partie I.B feront référence à ce qui aura été démontré dans le I.A. I.A - Équilibres liquide-vapeur des systèmes binaires On se propose dans cette première partie d'étudier quelques équilibres liquidevapeur (notés ELV dans la suite) de systèmes à deux constituants chimiques A et B mutuellement non réactifs. Les hypothèses d'étude sont les suivantes : · les ELV sont réalisés dans des conditions isothermes à une température T fixée ; · on néglige l'influence de la pression P sur le milieu liquide, qui est toujours monophasé (absence de démixtion) ; · la vapeur surmontant le liquide est supposée avoir un comportement de gaz parfait. Les compositions des phases en équilibre seront repérées par les fractions molaires du constituant A , et notées respectivement x A pour le liquide, et y A pour la vapeur. On appelle diagramme de composition, ou diagramme carré, la courbe des variations de y A en fonction de x A dans des conditions expérimentales données. De même que les diagrammes isothermes (composition, pression) ou isobares (composition, température), ces diagrammes carrés donnent un mode de représentation des systèmes binaires en état d' ELV . I.A.1) Le mélange liquide des constituants A et B est supposé idéal. a) Quelle loi d'origine expérimentale suivent les mélanges liquides idéaux pour toute composition ? Donner avec précision la signification des termes qui apparaissent dans cette loi. Concours Centrale-Supélec 2009 1/14 CHIMIE Filière PC Filière PC b) Donner l'expression du potentiel chimique d'un constituant i ( i = A, B ) du mélange liquide idéal. Retrouver cette expression à partir de la condition d' ELV relative aux potentiels chimiques. c) On définit à la température T le coefficient de volatilité relative noté _ , tel que : p* A ( T ) _ = -------------------p* B ( T ) expression dans laquelle p* i ( T ) désigne la pression de vapeur saturante (ou pression de saturation) du constituant i à la température T ( i = A, B ) . Montrer que, tant que les enthalpies molaires de vaporisation de A et B restent voisines, on peut négliger les variations de _ avec la température. d) Établir l'expression donnant y A en fonction de x A et de _ , lorsque l' ELV est réalisé à la température T . e) Le mélange liquide Benzène ( A ) -Méthylbenzène ( B ) peut être considéré idéal ; on donne pour ce mélange : xA 0 yA 0, 2 0, 4 0, 6 0, 82 0, 8 1 0, 93 Compléter le tableau ci-dessus, et tracer l'allure du diagramme carré à 40 °C pour ce système binaire. On adoptera comme échelle en abscisse et en ordonnée 1 cm pour 0, 1 unité de fraction molaire. En déduire quel est le constituant le plus volatil, c'est-à-dire celui qui s'incorpore préférentiellement dans la phase vapeur. On donne : à 40 °C ; p* A = 0, 243 bar ; p* B = 0, 078 bar . I.A.2) La figure 1 représente le diagramme carré du binaire Méthanol ( A ) Propanone ( B ) à 80 °C . On précise que le mélange liquide de ce binaire n'est plus idéal. Concours Centrale-Supélec 2009 1 yA Méthanol ( A ) -Propanone 0, 8 ( B ) T = 80 °C 0, 6 0, 4 Z 0, 2 Figure 1 x A 0 0, 2 0, 4 0, 6 0, 8 1 2/14 CHIMIE Filière PC a) Comment interpréter l'existence du point Z sur ce diagramme ? b) Quelles propriétés présentent le mélange liquide de composition Z vis-à-vis de l'ébullition ? Étayer vos affirmations à l'aide d'un calcul de variance. c) Comment est-il possible expérimentalement de distinguer un tel mélange liquide de composition Z , d'un corps pur liquide ? d) On souhaite tracer l'allure du diagramme isotherme (composition, pression) liquide-vapeur du binaire Méthanol-Propanone à 80 °C . Déduire de la figure 1 s'il doit apparaître dans ce tracé un maximum ou un minimum de pression, et préciser les natures des différents domaines et courbes du diagramme ainsi établi. On donne à 80 °C , p* A = 1, 81 bar et p* B = 2, 15 bar . e) Dans le cas général, est-il possible de rencontrer un diagramme carré avec une courbe de concavité opposée à celle de la figure 1 (donc en forme de S) ? Si non, dites pourquoi ; si oui, dans quel cas ? I.A.3) On démontre que dans un diagramme carré, la courbe y A en fonction de x A est nécessairement monotone croissante lorsque la phase liquide est stable, c'est-à-dire ne donne pas lieu à une démixtion liquide-liquide. L'un des deux théorèmes de Gibbs-Konovalov dit : pour un système binaire non réactif en état d' ELV isotherme, la pression de vapeur est extrémale si liquide et vapeur ont même composition. a) Reproduire la démonstration de la relation de Gibbs-Duhem appliquée à une phase homogène, à température et pression constantes. b) Il est encore possible d'appliquer cette relation à une phase liquide homogène dans des conditions seulement isothermes : dire pourquoi. Appliquer alors la relation sous sa forme dérivée à la phase liquide, puis expliciter les conditions d' ELV pour démontrer l'égalité : yA xA d yA 1 dP ---- ----------- = -------------------- u ----------y A y B dx A P dx A où P est la pression totale de la vapeur surmontant le liquide. c) Démontrer alors que dans un diagramme isotherme liquide-vapeur (composition, pression), lorsque la phase liquide est stable, les sens de variations des courbes d'ébullition et de rosée sont identiques et dépendent du signe de l'écart ( y A x A) . d) En déduire le théorème de Gibbs-Konovalov énoncé ci-dessus. I.A.4) On définit, pour un couple de corps purs ( A, B ) , le point de Bancroft (lorsqu'il existe) de coordonnées ( T b, p b ) par : p* A ( T b ) = p* B ( T b ) = p b . Concours Centrale-Supélec 2009 3/14 CHIMIE Filière PC 1 y A 1 y A T = 20 ° C T = 20 ° C 0, 5 0, 5 xA 0 1 xA 0 1 0, 5 1 y A yA T = 200 ° C T = 109, 6 ° C 0, 5 0, 5 xA xA 0 1 0, 5 1 0, 5 0 0, 5 1 1 y A T = 300 ° C Figure 2 : 0, 5 Binaire Méthanol ( A ) Propanone ( B ) 0 Concours Centrale-Supélec 2009 xA 0, 5 1 4/14 CHIMIE Filière PC Ainsi, pour les corps purs Méthanol ( A ) et Propanone ( B ) considérés plus haut : T b = 109, 6 ¡C p* A ( T ) < p B ( T ) pour T < T b p* A ( T ) > p* B ( T ) pour T > T b On donne en outre la figure 2 (page précédente) qui schématise l'évolution des diagrammes carrés du binaire Méthanol-Propanone en fonction de la température. a) Expliquer pourquoi l'existence d'un point de Bancroft entraîne nécessairement l'existence d'un azéotrope pour le binaire liquide-vapeur associé. b) Considérant les figures 1 et 2, comment interpréter l'évolution des diagrammes carrés avec la température ? On parle dans ce cas d'azéotropie bornée : commenter. c) À l'aide des figures 1 et 2, représenter schématiquement (comme au I.A.2-d) dans un unique système d'axes (composition, pression), l'évolution des diagrammes d' ELV du binaire Méthanol ( A ) -Propanone ( B ) avec la température. On échelonnera les différents diagrammes de bas en haut par températures croissantes. Quelle remarque peut-on faire quant à l'orientation de ces diagrammes dans le plan ? I.B - Copolymérisation statistique On considère dans cette deuxième partie la copolymérisation radicalaire en chaîne de deux monomère A et B , réalisée sous une température T fixée. Le mélange binaire des monomères sera toujours supposé monophasé. Les hypothèses d'étude de la copolymérisation relèvent du modèle terminal selon lequel : · la réactivité d'un macroradical en croissance ne dépend que de l'unité terminale A ou B ; · seule la phase de propagation est k AA AA déterminante pour la composition A +A du copolymère formé (hypothèse k AB A +B AB des chaînes longues). On rappelle que les différentes étapes élémenk BA B +A BA taires de cette propagation s'écrivent (voir ci-contre) : k BB BB B +B où les k ij désignent les différentes constantes de vitesse. Dans ce qui suit on désignera par A (respectivement B ) l'ensemble des macroradicaux de type AA et BA (respectivement AB et BB . Selon l'habitude, on notera à l'instant t , [ A ] la concentration molaire volumique et f A la fraction molaire du monomère A dans le mélange des monomères, et F A la fraction molaire en unités monomères A Concours Centrale-Supélec 2009 5/14 CHIMIE Filière PC incorporées dans le copolymère entre l'instant t et ( t + dt ) . Le diagramme de composition, ou diagramme carré, est la courbe des variations de F A en fonction de f A , à la température T . I.B.1) a) Quel est l'intérêt de la copolymérisation statistique quant à la composition du copolymère formé, par rapport à une copolymérisation par étapes (ou copolycondensation) réalisée avec deux monomères bifonctionnels ? b) Quel est donc l'intérêt de la copolymérisation statistique quant aux propriétés du copolymère formé ? I.B.2) On se propose d'établir l'expression de l'équation de Mayo-Lewis (ou équation de composition), à partir de laquelle il est possible d'exprimer F A en fonction de f A . a) Exprimer les vitesses de disparition des monomères A et B , ainsi que le rapport d [ A ] / d [ B ] , en fonction de [ A ] , [ B ] , A , B et des différentes constantes de vitesses. b) Exploiter l'approximation de l'état quasi stationnaire ( AEQS ) pour établir l'équation de Mayo-Lewis qui donne le rapport d [ A ] / d [ B ] en fonction de [ A ] , [ B ] et des rapports de réactivité r A et r B dont on rappelle les définitions : k AA r A = ----------, k AB k BB . r B = ---------k BA c) Il est d'usage de poser : [ A] d[ A] X = ------------- et x = --------- . [ B] d[ B] Montrer que l'équation de Mayo-Lewis peut s'écrire sous la forme : 1 + rAx X = x ------------------- . x + rB I.B.3) On établit généralement un classement des différents types de copolymérisation statistique, en fonction des valeurs prises par r A et r B . Un premier cas assez fréquent est celui pour lequel le produit r A r B est voisin de 1 : on dit alors que la copolymérisation est idéale. a) Que dire dans ce cas des réactivités des macroradicaux A et B sur les monomères A et B ? Comment se fera l'incorporation des unités monomères A et B dans le copolymère ? b) Exprimer les fractions molaires f A et F A en fonction de x et X définis cidessus. c) À l'aide de l'équation de Mayo-Lewis, établir l'expression donnant F A en fonction de f A et de r A à la température T , pour une copolymérisation statisti- Concours Centrale-Supélec 2009 6/14 CHIMIE Filière PC que idéale. En se référant à la partie I.A, expliquer pourquoi ce type de copolymérisation est qualifié d'idéal. d) Pour le couple de monomères Méthacrylate de méthyle ( A ) -Acrylate de méthyle ( B ) à 50° C , on trouve dans la littérature r A = 2, 2 avec r A r B = 0, 96 . Déduire du I.A, sans calculs, l'allure du diagramme carré pour ce système. Quel monomère s'incorpore préférentiellement dans le copolymère à tout instant ? Finalement, quelle analogie de comportement existe-t-il entre systèmes binaires liquide-vapeur, et systèmes monomères-copolymère ? e) Expliquer pourquoi, si l'on opère en réacteur fermé, il se produit une dérive en composition du copolymère formé au cours du temps ? Représenter sur le diagramme carré l'évolution de cette dérive ; vous semble-t-elle favorable ou au contraire préjudiciable aux bonnes propriétés du matériau ? Que suggérer alors ? I.B.4) Un autre cas communément rencontré est celui pour lequel r A et r B sont voisins de 0 , ou plus généralement tous deux très inférieurs à 1 . a) Dire, en justifiant votre réponse, quelle est l'architecture du copolymère formé lorsque r A et r B sont voisins de 0 . Quelle est alors l'allure du diaCH 3 gramme carré ? H2C C CH CH 2 b) Pour le couple de monomères CO 2 CH 3 Styrène ( A ) -Méthacrylate de méthyle ( B ) à 70° C on donne : r A = 0, 49 r B = 0, 46 Pour tracer le diagramme carré d'un tel système, il n'est pas nécessaire d'établir l'expression analytique de F A en fonction de f A . Montrer qu'il est possible de calculer les valeurs f A 0, 2 0, 4 0, 6 0, 8 de F A en exploitant les variables intermédiaires F 0, 57 0, 73 x et X . Compléter alors le tableau ci-contre. A c) Les valeurs calculées ci-dessus montrent qu'il existe nécessairement un point d'intersection entre la courbe de composition et la première bissectrice du diagramme carré. En copolymérisation statistique ce point est appelé azéotrope : expliquer pourquoi. Exprimer les coordonnées de l'azéotrope en fonction de r A et r B puis calculer leurs valeurs. d) Établir un tableau regroupant les valeurs de F A en fonction de f A , puis tracer point par point le diagramme carré du poly(styrène-co-méthacrylate de méthyle). On adoptera comme échelle en abscisse et en ordonnée 1 cm pour 0, 1 unité de fraction molaire. Commenter l'allure obtenue en référence à la partie I.A. Quel intérêt essentiel présente le mélange azéotropique des monomères pour le copolymère formé ? Concours Centrale-Supélec 2009 7/14 CHIMIE Filière PC e) Comment évoluera, en réacteur fermé, la composition du copolymère au cours du temps, si l'on part initialement d'un mélange de monomères tel que f A = 0, 30 , puis f A = 0, 70 ? Sera-t-il possible d'atteindre la composition azéotropique dans ces conditions ? I.B.5) Une technique expérimentale largement utilisée pour contrôler la 1 courbe de composition établie à partir du modèle terminal, est la RMN H . Dans le cas du poly(styrène-co-méthacrylate de méthyle), on prépare différents mélanges de monomères dans des tubes scellés, en présence d' AIBN comme amorceur, sous atmosphère de diazote. Les tubes sont placés dans un bain thermostaté à 70° C pendant 30 mn ; ce temps correspond à un taux de conversion du mélange des monomères égal à 3% , ce qui permet de négliger la dérive en composition du copolymère formé. Celui-ci est isolé par précipitation dans le 1 méthanol, puis séché. L'enregistrement du spectre de RMN H est réalisé en solution dans CDCl 3 . On prendra l'exemple d'un mélange de monomères pour lequel f A = 0, 334 ; la valeur calculée de F A issus du modèle terminal est alors 0, 391 . a) Sachant que les unités monomères se lient les unes aux autres suivant une addition tête-queue de façon statistique, écrire un enchaînement possible dans la chaîne du copolymère. b) On note respectivement p et q le nombre d'unités Styrène ( A ) et d'unités Méthacrylate de méthyle ( B ) dans la chaîne du copolymère. Exprimer F A en fonction de p et q . 1 c) Une première lecture du spectre RMN H conduit à identifier, entre autres, deux signaux particuliers ; · un massif centré sur 7 ppm , attribuable aux protons aromatiques de surface relative 1 ; · un massif centré sur 0, 8 attribuable aux protons du groupe méthyle lié à la chaîne carbonée, de surface relative 0, 92 . Déduire de ces résultats la valeur expérimentale de F A . d) Dans certains cas, la séparation du massif centré sur 0, 8 ppm des massifs voisins n'est pas nette ; il est alors préférable de considérer l'ensemble des massifs associés à tous les protons aliphatiques de copolymère. Dans le cas étudié, ces massifs s'échelonnent entre 0, 5 et 3, 7 ppm , et ont une surface relative de 3, 10 (toujours référée aux protons aromatiques de surface relative 1 ). Calculer la contribution des protons aliphatiques des unités méthacrylate de méthyle dans le copolymère, puis en déduire la nouvelle valeur expérimentale de F A . e) Sachant que tous les mélanges de monomères étudiés ont conduit à des résultats analogues à ceux de l'exemple choisi, conclure sur la validité du modèle terminal pour la copolymérisation considérée. Concours Centrale-Supélec 2009 8/14 CHIMIE Filière PC I.B.6) Dans le cas général, l'expression analytique de F A en fonction de f A déduite de l'équation de Mayo-Lewis, s'écrit : 2 r A f A + f A(1 f A) F A = ----------------------------------------------------------------------------------------. 2 2 r A f A + 2 f A(1 f A) + rB(1 f A) dF df A 1 rB dF df A 1 rA On en déduit que si f A A 0 alors, -----------A- A ------ et si f A A 1 alors -----------A- A ------ . a) Retrouver le fait que pour obtenir l'architecture du I.B.4-a), les rapports de réactivité doivent tendre vers 0 . b) Sachant qu'en copolymérisation radicalaire on ne connaît aucun couple de monomères caractérisés par r A > 1 et r B > 1 , est-il possible de rencontrer un diagramme carré avec une courbe en forme de S (telle que définie dans le I.A.2-e) ? Si non, dites pourquoi ; si oui, dans quel cas ? Comparer à la réponse donnée dans le I.A.2-e). Partie II - Synthèse de l'indinavir L'indinavir, dont le nom comPh OH OH N H mercial est Crixivan, est un médicament anti VIH . C'est N N N un composé qui doit être syn1 thétisé en grande quantité (le H O N traitement d'un patient O Indinavir nécessitant quasiment un tBu kilogramme par an) tout en contrôlant parfaitement la stéréochimie de chacun des centres asymétriques. Remarques : · les différentes parties du problème sont indépendantes ; · lors de l'écriture de mécanismes, il n'est pas nécessaire d'écrire les molécules dans leur intégralité ; seul le fragment utile pour expliquer la réaction sera représenté. Lorsqu'on vous demande d'identifier une structure, il faudra par contre la dessiner complètement ; · toute réponse doit être justifiée, sans donner nécessairement lieu à de longs développements. II.A - Stéréochimie de l'indinavir II.A.1) Combien ce composé compte-t-il d'atomes de carbone asymétriques et de stéréoisomères de configuration ? Concours Centrale-Supélec 2009 9/14 CHIMIE Filière PC II.A.2) Quelle est la configuration absolue de l'atome de carbone asymétrique numéroté 1 sur la figure ci-dessus ? tBuO O O N Cl Cl Ph O H TsO N OH H N C B A NH 2 NH tBu D O E Nous allons dans premier temps nous intéresser à l'élaboration des 5 synthons A , B , C , D , E ci-dessus dont trois devront être préparés sous forme d'énantiomères purs. Les groupements Ph , tBu et TsO représentent respectivement les groupements phényle, tertiobutyle : C ( CH 3 ) 3 et paratoluènesulfonyle : O S CH 3 O II.B - Synthèse du synthon A II.B.1) Rappeler les réactifs et les conditions opératoires permettant de passer du benzène au toluène Ph CH 3 . Préciser le mécanisme de la réaction. L'action du dibrome en présence de lumière sur le toluène conduit à la substitution d'un des atomes d'hydrogène du groupement méthyle par un atome de brome. spectre 1 spectre 2 II.B.2) Un des spectres RMN ci-dessus correspond au toluène, l'autre à Ph CH 2 Br . Attribuer le spectre en justifiant votre réponse. Concours Centrale-Supélec 2009 10/14 CHIMIE Filière PC II.B.3) Qu'aurait donné l'action du dibrome sur le toluène en présence de chlorure d'aluminium ? II.B.4) Comment peut-on passer de Ph CH 2 Br au composé A ? On pourra utiliser n'importe quel réactif organique, minéral ou solvant. II.C - Synthèse du synthon B II.C.1) La pyridine est-elle un composé aromatique ? Combien l'atome d'azote apporte-t-il d'électrons au système / ? Les réactions de substitution électrophile étant difficiles sur la pyridine, il est souvent plus facile de synthétiser directement la pyridine substituée. pyridine N COOEt Br 2 Br O H 2 O, 0°C 1 OH 2 Br 3 O 4 COOEt II.C.2) a) La réaction du dibrome sur le cyclopentène dans l'eau conduit au bromoalcool 1 . Proposer un mécanisme pour cette réaction et préciser la stéréochimie du produit obtenu. Le produit obtenu est-il optiquement actif ? b) Préciser les conditions expérimentales permettant de passer de 1 à 2 . c) Proposer une synthèse de 3 à partir de 2 et de n'importe quel réactif organique ou minéral. d) Comment effectuer H + H la transformation de 3 COOEt HO N H 2 , H COOEt en 4 ? 4 II.C.3) L'action de N N l'hydroxylamine 5 6 OH sur 4 en N H 2 OH milieu acide conduit, dans un premier temps à l'intermédiaire 5 qui se déshydrate ensuite en 6 . Proposer un mécanisme pour ces transformations. Quelle est la force motrice de la transformation 5 A 6 ? II.C.4) Comment passer de 6 au composé B ? On précisera réactif organique, minéral et solvant si nécessaire. II.D - Synthèse du synthon C Le composé de départ est l'alcool allylique 7 : Concours Centrale-Supélec 2009 HO 7 11/14 CHIMIE Filière PC K.B. Sharpless a mis au point une méthode particulièrement efficace pour réaliser une époxydation énantiosélective d'un alcool allylique en présence de tartrate de diéthyle. Avec cette méthode, on synthétise l'époxyde 8 ce qui permet de conduire à C avec la stéréochimie souhaitée. II.D.1) La structure du ( + ) -tartrate de diéthyle est OH représentée ci-contre. Combien ce composé compte t-il CO 2 Et de stéréoisomères de configuration ? Les représenter dans l'espace et préciser, si c'est possible, le signe de EtO 2 C leur pouvoir rotatoire. OH L'interprétation de la stéréochimie de la réaction ( + ) tartrate de dithyle d'époxydation de Sharpless peut se modéliser de la façon suivante. En plaçant l'alcool allylique dans un plan ( - ) tartrate de dithyle comme sur la figure ci-contre, l'utilisation de ( - ) -tartrate de diéthyle permet une époxydaHO tion par le dessus et c'est l'inverse avec le ( + ) tartrate de diéthyle. ( + ) + tartrate de dithyle II.D.2) a) À l'aide de ce résultat, préciser si l'on doit, pour cette réaction d'époxydation, utiliser du ( + ) ou du ( - ) tartrate de diéthyle (aucun mécanisme n'est demandé). b) En notant [ R ] et [ S ] les concentrations respectives en énantiomères R et S dans le mélange, on définit l'excès énantiomérique par [ R] [S] ee = 100 --------------------------- . [ R] + [S] Dans cette synthèse, l'excès énantiomérique atteint 94% . Quels sont les pourcentages de composés R et S dans le mélange ? c) Combien le spectre RMN de 8 fait-il apparaître de groupes de protons magnétiquement équivalents ? II.D.3) On fait réagir 8 sur le chlorure de O TsCl l'acide paratoluène sulfonique : TsCl afin d'obteCH 3 nir C . Préciser le mécanisme de cette réaction Cl S O ( TsCl réagissant comme un chlorure d'acyle). II.D.4) Considérons la réacO O -- tion d'un nucléophile Nu sur Nu + Nu +TsO C correspondant à la transforH TsO mation suivante : C H Proposer un mécanisme pour cette réaction. Concours Centrale-Supélec 2009 12/14 CHIMIE Filière PC II.E - Synthèse du synthon D O O O HN NH tBuO N tBuO O N H O N H tBu 9 N O tBu 10 O Ph O OtBu 11 O Ph O Cl 12 Notre point de départ sera le composé 9 que l'on transforme en 10 . On dispose pour cela des réactifs 11 et 12 . II.E.1) Quel est l'atome d'azote le plus nucléophile de 9 ? Dans quel ordre doit-on faire réagir 11 et 12 pour passer de 9 à 10 ? II.E.2) L'hydrogénation de 10 , suivie d'une déprotection sélective d'une des fonctions amide conduit à D . a) Citer un catalyseur d'hydrogénation. Quelle est la stéréochimie de cette réaction ? b) Le catalyseur précédent permet-il d'obtenir D avec la stéréochimie souhaitée ? II.F - Synthèse du synthon E CH 3 N L'indène 13 est le composé de départ O pour cette synthèse. 13 II.F.1) L'indène est-il un composé 16 aromatique ? II.F.2) Comment passer de 13 à l'époxyde correspondant 14 ? Le mélange obtenu est-il optiquement actif ? II.F.3) Le traitement de 14 par l'acétonitrile CH 3 CN en milieu acide conduit à 16 . a) Donner la structure de l'intermédiaire réactionnel 15 majoritairement obtenu lors de l'ouverture de l'époxyde 14 en milieu acide. b) Proposer alors un mécanisme pour la transformation 15 A 16 (sans se soucier de la stéréochimie de la réaction). L'hydrolyse de 16 donne E sous forme de mélange racémique. L'utilisation d'acide tartrique HOOC CHOH CHOH COOH permet alors la résolution du mélange racémique précédent. Concours Centrale-Supélec 2009 13/14 CHIMIE Filière PC II.F.4) a) Proposer une méthode de séparation d'un mélange d'énantiomères ? b) A-t-on intérêt ici à utiliser le dérivé méso ( 2 R 3S ) de l'acide tartrique ou un des énantiomères purs ( 2 R 3 R ou 2S 3S ) ? c) Quelle est la réaction mise en jeu, ici lors de l'action de l'acide tartrique sur E à température ambiante ? II.G - Synthèse de l'indinavir II.G.1) On souhaite réaliser l'acylation de la fonction amine de E à l'aide du réactif A . Il n'est pas nécessaire ici de protéger la fonction alcool ; expliquer pourquoi. Donner la structure du composé 17 alors obtenu. II.G.2) On traite 17 à O O l'aide de l'éther d'énol 18 en milieu acide. N Ph Ph N O O Expliquer l'obtention OCH 3 de 19 . O II.G.3) 19 Le passage de 19 à 21 21 18 est effectué grâce à l'action d'une base dans un premier temps. L'intermédiaire 20 obtenu est, dans un second temps, opposé à C (mécanisme similaire à celui évoqué au II.D.4). On obtient un mélange de diastéréoisomères 21 et 21v dans un rapport 96 : 4 le composé majoritaire étant 21 . a) Quelle base peut-on utiliser ? Doit-on l'introduire, a priori, en quantité stoechiométrique ou catalytique ? Quelle est la structure de l'intermédiaire 20 ? b) Justifier la stéréochimie des carbones asymétriques de 21 . Quelle est la structure du composé 21v ? II.G.4) 21 est ensuite opposé au composé D . On obtient le composé 22 . Donner sa structure ainsi que le mécanisme de sa formation. 1 II.G.5) L'action d'acide chlorhydrique à 6 mol u L permet de libérer les différents groupements protecteurs de 22 . On obtient ainsi le composé 23 qu'il reste alors à faire réagir sur B pour obtenir l'indinavir. Quelle est la structure de 23 ? Nommer le mécanisme qui permet de passer de 23 à l'indinavir. ··· FIN ··· Concours Centrale-Supélec 2009 14/14
