CCINP Chimie 2 PC 2013
| Thème de l'épreuve | L'électron en chimie et la synthèse de la citréoviridine |
| Principaux outils utilisés | diagramme des orbitales moléculaires, cinétique, thermochimie, cristallographie, diagramme binaire, chimie organique |
| Mots clefs | électron, pile à combustible, alliage, citréoviridine |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
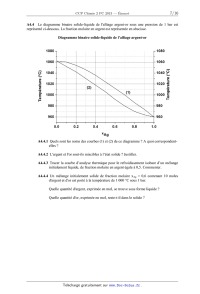
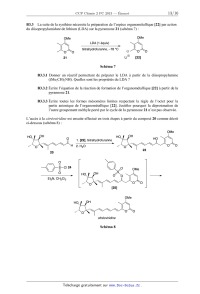
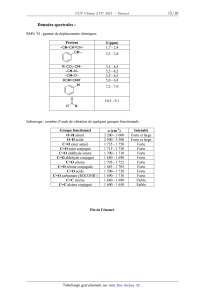
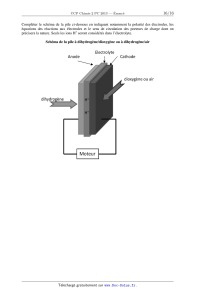
SESSION 2013 PCCH209 _:â=_ CONCOURS COMMUNS - - POLYTECHNIQUES EPREUVE SPECIFIQUE - FILIERE PC CHIMIE 2 Durée : 4 heures N.B. : Le candidat attachera la plus grande importance à la clarté, & la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d 'énonce', il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu 'il a été amené à prendre. | Les calculatrices sont autorisées | Le document--réponse distribué avec le sujet doit être joint à la copie. Les parties A et B sont indépendantes et dans chacune d'elles, certaines questions peuvent être traitées séparément. Toute démonstration illisible ou incompréhensible sera considérée comme fausse. Partie A : l'électron en chimie, de l'atome au métal Cette partie comporte quatre sous--parties largement indépendantes. Dans chaque sous--partie, certaines questions peuvent être traitées indépendamment des précédentes. La sous--partie A] s'intéresse à la classification périodique et aux configurations électroniques des atomes et molécules. La sous--partie A2 traite de l'observation, en temps réel, de l'électron et de sa réactivité. La sous--partie A3 s'intéresse aux phénomènes de transfert des électrons et, en particulier, aux piles à combustible. Enfin, l'étude d'un métal et d'un alliage est le sujet de la dernière sous--partie A4. Partie B : synthèse de la citréoviridine Pour l'écriture des mécanismes, à chaque fois qu'il le juge nécessaire, le candidat pourra utiliser des notations simplifiées des molécules lui permettant de se concentrer sur les fonctions réactives. Les données spectrales sont mentionnées en fin de sujet. 1/15 Partie A. L'électron en chimie, de l'atome au métal Données : Nombre d'Avogadro NA = 6,022 x 1023 mol". Numéros atomiques : Elément H F P S Z 1 9 15 16 Niveaux énergétiques de différentes orbitales atomiques (OA) de l'hydrogène et du fluor : E,,(H) = - 13,6 eV E2S(F) = - 37,9 eV E2p(F) = - 19,4 eV. Coefficient d'absorption molaire de l'électron dans l'ammoniac à 800 nm, à 25 ° C : 5 = 4 700 L mol_1 cm_l. Masse molaire atomique de l'hydrogène : M(H) = 1 g mol--1. Constante de Faraday : F = 96 485 C mol"1 . Constante d'état des gaz parfaits : R = 8,314 J mol_1 K_1. Enthalpie molaire standard de formation de Hng à 298 K : AfH°(HzO(l)) : - 285,8 kJ.mol'l. Entropies molaires standards à 298 K : composé 02(g) H2(g) H2Ofl) s;,(J - K--1 -mol_l) 205 131 70 A]. De l'atome à la molécule A1.1 Écrire la configuration électronique des atomes de phosphore et de soufre dans leur état fondamental. Donner, pour chacun d'eux, leur nombre d'électrons de valence. A quelles colonnes de la classification périodique appartiennent les éléments phosphore et soufre ? A1.2 Qu'est-ce que l'énergie de première ionisation ? Comment évolue-t--elle dans la classification périodique ? Expliquer le fait que l'énergie de première ionisation du phosphore (1 012 kJ.mol'l) soit légèrement supérieure à celle du soufre (1 000 kJ.mol'l). Dans tout ce qui suit, OA et OM correspondent respectivement à orbitale atomique et orbitale moléculaire. On s'intéresse à la répartition des électrons dans la molécule de fluorure d'hydrogène HF. A1.3 Écrire la configuration électronique des atomes d'hydrogène et de fluor dans leur état fondamental. On se propose de tracer le diagramme des OM de la molécule de fluorure d'hydrogène HF. On procède par combinaison des OA en se limitant aux OA des électrons de valence. On choisit l'axe 2 comme axe de la molécule. 2/15 A1.4 Expliquer les règles de construction des OM d'une molécule diatomique. On précise que les règles utilisées pour construire les diagrammes d'OM des molécules homonucléaires sont généralisables aux molécules hétéronucléaires. Justifier le fait que l'interaction entre l'orbitale ls de l'atome d'hydrogène et l'orbitale 2s de l'atome de fluor puisse être négligée. Quelles sont alors les interactions entre OA de l'atome d'hydrogène et OA de l'atome de fluor à prendre en compte ? A1.5 Représenter, sur un diagramme d'énergie, les différentes OM de HF. Préciser le caractère liant, non--liant ou antiliant de chaque OM. On précise ici qu'une OA qui ne peut pas interagir avec une autre OA conduit à une OM non liante. A1.6 Placer les électrons dans les OM représentées àla question A1.5. A1.7 Quel est l'indice de liaison de HF ? Est-il compatible avec ce qui est attendu en utilisant le modéle de Lewis ? A2. L'électron solvaté dans l'ammoniac Lorsqu'on ajoute du sodium dans de l'ammoniac liquide, on obtient une solution dont la couleur devient bleu foncé La mesure de la conductivité de cette solution montre qu'il existe des espèces ioniques en solution. Plus précisément, on observe la formation d'électrons solvatés dans l'ammoniac. A2.] Écrire l'équation de la réaction de formation, en présence de sodium, de l'électron solvaté dans l'ammoniac. On symbolisera par eÂm l'électron solvaté dans l'ammoniac. A2.2 Expérimentalement, on forme l'électron solvaté dans l'ammoniac liquide à une date t = 0, puis on étudie sa cinétique de disparition, en mesurant, en fonction du temps, l'évolution de l'absorbance de la solution placée dans une cellule de 1 cm d'épaisseur à une longueur d'onde de 800 nm. Les évolutions de l'absorbance A, mesurée à 800 nm, ainsi que de l'opposé de la dérivée de l'absorbance par rapport au temps, sont données dans le tableau ci-dessous. On considère que cette absorbance est uniquement due àla présence de l'électron solvaté dans la solution. Temps (us) AbsorbanceA - dA/dt (105 s'1) 0 0,298 0,2 0,189 3,104 0,4 0,141 1,845 0,6 0,113 1,256 0,8 0,093 0,906 1,0 0,078 0,679 1,2 0,065 0,507 1,4 0,056 0,402 1,6 0,049 0,328 1,8 0,043 0,269 2,0 0,038 0,225 2,5 0,028 0,146 3,0 0,022 0,106 3,5 0,017 0,076 3/15 Déterminer la valeur de la concentration molaire en électron solvaté à l'instant t = O. A2.3 En étudiant les données relatives à l'intervalle de temps [0 us ; 1 us] et en utilisant la méthode intégrale, montrer que la réaction de disparition de l'électron suit une loi de vitesse d'ordre 2 durant la premiére microseconde. En déduire la valeur de sa constante de vitesse. A2.4 On peut supposer que l'électron disparait par réaction avec une autre espèce qui a une concentration molaire identique à celle de l'électron. La constante de vitesse particulaire, kdfi , limitée par la diffusion de ces deux espèces, peut être calculée grâce à l'expression suivante : kdfi : 47ÏÎ"D . où r représente la distance d'approche des deux espèces et D est la somme des coefficients de diffusion de ces espèces dans l'ammoniac. On prendra ici r = 0,57 nm et D = 1,1 x 10--4cm2 -s_1 . Calculer la constante de vitesse molaire limitée par la diffusion en utilisant les unités L, mol et s. Comparer le résultat avec la valeur expérimentale obtenue dans la question précédente Commenter. A2.5 On s'intéresse désormais à la totalité de la courbe de disparition de l'électron solvaté. A2.5.1 Montrer que l'hypothèse d'un ordre 2 n'est plus satisfaite pour l'ensemble des données relatives à l'intervalle de temps [0 us ; 3,5 us]. A2.5.2 Montrer alors que la totalité de la courbe peut être interprétée par une compétition entre un mécanisme d'ordre 1 et un mécanisme d'ordre 2. Pour cela, on pourra exprimer -- dA / dt en fonction de A et de A2 . . . . dA ] , . . A2.5.3 En ut1hsant la foncüon -- d--XÎ , determmer les deux constantes de v1tesse t ! associées aux mécanismes d'ordre 1 et d'ordre 2, sans utiliser la valeur de la constante de vitesse trouvée à la question A2.3. A3. Réactions de transfert d'électrons : l'exemple des piles à combustible On considère ici une cellule galvanique de force électromotrice (tension à vide) 6. La température est notée T. On envisage une transformation élémentaire, supposée réversible, lors du fonctionnement de la pile. A3.1 Exprimer le travail électrique élémentaire ôWe transféré par la pile au milieu extérieur en fonction de la force électromotrice e, du nombre n d£ d'électrons transférés pour l'avancement élémentaire d£ associé à la réaction modélisant le fonctionnement de la pile. A3.2 En utilisant le premier et le second principe de la thermodynamique, exprimer la variation élémentaire dG de l'enthalpie libre en fonction, entre autre, du travail électrique élémentaire ôWe transféré par la pile au milieu extérieur. Montrer alors que A,.G = - nFe, où A,.G est l'enthalpie libre de la réaction. 4/15 A3.3 Exprimer l'entropie et l'enthalpie de la réaction (respectivement AFS et ArH) en fonction de Ô n, e, Tet (_e] . ÔT pê On s'intéresse dans ce qui suit aux piles à combustible. La pile à combustible est une cellule galvanique alimentée en continu en réducteur et en oxydant. Un exemple de pile à combustible est la pile à dihydrogène/dioxygène ou a dihydrogène/air. Comme dans une pile électrochimique ou dans une batterie, la pile à combustible est constituée de deux électrodes et d'un électrolyte (membrane polymère). A3.4 Quel(s) est (sont) l'(les) avantage(s) d'une pile à combustible par rapport a une batterie ? A3.5 On considère les couples d'oxydoréduction mis en jeu dans la pile à dihydrogène/dioxygène ou a dihydrogène/air : H+(aq)/H2(g) et 02(g)/H20(1). Écrire les demi--équations électroniques pour chaque couple. Écrire l'équation de la réaction modélisant la transformation du système quand la pile débite. Le schéma (ci-dessous) de la pile est donné dans le document-réponse. Compléter le schéma de la pile sur le document--réponse en indiquant notamment la polarité des électrodes, les équations des réactions aux électrodes et le sens de circulation des porteurs de charge dont on précisera la nature. Seuls les ions H+ seront considérés dans l'électrolyte. Schéma de la pile à dihydrogène/dioxygène ou à dihydrogène/air Electrolyte Anode \ Cathode dioxygène ou air dihydro gène _ MOÎEURHI' _ 5/15 A3.6 Le rendement énergétique 17 d'une pile est défini comme le rapport entre l'énergie électrique fournie et l'énergie thermique transférée par le système pendant la réaction. Pour un fonctionnement réversible, supposé isotherme et isobare, exprimer ce rendement en fonction des grandeurs thermodynamiques AVG et A,,H caractéristiques de la réaction de fonctionnement de la pile. On pourra utiliser les réponses àla question A3.2. Dans tout ce qui suit, le dihydrogène et le dioxygène alimentant la pile à combustible sont supposés purs, leur pression étant égale à P" = 1 bar. A3.7 Déterminer la valeur du rendement de la pile en fonctionnement à 298 K. Commenter sa valeur. A3.8 Déterminer la valeur de la force électromotrice de la pile à 298 K. A3.9 Donner l'expression de l'évolution de la force électromotrice e en fonction de la température T. On supposera que les enthalpies et entropies molaires standards ne varient pas avec la température, dans la gamme de températures considérées. A3.10 La tension fournie par la pile est de 0,7 V à 298 K. Comment expliquer la différence entre cette valeur et la valeur calculée ? A3.11 Dans ces conditions, pour une intensité de 200 A, les piles sont groupées en série de 32, afin d'obtenir une puissance suffisante pour faire fonctionner un moteur électrique. Quelle masse de dihydrogène sera consommée par ces 32 piles après 100 h de fonctionnement ? A4. Les métaux A4.] Comment se comportent les électrons dans un métal ? Quelles sont les propriétés des métaux ? Dans ce qui suit, on étudiera le métal argent, ainsi qu'un alliage or-argent. L'argent a un rayon atomique R = 144 pm. Il cristallise selon une maille cubique à faces centrées (cfc). La masse molaire de l'argent est de 108 g.mol". A4.2 Calculer la masse volumique de l'argent. A4.3 L'argent et l'or cristallisent en formant un alliage. Cet alliage peut être un alliage d'insertion ou de substitution. Le rayon atomique de l'or a pour valeur R' = 147 pm et sa masse molaire vautM= 197 g.mol". A4.3.1 Définir ces deux types d'alliage. A4.3.2 Représenter les deux types de sites interstitiels après les avoir définis. A4.3.3 Calculer le rayon RO d'un site octaédrique. Calculer également le rayon RT d'un site tétraédrique. A4.3.4 L'alliage or-argent est-il un alliage d'insertion ou de substitution ? Justifier. 6/15 A4.4 Le diagramme binaire solide--liquide de l'alliage argent-or sous une pression de 1 bar est représenté ci-dessous. La fraction molaire en argent est représentée en abscisse. Diagramme binaire solide-liquide de l'alliage argent-or 1080-- g â È . â --1080 1060 1060 33 1040 1040 %__'_ --.;: 3 1020 1020 ;; E --$ \3 Q. & 1000 1000Ë 1°-' |- 980 980 960 @ ÿ @ ÿ i 960 0.0 0.2 0.4 0.6 0.8 1.0 XAg A4.4.1 Quels sont les noms des courbes (1) et (2) de ce diagramme ? A quoi correspondent- elles ? A4.4.2 L'argent et l'or sont--ils miscibles à l'état solide ? Justifier. A4.4.3 Tracer la courbe d'analyse thermique pour le refroidissement isobare d'un mélange initialement liquide, de fraction molaire en argent égale à 0,5. Commenter. A4.4.4 Un mélange initialement solide de fraction molaire XAg = 0,6 contenant 10 moles d'argent et d'or est porté à la température de 1 000 °C sous 1 bar. Quelle quantité d'argent, exprimée en mol, se trouve sous forme liquide ? Quelle quantité d'or, exprimée en mol, reste-t--il dans le solide ? 7/15 Partie B. Synthèse de la citréoviridine Plus de 200 espèces de moisissures produisent des agents d'intoxication alimentaire. Il s'agit de mycotoxines dont les manifestations sont nombreuses, certaines étant mutagènes et cancérigènes, d'autres endommageant des organes particuliers (foie, reins, système nerveux. . .). Elles sont souvent produites sur des céréales moisies comme les aflatoxines sur toutes les céréales oléagineuses, les ochratoxines sur le maïs, le seigle et l'orge, ou encore la citréoviridine sur le riz et l'orge. La structure de chacun de ces composés est proposée ci-dessous : HO, H ... H 0 " | \ e __... \ \ \ \ o 0 Cl aflaz'oxine B1 ochraz'oxine A citréoviridine Le rôle des moisissures dans les toxi-infections n'a attiré l'attention des chercheurs que depuis une trentaine d'années, àla suite de l'intoxication massive de milliers de volailles en Angleterre. Dans ce problème, nous nous proposons d'étudier la synthèse asymétrique de la citréoviridine décrite par le groupe de Williams (T he Journal of Organic Chemistry 1987, 52, 5067--5079) à partir de la 3-(benzyloxy)butanone chirale 1 via les intermédiaires 9 et 16 (schéma 1) : OMG 0 OH MeO/\/ H | \ :> \'. . \ \ \ \ o o \' o O citréoviridine Schéma 1 8/15 BI. Synthèse de l'intermédiaire 9 La synthèse de l'intermédiaire 9 utilise la 3-(benzyloxy)butanone chirale 1 comme composé de départ. Les premières étapes de la synthèse sont données ci-après (schéma 2) : O 1. /\ ' C6H5VO MgBr, tetrahydrofuranne> 2. Hydrolyse acide 1 MeO M OCH Cl ? xQ e ( 2)2 > 3 _» C6H5VO ' H + H2CO Me CH NEt (R'/q) ( 2 )2 4 O Schéma2 B1.1 Représenter les deux isomères du composé 2 qui peuvent se former à partir de la 3-(benzyloxy)butanone chirale 1. Quelle relation d'isomérie lie ces isomères ? B1.2 En pratique, les auteurs n'obtiennent que l'isomère du composé 2 de configuration (RR). Le dessiner en convention spatiale de Gram en justifiant la représentation. B1.3 Représenter le composé 3. Écrire l'équation de la réaction de formation du composé 3 à partir de l'isomère du produit 2 de configuration (R,R) en précisant bien le rôle de la diisopropyléthylamine ((Me2CH)2NEt). Nommer le mécanisme de cette réaction. B1.4 Proposer une séquence réactionnelle pour la formation de l'aldéhyde 4, à partir du composé 3, du méthanal (H2CO) étant obtenu comme autre produit de la réaction. L'aldéhyde 4 est ensuite mis en réaction avec l'organomagnésien 6 (réactif de Grignard) préparé à partir du bromé vinylique 5 (schéma 3) : Br ,? MgBr 5 6 MeO 1) a) 6, tétrahydrofuranne MeO --__ b) Hydrolyse aolde __ 2) Chromatographie séparative sur silice i Schéma 3 B1.5 Donner un réactif et les précautions opératoires pour préparer l'organomagnésien 6 à partir du bromé vinylique 5. Ecrire les équations des réactions secondaires à éviter. B1.6 Ecrire le mécanisme de la réaction du composé 4 avec l'organomagnésien 6. A quoi sert la chromatographie séparative sur silice dans ce protocole ? 9/15 B1.7 Nommer les groupes caractéristiques (fonctions) présents dans le composé 7. La synthèse se poursuit par une cyclisation effectuée par réaction d'iodo-éthérification sur le composé 7. Cette réaction passe l'intermédiaire cyclique 8 comme décrit ci-après (schéma 4) : Schéma 4 B1.8 Proposer un mécanisme réactionnel pour rendre compte de cette transformation (on ne s'intéressera pas àla stéréosélectivité de la réaction). BZ. Synthèse de l'intermédiaire 16 La synthèse de l'intermédiaire 16 est ensuite effectuée à partir du composé 9 en six étapes décrites ci-dessous (schéma 5) : o C6H5/\OJ\CI 10 Et3N -- V tétrahydrofuranne réduction et déprotection _» Schéma 5 B2.1 Le composé 9 réagit avec le chlorure de benzyloxyméthanoyle 10 en présence de triéthylamine (Et3N) et conduit à la formation du produit 11. Écrire le mécanisme réactionnel de la formation du produit 11. 10/15 B2.2 À quel mécanisme correspond la transformation du dérivé iodé 11 en composé 12 ? Proposer un réactif pour effectuer cette transformation. B2.3 En l'absence d'ozone, indiquer une méthode de formation de l'aldéhyde 13, à partir du composé 12. B2.4 Proposer un réactif pour la formation du composé 14 à partir de l'aldéhyde 13. Donner une méthode de préparation de ce réactif. B2.5 Proposer un réactif pour obtenir l'intermédiaire 16 à partir du composé 15. Donner la composition de ce réactif. Représenter le produit secondaire de formule brute C14H2205 également obtenu lors de cette réaction. B2.6 Quelle est la propriété de la double liaison de l'intermédiaire 16 ? B2.7 Les auteurs isolent l'intermédiaire 16 dont la pureté est analysée par chromatographie sur couche mince (CCM), spectroscopie de résonance magnétique nucléaire du proton (RMN 1H) et spectroscopie infrarouge (IR). B2.7.1 L'analyse chromatographique de la pureté de l'intermédiaire 16 est effectuée en déposant sur une même plaque de gel de silice une petite quantité du composé 15 et de l'intermédiaire 16 en solution dans le dichlorométhane. Après élution avec un mélange tétrahydrofuranne/dichlorométhane (proportion volumique = l/4) puis révélation avec une solution de permanganate de potassium, la plaque chromatographique obtenue est la suivante (figure 1) : front du solvant @ 0 ligne de depot ; ; composé 15 5 intermédiaire 16 Figure 1 À l'aide de la figure 1, calculer les rapports frontaux notés Rf pour le composé 15 et l'intermédiaire 16. Justifier la position relative des taches correspondant au composé 15 et à l'intermédiaire 16 en rappelant succinctement le principe de la CCM. B2.7.2 L'analyse de la pureté de l'intermédiaire 16 par spectroscopie RMN 1H est effectuée en comparant les spectres du composé 15 et de l'intermédiaire 16 obtenus à 360 MHZ dans le chloroforme deutéré (CDCh). Ces spectres présentent, entre autre, des signaux caractéristiques dont les déplacements chimiques 8 (exprimés en ppm = partie par million), les multiplicités et le nombre d'hydrogènes correspondant sont donnés page suivante. 11/15 Composé 15 : 5,74 ppm (singulet, 1 H). Intermédiaire 16 : 9,15 ppm (singulet, 1 H) et 6,69 ppm (singulet, 1 H). Proposer une attribution de chacun des signaux à un proton caractéristique du composé 15 et de l'intermédiaire 16 en RMN 1H. B2.7.3 L'analyse de la pureté de l'intermédiaire 16 par spectroscopie IR est effectuée en comparant les spectres d'absorption du composé 15 et de l'intermédiaire 16. Ces spectres présentent, entre autre, des bandes d'absorption caractéristiques dont les . , _1 , . nombres d'onde (expr1mes en cm ) et les allures sont donnes c1-dessous : Composé 15 : 3 450 cm_1 (intense et large). Intermédiaire 16 : 3 435 cm_1 (intense et large) et 1 680 cm_1 (intense). Proposer une attribution de chacune des bandes d'absorption à un (ou des) groupe(s) caractéristique(s) présent(s) dans le composé 15 et dans l'intermédiaire 16. B3. Accès àla citréoviridine La synthèse de la citréoviridine se poursuit. L'intermédiaire 16 est tout d'abord transformé en composé 20 comme suit (schéma 6) : (C6H5)3PWCOZEt 17 18 1. LiAIH4, tétrahydrofuranne tétrahydrofuranne ' 2. H20 oxydation 0 _, \ '" WH 20 Schéma 6 B3.1 La réaction du composé 16 avec l'ylure de phosphore 17 conduit à un unique composé 18 dont toutes les doubles liaisons ont une configuration (E). Dessiner le composé 18 en convention spatiale de Cram en justifiant la représentation. B3.2 Représenter le produit 19 en convention spatiale de Cram. À quel type de réaction correspond sa formation à partir du composé 18 ? 12/15 B3.3 La suite de la synthèse nécessite la préparation de l'espèce organométallique [22] par action du diisopropylamidure de lithium (LDA) sur la pyrannone 21 (schéma 7) : OMe OMe \ LDA(1équiv) _ | \ | O O tétrahydrofuranne,--78 °C @ O 0 21 u® [22] Schéma 7 B3.3.1 Donner un réactif permettant de préparer le LDA à partir de la diisopropylamine ((Me2CH)2NH). Quelles sont les propriétés du LDA ? B3.3.2 Écrire l'équation de la réaction de formation de l'organométallique [22] à partir de la pyrannone 21. B3.3.3 Écrire toutes les formes mésomères limites respectant la règle de l'octet pour la partie anionique de l'organométallique [22]. Justifier pourquoi la déprotonation de l'autre groupement méthyle porté par le cycle de la pyrannone 21 n'est pas observée. L'accès à la citréoviridz'ne est ensuite effectué en trois étapes à partir du composé 20 comme décrit ci-dessous (schéma 8) : OMe \ 1- [22], tétrahydrofuranne HO | H 2. H20 ' o o Et3N, CHZCl2 OMe | \ \ \ \ O O citréoviridine Schéma 8 13/15 B3.4 Le groupe tosylate (figure 2) est un excellent groupe partant très utilisé en synthèse organique : Il @ groupe tosylate : --< >--5--0 || Figure 2 B3.4.1 Justifier pourquoi le groupe tosylate est un excellent groupe partant. B3.4.2 Normalement, le composé obtenu par réaction entre un alcool et le chlorure de tosyle 24 est stable. Justifier pourquoi, lors de cette synthèse, l'intermédiaire [25] obtenu par réaction du composé 23 avec le chlorure de tosyle 24 n'est pas stable et conduit directement à la formation de la citréoviridine. 14/15 Données spectrales : RMN 1H : gamme de déplacements chimiques Protons 8 (ppm) --CH--CH=CH-- 1,7 - 2,4 ./CH_ 2,3 - 2,8 R--COZ--CH-- 3,5 - 4,5 --CH--N-- 3,5 - 4,5 --CH--O-- 3,5 - 4,5 RCH=CHR' 5,0 - 6,8 ./H 7,2 - 7,9 i 10,3 - 9,1 R H Infrarouge : nombre d'onde de vibration de quelques groupes fonctionnels Groupe fonctionnel o (cm--1) Intensité O--H alcool 3 200 - 3 600 Forte et large O--H acide 2 500 - 3 300 Forte et large C=O ester saturé 1 735 - 1 750 Forte C=O ester conjugué 1 715 - 1 730 Forte C=O aldéhyde saturé 1 700 - 1 710 Forte C=O aldéhyde conjugué 1 680 - 1 690 Forte C=O cétone 1 705 - 1 725 Forte C=O cétone conjuguée 1 685 - 1 705 Forte C=O acide 1 700 - 1 720 Forte C=O carbamate (ROCONR') 1 690 - 1 710 Forte C=C alcène 1 640 - 1 690 Faible C=C alcène conjugué 1 600 - 1 650 Faible Fin de l'énoncé 15/15 Compléter le schéma de la pile ci-dessous en indiquant notamment la polarité des électrodes, les équations des réactions aux électrodes et le sens de circulation des porteurs de charge dont on précisera la nature. Seuls les ions H+ seront considérés dans l'électrolyte. Schéma de la pile à dihydrogène/dioxygène ou à dihydrogène/air Electrolyte Anode Cathode \ dioxygène ou air dihydrogène ' -- Moteur 2/2
