CCINP Chimie PC 2021
| Thème de l'épreuve | Synthèse asymétrique de la (-)-swainsonine. Le chlorure d'or (III). |
| Principaux outils utilisés | chimie organique, cristallographie, cinétique chimique, oxydoréduction, courbes courant-potentiel, thermodynamique, orbitales moléculaires |
| Mots clefs | synthèse asymétrique, or, chlorure d'or, complexes |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
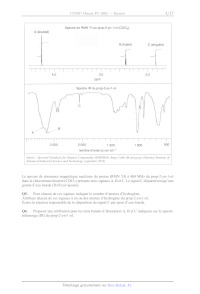
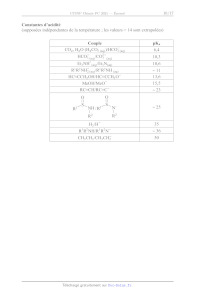
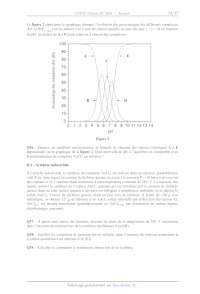
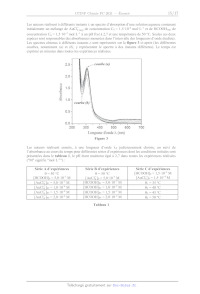
SESSION 2021 PC3C GP CONCOURS COMMUN INP ÉPREUVE SPÉCIFIQUE - FILIÈRE PC CHIMIE Durée : 4 heures N.B. : le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a êté amené à prendre. RAPPEL DES CONSIGNES «_ Utiliser uniquement un stylo noir ou bleu foncé non efjaçable pour la rédaction de votre composition ; d'autres couleurs, excepté le vert, peuvent être utilisées, mais exclusivement pour les schémas et la mise en évidence des résultats. ° Ne pas utiliser de correcteur. «_ Écrire le mot FIN à la fin de votre composition. Les calculatrices sont autorisées. Le sujet est composé de deux problèmes indépendants. Chaque problème est constitué de parties indépendantes. Des données sont disponibles à la fin de chaque problème. Toute réponse devra être clairement justifiée. 1/17 PROBLÈME 1 Synthèse asymétrique de la (-)-swainsonine La (---)-swainsonine est un alcaloïde toxique présent dans plusieurs espèces de plantes à fleurs de l'ouest de l'Australie et du sud des États-Unis d' Amérique qui sont responsables de l'intoxication des bétails. De nombreux groupes de recherche à travers le monde ont mis au point des synthèses de cette molécule afin d'étudier sa bioactivité. Ce problème s'intéresse à la synthèse asymétrique de la (--)-swainsonine à partir de la (--)-érythronolactone commerciale via l'intermédiaire | (Organic Letters 2011, 23, 6452) : S 0 _o BnO HN" "O TMS Ce Re -- TBSO OBn OMOM | (--)-swainsonine \ \ CH; abréviations : TMS = n2 ; TBS = --$ : Bn= CY ;, MOM = CH3OCH, Les deux parties de ce problème sont indépendantes et le candidat est libre de les traiter dans l'ordre qu'il souhaite. Pour l'écriture des mécanismes, chaque fois qu'il le juge nécessaire, le candidat pourra utiliser des notations simplifiées des molécules lui permettant de se concentrer uniquement sur les groupes caractéristiques concernés. (--)-érythronolactone Partie I - Synthèse de l'intermédiaire | L.1 - Synthèse de la N-fert-butylsulfinylimine 5 La synthèse de l'intermédiaire | nécessite la préparation de la N-tert-butylsulfinylimine 5 qui peut être obtenue à partir de la (---)-érythronolactone par la séquence réactionnelle suivante : 0 O OBn O 0 dibenzylation O H,S0, (cat.) CF y Ha Aou " eOH, reflux : HO OH BnO opn PRES (--)-érythronolactone ; 4 - 8 Y OBn O OBn O HN O S& silylation ) (OED, ON _ Sn TH A, TBSO OBn TBSO OBn THE 257 + gaz OH THE, < 10 °C prop-2-yn-1-ol réactif 6 (1 équiv) > 6 + gaz THE, < 10 °C TMSCI (2 équiv) 9 H,SO, (1,40 mol-L-1) TMS ----\ THF, < 25 °C puis reflux (CoH20OSi2) THF, HO, < 45 °C. 10 ©# Le protocole de la synthèse du 3-triméthylsilylprop-2-yn-1-ol 10 est donné ci-après. Sous atmosphère inerte, 48,7 g (2,0 mol) de copeaux de magnésium et 1 L de tétrahydrofurane anhydre sont introduits dans un ballon tricol de 3 L équipé d'un agitateur mécanique, d'une ampoule de coulée isobare, d'un réfrigérant (tous passés à l'étuve pendant une nuit) et d'un thermomètre. À la suspension ainsi obtenue, 149,5 mL de bromoéthane (2,0 mol) sont additionnés goutte-à-goutte sur une période de 3 h en maintenant la température inférieure à 50 °C. À la fin de l'addition, la solution, de couleur gris-vert, est chauffée à 50 °C pendant 1 h, puis refroidie à 5 °C avec un bain de glace. La solution obtenue est dosée en retour par le diode (12) permettant de calculer un rendement de 73 %. En maintenant la température inférieure à 10 °C, 41,6 mL (0,72 mol) de prop-2-yn-1-ol dans 42 mL de tétrahydrofurane anhydre sont additionnés goutte-à-goutte en 2 h à la solution précédente. L'ampoule d'addition est rincée avec 25 mL de tétrahydrofurane anhydre, puis le milieu est agité toute la nuit. La solution résultante est refroidie à 5 °C avec un bain de glace et 184 mL (1,45 mol) de chlorotriméthylsilane (TMSCT) sont introduits dans l'ampoule de coulée et additionnés goutte-à- goutte sur 1 h en maintenant la température inférieure à 25 °C. À la fin de l'addition, le milieu est chauffé à reflux pendant 2 h. La suspension est ensuite refroidie à 20 °C et 800 mL d'acide sulfurique aqueux (1,40 mol-L'?) sont additionnés avec précaution en 45 min de façon à maintenir la température en dessous de 45 °C. Après 5 min d'agitation, la solution résultante est refroidie à température ambiante, puis 600 mL de diéthyléther sont ajoutés. Les deux phases sont agitées puis transférées dans une ampoule à décanter de 4 L et séparées. La phase aqueuse est extraite deux fois avec 400 mL de diéthyléther. Les phases organiques sont regroupées, puis lavées deux fois avec 1 L d'eau et une fois avec 800 mL d'une solution aqueuse saturée de chlorure de sodium. Les phases organiques réunies sont séchées sur sulfate de magnésium anhydre et concentrées à l'évaporateur rotatif. Le résidu jaune-brun obtenu est purifié par distillation sous vide pour conduire à 86 g de 3-triméthylsilylprop-2-yn-1-ol 10 sous forme de liquide incolore. 3/17 Spectre de RMN 'H du prop-2-yn-1-ol (CDCI:) À (doublet) -- pit E B (triplet) C (singulet) ppm 4,0 3,0 2,0 Spectre IR du prop-2-yn-1-0l ee 7 _ - * -" ee -T 7 _ > 3 000 2 000 1 500 1 O00 nombre d'onde (u) en cm"! _ 500 Advanced Industrial Science and Technology, septembre 2019). Source : Spectral Database for Organic Compounds (SDBSWeb), https://sdbs.db.aist.go.jp (National Institute of Le spectre de résonance magnétique nucléaire du proton (RMN 'H) à 400 MHz du prop-2-yn-1-ol dans le chloroforme deutéré (CDCH) présente trois signaux A, B et C. Le signal C disparaît lorsqu'une goutte d'eau lourde (D20) est ajoutée. Q5. Pour chacun de ces signaux indiquer le nombre d'atomes d'hydrogène. Attribuer chacun de ces signaux à un ou des atomes d'hydrogène du prop-2-yn-1-ol. Ecrire la réaction responsable de la disparition du signal C par ajout d'eau lourde. Q6. Proposer une attribution pour les trois bandes d'absorption A, B et C indiquées sur le spectre infrarouge (IR) du prop-2-yn-1-o1. 4/17 Dans le protocole de synthèse mis en oeuvre, le réactif 6 est formé in situ avant de réagir avec le prop-2-yn-1l-ol. Q7. Représenter le réactif 6. Q8. Justifier les conditions opératoires soulignées dans le protocole de la synthèse du composé 10 en écrivant notamment les équations des réactions secondaires à éviter. Q9. Représenter les structures des intermédiaires 7 et 8 en les justifiant à l'aide des données thermodynamiques fournies. Identifier le gaz qui accompagne la formation de ces intermédiaires. Q10. Déterminer le sens de la polarisation de la liaison silicium-chlore. Proposer une structure pour l'espèce 9 sachant que le chlorotriméthylsilane (TMSCT) réagit en tant qu'électrophile dans la transformation 8 -- 9. Q11. Expliquer le rôle de l'extraction et des lavages dans le protocole de synthèse du 3-triméthylsilylprop-2-yn-1-ol 10. L.3 - Obtention de l'intermédiaire | La réaction de la N-fert-butylsulfinylimine 5 avec le mélange d'allénylzincs 12a et 12b issu de l'espèce 11 permet finalement d'accéder majoritairement à l'intermédiaire Î : TMS, h 1. sec-BuLi (1 équiv) D -- _-- stalisat -- Et,O, -- 80 °C " TMS ------ \ acétalisation TMS ----\ 20, BrZn 12 OMOM > > a 10 ©H 1 OMOM 5 ZnBr, ELO, - 80 °C + DA | énantiomère 12b S BnO N° 'Oo Y A4 Y = OK SK TBSO OBn BnO HN" 'O TMS BnO HN O TMS 5 hydrolyse LL Z D , + = Et,O, -- 80 °C TBSO OBn OMOM TBSO OBn OMOM | autres stéréoisomères Q12. La déprotonation de l'espèce 11 avec un équivalent de sec-butyllithium a lieu en position propargylique (atome de carbone d'indice de position 1 noté sur la structure de l'espèce 11). Justifier pourquoi les atomes d'hydrogène portés par cet atome de carbone sont les plus acides. Q13. Montrer que l'allénylzinc 12a est chiral. Déterminer les proportions de 12a et 12b sachant que le mélange obtenu n'a pas d'activité optique. Q14. La réaction du mélange des énantiomères 12a et 12b avec la N-fert-butylsulfinylimine 5 conduit majoritairement à la formation de l'espèce |. Combien d'autres stéréoisomères sont formés lors de cette réaction ? Quelle(s) relation(s) d'isomérie les lie(nt). Justifier les réponses. 5/17 Partie IT - Accès à la (---)-swainsonine L'intermédiaire | est tout d'abord transformé en espèce cyclique 17 selon la séquence réactionnelle suivante : S S S BnO HN "O TMS BnO HN" "oO BnO HN" "oO ns LL K,CO3 = Z ? : MeOH, 25 °C NT Pat TBSO OBn OMOM TBSO OBn OMOM TBSO OBn OMOM I 13 S ZT S BnO HN O N" Vo nBuN® F© - MeSO, CI, Et;N NaH BnO. > AS > 16 + gaz THF, HO, 20 °C : CH,Cl,, 0 °C THF, 0 °C HO OBn OMOM Oo 15 Dans la première étape, la position acétylénique de l'intermédiaire | est désilylée par le méthanolate de potassium (MeOK), obtenu par réaction du carbonate de potassium (K2CO3) avec le méthanol (MeOH). Q15. Écrire la réaction acide-base entre le méthanol et le carbonate de potassium. À l'aide des valeurs de pK, des couples acide-base associés, justifier pourquoi cette réaction est a priori très peu avancée. Expérimentalement, 100 mL d'une solution de méthanolate de potassium, de concentration environ égale à 0,7 mol-L !, sont préparés en mettant à réagir 9,50 g de carbonate de potassium avec 100 mL de méthanol pendant 6 h à 25 °C. La réaction s'accompagne de la formation de 6,88 g d'hydrogénocarbonate de potassium solide (KHCO3) inerte dans ces conditions et qui est séparé par filtration. Q16. Montrer qu'après 6 h à 25 °C, la réaction entre le méthanol et le carbonate de potassium est totale. Proposer une explication en s'appuyant sur les différences de solubilité des espèces dans le méthanol. Q17. Proposer des conditions opératoires pour réaliser la transformation 13 -- 14. Q18. Lors de la transformation 14 -- 15, il y a création d'une liaison silicium-fluor très forte. Proposer un mécanisme d'addition-élimination (A-E) faisant intervenir un atome de silicium hypervalent pour rendre compte de la formation du produit désilylé 15. Q19. Donner une représentation spatiale topologique du produit 16 obtenu par réaction de l'espèce 15 avec le chlorure de méthanesulfonyle, nommé aussi chlorure de mésyle (MeSO:CT), en présence de triéthylamine (Et3N). Expliquer l'intérêt de la transformation 15 -- 16. Q20. Indiquer le gaz se dégageant lors de la transformation 16 -- 17. Proposer un mécanisme rendant compte de la formation de l'espèce 17. 6/17 La synthèse se poursuit avec la séquence de réactions suivante : Y S ® à TO NH, CI N O B Li _ 2 po CA _ © CA + -- + S=0O BnO NS MOHOC Bo do = | OMOM 17 18 gaz NZ ZE, EtN (excès) BnOr< 18 ) °C BnÔ à " OMOM 19 Q21. En milieu acide, l'atome d'azote de l'espèce 17 est protoné. Proposer un mécanisme rendant compte de la formation du chlorure d'alkylammonium 18 à partir de l'espèce 17 en milieu acide. Q22. Écrire l'équation de la réaction modélisant la formation de l'espèce 19 par réaction du chlorure d'alkylammonium 18 avec le bromure d'allyle (CH2=CHCH:Br) en présence d'un excès de triéthylamine (Et3N). La (--)-swainsonine est ensuite obtenue en deux étapes selon une séquence réactionnelle représentée c1-dessous et impliquant la formation de l'espèce bicyclique 20 via une métathèse d'alcènes catalysée par le carbène de Grubbs | : N T 7 . BnO:' TO OS -- carbène de Grubbs | BnOr:: déprotection BnO::: B Ô à toluène, 100 °C 1 OMOM BnO OMOM 19 20 ler CI 7 Ph Ph Ru--" = [Ru] --" ai" | ? BnOr'' R | P(Cy)s BnoO OH HO On avec Cy = CC) et Ph = @ 22 (--)-swainsonine carbène de Grubbs | La métathèse est une réaction dans laquelle des fragments entre molécules organiques s'intervertissent. Dans le cadre de la métathèse des alcènes, les fragments échangés correspondent à des groupements alkylidène : R1 R1 bè ) . { carbène + R2 R2 7/17 Les catalyseurs de métathèse des alcènes sont en général des carbènes de métaux de transition comme le nickel, le tungstène et le ruthénium. Avec le carbène de Grubbs |, le mécanisme met en jeu le cycle catalytique suivant : R!1 R1 1 R1 Î Ph Î [Ru] -- [Ru]-- carbène de carbène || Grubbs | R! R' R! [Ru] [Ru] RUT ) 2 ph , ñ métallacycle II métallacycle ] métallacycle Il R!1 R1 Ru]-- [Ru] -- À N carbène | carbène | l | éthylène Ph U styrène R° Q23. En considérant que la double liaison carbone-carbone entourée sur l'espèce 19 est la plus réactive vis-à-vis du carbène de Grubbs |, donner une représentation plane topologique des métallacycles | et Il et du carbène | du cycle catalytique de la métathèse des alcènes conduisant à l'espèce bicyclique 20. Q24. Proposer des conditions opératoires pour la transformation 21 -- 22. Dans ces conditions, les fonctions alcool sont libérées pour conduire à la (--)-swainsonine. Q25. Indiquer le stéréoisomère, obtenu lors de la réaction du mélange des énantiomères 12a et 12b avec la N-tert-butylsulfinylimine 5, permettant de synthétiser la (--)-8-épi-swainsonine, représentée c1-après, à l'aide de la même stratégie de synthèse. SK BnO HN O _TMS N AAA > HO" : TBSO OBn OMOM Fo OH (--)-8-épi-swainsonine 8/17 Données relatives au problème 1 Données RMN 'H Gamme de déplacements chimiques de quelques atomes d'hydrogène caractéristiques* Atomes d'hydrogène O-H C=C-H ---CH-0- Ô (ppm) 1,0 -- 6,0 2,0 -- 2,5 3,5-4,8 Données IR Gamme de fréquences de vibration de quelques liaisons caractéristiques* Liaisons v (cm !) Intensité O-H (alcool) 3 200 -- 3 650 Intense et large C-H (alcyne) 3 250 -- 3 300 Intense C-H (alcane) 2 840 -- 2 960 Moyenne C=C 2 000 -- 2 260 Faible *Source : E. Pretsch, W. Simon, J. Seibl, T. Clerc, W. Fresenius, J. F. K Hubert, E. Pungor, G. A. Rechnitz, W. Simon, Tables of Spectral Data for Structure Determination of Organic Compounds 24 Edition (1989) Numéros atomiques Élément H C N O Z I 6 7 8 Masses molaires atomiques Élément H C O K M (g-mol !) | 1,0 | 12,0 | 16,0 | 39,1 Électronégativités de Pauling Élément CI SI X 3,2 1,9 Solubilités dans le méthanol à 25 °C Espèce KHCO;3 | K2CO:; MeOK Solubilité (mmol /100 mL) = 0 22,5 86,7 Masse volumique du méthanol : 0,792 kg-L ! 9/17 Constantes d'acidité (supposées indépendantes de la température ; les valeurs > 14 sont extrapolées) Couple PKa CO;, H20 (H2CO; (ao) HCO3 (ao) 6,4 _ D-- HCO: /CO3 Go 10,3 EG NH (a0)/Et3 N(ac) 10,6 + R'R2NH; (ag R'R2NH (20) = ]1 HC=CCH,OH/HC=CCH,07 13,6 MeOH/MeO 15,5 RC=CH/RC=C" = 23 1 ] R2 R? H,/H° 35 R'R°NH/R'R°N7 = 36 CH;CH;/CH;CH; 50 10/17 PROBLÈME 2 Le chlorure d'or (III) Le chlorure d'or (IT), également appelé chlorure aurique, est l'une des espèces chimiques les plus communes contenant de l'or. Il se présente sous la forme d'un solide rouge AuCI;,,, ou sous la forme d'un complexe AuCL 44 en présence d'acide chlorhydrique. Cette espèce chimique est utilisée pour améliorer la conservation des photos argentiques depuis le XIX siècle, ou encore comme catalyseur dans certaines réactions organiques où 1l constitue une alternative non toxique aux sels de mercure. Ce problème propose d'étudier la structure du chlorure d'or (III), ses différents modes de synthèse, ainsi que ses différentes applications. Partie I - Structure du chlorure d'or (III) L'or est un élément chimique de symbole Au ayant pour configuration électronique [Xe] 4f* 5d!° 6s!. Il s'agit d'un métal très dense présentant un éclat Jaune caractéristique, particulièrement ductile et facile à travailler. Sa structure cristallographique à l'état solide est une structure cubique faces centrées. Le rayon métallique de l'or est de 144 pm. On le trouve généralement aux nombres d'oxydation + I et + II sous forme complexée par des ligands tels que les ions chlorures CI ou les ions cyanures CN . Q26. Déterminer le numéro atomique de l'or ainsi que sa position dans la classification périodique (période et colonne). Justifier les réponses. Q27. Indiquer si la configuration électronique de l'or respecte les règles de remplissage électronique et préciser quel nombre d'oxydation de l'or est particulièrement stable. Justifier les réponses. Q28. Justifier, à l'aide d'un raisonnement quantitatif, que l'or est un métal " très dense ". La figure 1 représente les diagrammes d'Orbitales Moléculaires (O.M.) de complexes ML;, dans lesquels les niveaux d'énergies des O.M. obtenues par interaction des orbitales atomiques d d'un élément central métallique M avec n ligands L (n -- 4 ou 6) sont représentés en fonction de la géométrie des complexes. E 1 1 _ ro de De dn J- b y -- bn 6 ' OR L L | AL LL Ve ML LM --L M T7 TT / N TT 7 NN L ML, octaédrique ML, plan carré ML, tétraédrique Figure 1 11/17 Q29. Identifier et nommer les orbitales du métal figurant dans le diagramme d'orbitales moléculaires bi (1 = 1 à 5) du complexe ML octaédrique de la figure 1. Expliquer la levée de dégénérescence des 5 orbitales atomiques d. Q30. Sachant que la géométrie ML4 plan carré peut être obtenue à partir de la géométrie ML octaédrique en éloignant à l'infini les deux ligands L situés le long de l'axe z du métal M, interpréter les variations des énergies des O.M. @i (1 = 6 à 10) par rapport à celles des O.M. @i (1 = 1 à 5) sur la figure 1. Représenter les O.M. o et D10. Q31. Expérimentalement, on constate que le complexe d'or (III) AuCI, est diamagnétique (c'est-à-dire qu'il ne possède pas d'électron célibaire dans sa configuration électronique). En déduire la géométrie adoptée par ce complexe à l'aide de la figure 1. Justifier. Partie II - Synthèse du chlorure d'or (ID) IT.1 - Synthèse au laboratoire L'un des principaux moyens d'obtention du chlorure d'or (IT) au laboratoire est l'utilisation du complexe AuCL (aa): L'or métallique n'est oxydé ni par de l'acide chlorhydrique (H30° (ag) + CT (ag)); ni par une solution aqueuse d'acide nitrique (H30° (ag) + NO; (aq). En revanche, un mélange de ces deux acides, appelé eau régale, permet d'oxyder partiellement l'or en complexe AuCL (0): L'eau régale fut mentionnée pour la première fois dans une oeuvre de Pseudo-Geber datée d'environ 1300. Historiquement, elle a été utilisée lors de la Seconde Guerre Mondiale par le chimiste hongrois George de Hevesy qui, voulant éviter le vol par les Nazis du prix Nobel en or de Max von Laue et James Franck, a dissous les deux médailles dans l'eau régale. La solution ainsi obtenue a permis plus tard de récupérer l'or pour refabriquer les deux médailles. Q32. Justifier quantitativement que l'or métallique ne peut pas être oxydé par une solution d'acide nitrique d'un point de vue thermodynamique. Pour cela, on écrira notamment l'équation de la réaction la plus favorable thermodynamiquement et on calculera sa constante d'équilibre à 298 K. Q33. Déterminer, à partir des données, le potentiel standard du couple AuCL 4/ Au, à 298 K. Détailler la démarche. En déduire que l'or métallique ne peut pas être oxydé par de l'acide chlorhydrique, en adoptant la même démarche que précédemment. Q34. Déduire qualitativement pourquoi l'eau régale peut oxyder l'or d'un point de vue thermodynamique et écrire l'équation de réaction correspondante. Q35. À l'aide du tracé de courbes de courant-potentiel appropriées, justifier si l'oxydation de l'or par l'eau régale présente ou non un blocage cinétique. 12/17 La figure 2 représente le graphique donnant l'évolution des pourcentages des différents complexes AuCI, (HO), (aq) (où les indices x et y sont des entiers positifs ou nuls tels que x + y -- 4) en fonction du pH, les lettres de A à E étant relatives à chacun des complexes : 100 -- = 00 | \ / 80 - Loc | 70 - | 60 - u | [(] 30 - >) | | | | -- . 20 - ] } } A \ 10 - / Pourcentage des complexes d'or (IT) 0 + 0 12345678 9101112113 14 pH Figure 2 Q36. Donner, en justifiant succinctement, la formule de chacune des espèces chimiques A à E apparaissant sur le graphique de la figure 2. Quel intervalle de pH à l'équilibre est compatible avec la prédominance du complexe AuCI, en solution ? IL.2 - Synthèse industrielle À l'échelle industrielle, la synthèse du complexe AuCIL, est réalisée dans un réacteur, préalablement vidé d'air, dans lequel un courant de dichlore gazeux en excès à la pression P = 10 bar est envoyé sur des copeaux d'or, l'enceinte étant maintenue à une température constante de 250 °C. La réaction, très rapide, permet la synthèse de l'espèce AuCÏ; gazeuse qu1 est entraînée par le courant de dichlore gazeux dans un tube incliné menant à un réservoir réfrigéré à température ambiante où se dépose le solide AuCl;, l'excès de dichlore gazeux étant recyclé vers le réacteur. À partir de 100 g d'or métallique, on obtient 121 g de chlorure d'or AuCH; solide (1dentifié par diffraction des rayons X). AuC est ensuite transformé quantitativement en AuCI 4 par dissolution en milieu aqueux chlorhydrique concentré. Q37. À partir entre autres des données, discuter du choix de la température de 250 °C maintenue dans l'enceinte du réacteur lors de la synthèse du chlorure d'or (II). Q38. Justifier les conditions de pression élevée utilisées dans l'enceinte du réacteur permettant la synthèse quantitative du chlorure d'or (III). Q39. Calculer et commenter le rendement obtenu lors de la synthèse. 13/17 Partie III - Applications du chlorure d'or (III) Le chlorure d'or (III) sous sa forme AuCTÏ, peut servir de catalyseur lors de synthèses organiques, telle que la synthèse de cétones aromatiques à partir d'alcynes proposée par Y. Yamamoto en 2002 et dont le cycle catalytique est représenté c1-dessous : R° (X © R° S SR AuCI, R étape (1) étape (5) étape (4) Z R © AUCI, R° étape (3) R° -- R' R' Q40. Écrire l'équation de la réaction décrite par ce cycle catalytique. © AUCI, Q41. Proposer un mécanisme à l'aide du formalisme des flèches courbes pour l'étape (2). Q42. Préciser le nom de la réaction à laquelle s'apparente l'étape (4). Q43. Proposer un mécanisme concerté à l'aide du formalisme des flèches courbes pour l'étape {5) et préciser, en justifiant, si cette étape (5) pourrait ou non être qualifiée d'élimination réductrice. La récupération de l'or métallique à partir d'une solution aqueuse contenant de l'or sous forme de chlorure d'or (III) AuCL 4) peut s'effectuer de plusieurs manières. L'une d'elles consiste à utiliser un réducteur tel que l'acide méthanoïque HCOOH. L'équation de la réaction modélisant cette transformation est la suivante : 2 AUCL (aq) + 3 HCOOH/:9 -- 2 AU(s) + 3 CO; (g) + 6 HT (29) + 8 CT (ac) Une étude cinétique de cette transformation a été réalisée par K. Pactawsk1 and T. Sak en 2014. Dans cette étude, les auteurs font l'hypothèse que la vitesse de la réaction s'écrit sous la forme : v = k[AuCIL, FPP[HCOOH/] p et q étant les ordres partiels par rapport aux réactifs et k la constante de vitesse de la réaction. 14/17 Les auteurs réalisent à différents instants r; un spectre d'absorption d'une solution aqueuse contenant initialement un mélange de AuCL, 4) de concentration Co -- 1,5:10 * mol-L ! et de HCOOH«w de concentration Co = 1,510? mol-L ! à un pH fixé à 2,7 et une température de 50 °C. Seules ces deux espèces sont responsables des absorbances mesurées dans l'intervalle des longueurs d'onde étudiées. Les spectres obtenus à différents instants 7; sont représentés sur la figure 3 ci-après (les différentes courbes, notamment (a) et (b), y représentent le spectre à des instants différents). Le temps est exprimé en minutes dans toutes les expériences réalisées. 2.9 - 2:90 9 Absorbance 1.0: 0.5 - courbe (b) | 0.0 - _# courbe (a) | L | | | 200 300 400 500 Longueur d'onde À (nm) Figure 3 700 Les auteurs réalisent ensuite, à une longueur d'onde Ào judicieusement choisie, un suivi de l'absorbance au cours du temps pour différentes séries d'expériences dont les conditions initiales sont présentées dans le tableau 1, le pH étant maintenu égal à 2,7 dans toutes les expériences réalisées ("M signifie "mol-L !") : Série À d'expériences 0 -- 50 °C [HCOOHo = 5,0-107° M Série B d'expériences 0 = 50 °C [AuCL, lo = 5,0-10° M Série C d'expériences [HCOOHo = 1,5:10° M [AuCL, lo = 1,510 M [AuCI loi = 5,0-10 ° M [HCOOH]o = 5,010 ° M 01 = 35 °C [AuCL lo = 1,0-10* M [HCOOH]o = 1,0-10 7 M 62 -- 40 °C [AuCL lo3 = 1,510 M [HCOOH]o3 = 1,510 7 M 03 = 45 °C [AuCL, Jo4 = 2,0-10* M [HCOOH]os = 2,0-10 7 M 04 = 50 °C Tableau 1 15/17 Grâce aux mesures d'absorbance enregistrées au cours du temps, K. Pactawsk1 and T. Sak parviennent à tracer différentes courbes correspondant à chaque série d'expériences. Les résultats des régressions linéaires (équations et coefficient de corrélation R?) figurent au bas de chaque courbe de la figure 4 : vo représente la vitesse initiale et kw une constante introduite par les auteurs. log[AuC1, 1, In[HCOOH/], 1/T (K1) -4,4 -4,2 -4 -3,8 -3,6 -7 -6 -5 -4 0,003 0,0031 0,0032 0,0033 l 1 1 1 -4,2 l L 1 -0,2 1 1 J À -4,3 + -0,3 2 - | 44 + -0,4 -22 - + -0,5 + -4,5 © 5 |Tà a 1 06 = 8 + 46 F | Æ -2,4 | S l'or F5 | & ...-- Lu + -4,7 + -0,8 -2,6 - + -4,8 + -0,9 l 4,9 J' 4 log(vo) = 0,99.1og[AuC1,], -- 0,62 In(k,,) = 0,51.n[HCOOHI], + 2,24 In(kyps) = -4,44.103/T + 11,8 R? = 0,997 R? = 0,999 R? = 0,996 Série À d'expériences Série B d'expériences Série C d'expériences Figure 4 Q44. Préciser, à l'aide d'un diagramme approprié, l'espèce chimique prédominante du couple acide-base dont l'espèce acide est l'acide méthanoïque dans les conditions opératoires utilisées pour la récupération de l'or. Q45. Estimer la valeur de la longueur d'onde À choisie par K. Pactawski and T. Sak pour réaliser le suivi expérimental de l'absorbance au cours du temps. Attribuer, en justifiant, les deux courbes (a) et (b) de la figure 3 aux instants # -- 0 et £ = 120 min. Q46. Expliquer comment les auteurs peuvent déterminer la vitesse initiale vo de la réaction à partir du suivi de l'absorbance au cours du temps. Q47. Dans les deux séries B et C d'expériences réalisées, une constante notée ki, est introduite par K. Pactawski and T. Sak. Justifier son introduction et donner son expression. Q48. À partir du graphique de la série À d'expériences de la figure 4, déterminer l'ordre partiel par rapport à l'un des deux réactifs. Détailler la démarche. Q49. À partir du graphique de la série B d'expériences de la figure 4, déterminer l'ordre partiel par rapport à l'autre réactif. En déduire, en justifiant la réponse, si la réaction de réduction du chlorure d'or (III) par l'acide méthanoïque pourrait ou non s'apparenter à un acte élémentaire. Q50. Préciser quelles grandeurs caractéristiques de la réaction peuvent être déterminées grâce au graphique correspondant à la série C d'expériences de la figure 4. Déterminer les valeurs de ces grandeurs. 16/17 Données relatives au problème 2 Numéros atomiques Élément H C N O | CI | Xe Z I 6 7 8 17 | 54 Masses molaires atomiques Élément | H | C | O | Si | CI | K | Au M (g-mol !) | 1,0 | 12,0 | 16,0 | 28,1 | 35,5 | 39,1 | 197,0 Enthalpies standard de formation (supposées indépendantes de la température) Espèce CL AU(s) AuC B(9) AfH° (kJ-mol !) 0 0 --115 Constantes d'acidité (supposées indépendantes de la température) Couple PKa HAUC lag) AUC 4 (ao) < 0 HCOOHça/HCOO (ay 3.8 Constante de formation globale de AuCL (19 à 298 K : B4= 10* Potentiels standard (supposés indépendants de la température) Couple | H30"*a9/H2( | NO3 ag/NO(@ | Ch / Clay AU" ag/Au( E° (V) 0 0,96 1,36 1,50 Surtensions cathodiques en réduction (surtensions anodiques supposées nulles) Couple H30"a9/H2(e) sur Au NO3 (ag/NO() Sur Au n (V) -- 0,31 -- 0,02 Constante de Faraday : F = 9,65:10* C-mol ! Constante d'Avogadro : N1 = 6,02-107* mol ! Constante des gaz parfaits : R = 8,31 J-K_!-mol ! À 298 K : RTIn(10}F = 0, 06 V FIN 17/17
