CCINP Chimie PC 2019
| Thème de l'épreuve | La serricornine. Le rhodium. |
| Principaux outils utilisés | chimie organique, chimie de coordination, solutions aqueuses, cristallographie, mélanges binaires, thermodynamique, cinétique chimique |
| Mots clefs | serricornine, Horner-Wadworth-Emmons, dithioacétal, rhodium, extraction, catalyseur, hydroformylation, alliage, acide nitrique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - -
Énoncé complet
(télécharger le PDF)









Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
SESSION 2019 PCCH007
GP
CONCOURS
COMMUN
INP
ÉPREUVE SPÉCIFIQUE - FILIÈRE PC
CHIMIE
Jeudi 2 mai :14h-18h
N.B. : le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de
la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être
une erreur dénoncé, il le
signalera sur Sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu'il a été amené à prendre.
Les calculatrices sont autorisées
Le sujet est composé de deux problèmes indépendants.
Problème 1 : pages 2 à 7
Problème 2 : pages 8 à 14
Données relatives à l'ensemble du sujet : page 15
(Chaque problème est constitué de parties indépendantes).
1/15
PROBLÈME 1
La serricornine
Ce problème a pour sujet l'étude de la serricornine, phéromone sexuelle de la
femelle du scarabée du
tabac (Lasioderma serricorne). 65 000 femelles du scarabée du tabac permettent
d'obtenir 1,5 mg de
serricornine. Du fait de sa faible disponibilité à l'état naturel, de nombreux
groupes de recherche à
travers le monde ont donc mis au point des synthèses asymétriques de cette
molécule afin d'étudier sa
bioactivité avec, entre autres, pour objectif de concevoir des pièges à
phéromones pouvant représenter
une bonne alternative à l'utilisation de pesticides dans les plantations de
tabac.
Les trois parties de ce problème sont de difficulté croissante. Elles sont
indépendantes et le candidat est
libre de les traiter dans l'ordre qu'il souhaite. Pour l'écriture des
mécanismes, chaque fois qu'il le juge
nécessaire, le candidat pourra utiliser des notations simplifiées des molécules
lui permettant de se
concentrer uniquement sur les groupes caractéristiques concernés.
Partie I - Autour de la serricornine
La serricornine existe sous deux formes en équilibre en présence de traces
d'acide. Elle est donc souvent
acétylée afin d'en faciliter l'analyse (schéma 1) :
OH
7. 0
O
O
H® (cat. OH O À, Xo O
OT EUN. CHCL ST
SEITICOMINE SEITICOMINE serricornine acétylée
(forme cyclique) (forme linéaire)
Schéma 1
Q1. Donner le nom de la forme linéaire de la serricornine en nomenclature
systématique.
Q2. Reproduire les deux formes de la serricornine (cyclique et linéaire) et
entourer les groupes
fonctionnels caractéristiques. À quelles fonctions correspondent-ils "?
Q3. Attribuer le descripteur stéréochimique du carbone asymétrique de la forme
linéaire de la
serricornine marqué par un astérisque. Justifier la réponse.
Q4. Proposer un schéma mécanistique rendant compte de la formation de la forme
cyclique de la
serricornine à partir de la forme linéaire en présence de traces d'acide. On ne
s'intéressera pas à la
stéréosélectivité de la réaction.
Q5. Proposer un schéma mécanistique rendant compte de la formation de la
serricornine acétylée à
partir de la serricornine linéaire en précisant le rôle de la triéthylamine.
Q6. Le spectre de spectroscopie de résonance magnétique nucléaire du proton
(RMN 1H) à 400 MHz
dans le chloroforme deutéré (CDCH) de la serricornine acétylée présente, entre
autres, un signal
[ô = 4,64 ppm (dt, *J = 7,9 Hz et 4,9 Hz, 1 H) ; ppm = partie par million, dt =
doublet de triplet].
Attribuer le signal observé sur le spectre de RMN IH à un ou des atomes
d'hydrogène caractéristiques
de la serricornine acétylée. Justifier la multiplicité (voir données, page 15).
2/15
Q7. Le spectre de spectroscopie infrarouge (IR) de la serricornine acétylée
présente, entre autres,
deux bandes d'absorption intenses à 1 735 et 1 715 cm !.
Proposer une attribution pour ces bandes d'absorption (voir données, page 15).
Partie II - Synthèse de R. A. Pilli et M. M. Murta (1988)
La synthèse asymétrique de la serricornine racémique décrite par R. A. Pilli et
M. M. Murta, au Brésil,
(Synthetic Communications 1988, 18 (9), 981-993) utilise comme substrat de
départ le composé 1,
la 2-méthyl-2-triméthylsilyloxypentan-3-one (schéma 2) :
O | OH O
OSiMe, LDA 1 1. EtCHO, THF, -- 78 °C_ 3 OSiMe:
THF, -- 78 °C 2. NH4CI/H)O
1 3
O O
1. acétvlation 0 O NaBH _réactifé. s Q
. | 7
2. traitement acide : EtOH
4 7
O
on A9 ,
réactif 8 = Hs MeONa (1 équiv.)
ee K ------ 10 > [11]
: PtO, (cat.) MeOH
: CO:Et
9
O
on) OH O
1. MeOH, reflux O 1. EtMgBr CL >
2. H10® SEEN 2. 2. hydrolyse :
- serricornine serricornine
12 (forme cyclique) (forme linéaire)
Schéma 2
Q8. Représenter l'intermédiaire [2] obtenu par réaction du composé 1 avec le
diisopropylamidure de
Hithium (LDA = [(CH3)CH}{2NLi) dans le tétrahydrofurane (THF).
Q9. Proposer un schéma mécanistique rendant compte de la formation de la
£-hydroxycétone 3 à
partir de l'intermédiaire [2]. On ne s'intéressera pas à la stéréosélectivité
de la réaction.
Q10. Représenter tous les stéréoisomères du composé 5 qui peuvent être obtenus.
Préciser la (les)
relation(s) d'isomérie qui les lie(nt).
Proposer un schéma mécanistique rendant compte de la formation du composé 5. On
ne s'intéressera
pas à la stéréosélectivité de la réaction.
Q11. Proposer un réactif 6 pour obtenir l'aldéhyde 7 à partir du composé 5.
Donner la structure du sous-produit, de formule brute C3H60O, qui accompagne la
formation de
l'aldéhyde 7.
3/15
Q12. À l'aide du document 1 (page 5), proposer un réactif 8 pour préparer
l'ester «, B-insaturé 9 avec
une excellente sélectivité (£) et permettant une purification facile.
Proposer une séquence réactionnelle en deux étapes pour la synthèse du réactif
8.
Proposer un schéma mécanistique pour chaque étape de cette séquence.
Q13. Représenter le composé 10. On ne s'intéressera pas à la stéréosélectivité
de la réaction.
Q14. Proposer une méthode pour préparer une solution de méthanolate de sodium
(MeONa) dans le
méthanol (MeOH)).
Q15. Représenter l'intermédiaire [11] obtenu par réaction du composé 10 avec un
équivalent de
méthanolate de sodium (MeONa) dans le méthanol (MeOH)) et dont la formation
s'accompagne de la
libération d'acétate de méthyle (MeCO2Me).
Q16. Au reflux du méthanol (MeOH), l'intermédiaire [11] n'est pas stable et
conduit spontanément à
la lactone 12 après hydrolyse acide. En reprenant les représentations de la
figure 1 ci-dessous, dessiner
les deux conformations « chaise » de la lactone 12. Indiquer la conformation «
chaise » la plus stable.
Justifier la réponse.
Figure 1
Q17. Proposer une méthode de préparation du bromure d'éthylmagnésium (EtMgBr)
en précisant,
sans les justifier, trois précautions opératoires à respecter.
4/15
Document 1 - La réaction de Horner-Wadsworth-Emmons
La réaction de Wittig est l'une des réactions les plus connues pour la
formation de doubles liaisons
carbone-carbone. La réaction de Wittig implique généralement la réaction d'un
ylure de phosphonium
avec un aldéhyde ou une cétone pour donner l'alcène et l'oxyde de phosphine
correspondants :
R1 _ R1
R£ ylure de R2 À oxyde de
phosphonium phosphine
Bien que très employée en synthèse au laboratoire, la réaction de Wittig
présente quelques
inconvénients :
-- emploi d'une base forte pour générer l'ylure de phosphonium ;
-- difficulté à séparer l'oxyde de phosphine du milieu réactionnel ;
-- contrôle de la configuration de la double liaison très sensible aux
conditions opératoires et à la
nature du groupement R*° sur l'ylure de phosphonium.
La réaction de Horner-Wadsworth-Emmons est une modification de la réaction de
Wittig qui
implique la réaction d'un carbanion de phosphonate stabilisé par un groupement
mésomère attracteur
(EWG = COR, CN, SO:R, etc.) avec des composés carbonylés :
R, EWG 9 R, 0 7
HO + FOR ----* = + M920-PORS,
R£ © R£ EWG phosphate
carbanion de (E)
phosphonate
IM® = Li®, Na®, Kk®)
Les carbanions de phosphonate utilisés sont générés par déprotonation des
phosphonates eux-mêmes
obtenus à partir des phosphites correspondants à l'aide de la réaction de
Michaelis-Arbuzov :
Réaction de
Michaelis-Arbuzov EWG O BOM® EwWG 9
EWG P(OHR4 > ! !
LX + OE>P(OHR)s Dax POR BH" Le d--P(OR*}
phosphonaîte carbanion de
phosphonate
IM® = Li® Na®, K®)
La réaction de Michaelis-Arbuzov peut être conduite sans solvant. En utilisant
le triéthylphosphite
P(OET); et un dérivé bromé (X = Br), le sous-produit généré est volatil. Dans
ces conditions, le
phosphonate peut alors être utilisé dans la réaction de
Horner-Wadsworth---Emmons sans purification.
La réaction de Horner-Wadsworth---Emmons présente plusieurs avantages sur la
réaction de Wittig :
-- les carbanions de phosphonates peuvent être générés avec des bases variées
(par exemple E&N,
MeONa, EtONa, fBuOK,, NaH, [(CH3)3S1]2NK) et sont nettement plus réactifs
(nucléophiles) que
les ylures de phosphonium ;
-- les phosphates libérés sont solubles dans l'eau et donc facilement
séparables de l'oléfine
préparée ;
-- Ja réaction est hautement sélective pour donner l'oléfine de configuration
(Æ).
5/15
Partie III - Synthèse de M. Mori, T. Chuman, K. Katô et K. Mori (1982)
La synthèse énantiosélective de la serricornine décrite par M. Mori, T. Chuman,
K. Katô et K. Mori
(Tetrahedron Letters 1982, 23 (44), 4593-4596), au Japon, utilise la cellulose
comme matière première
(schéma 3) :
1. pyrolyse acide
2. méthylation OH O
3. oléfination __ HO
| 4. hydrogénation H
5. traitement acide =
13
cellulose
H ,
réactif 14 0 ÿ TSCI (1 équiv.) réactif 17 17
7777 HO > 16
S pyridine, 0 °C
15
réaction de
1. réactif 19 D] Misunobu Mitsunobu on =
> hydrolyse re TS
21
, OH O
C OEt 22 EiO © ÿ 1. nBuLi, THF, -- 60 °C 2 étapes =
© D ; - > 24 >
HY (cat.) - S 2. iodoéthane :
= THE, -- 60 °C 7
23 serricornine
(forme linéaire)
e ï
pyridine = N. / TsCI = -- Y-$-0 THF = tétrahydrofurane
[|
O
Schéma 3
Q18. Indiquer la géométrie qui peut être déduite de la méthode VSEPR autour de
chacun des atomes
de soufre (Z = 16) du 1,3-dithiane 15.
Commenter la valeur mesurée expérimentalement de 99° pour l'angle valenciel
C---S-C dans
le 1,3-dithiane.
Q19. À l'aide du document 2, page 7, proposer un réactif 14 et des conditions
opératoires pour obtenir
le 1,3-dithiane 15.
Proposer un schéma mécanistique rendant compte de la formation du 1,3-dithiane
15.
Q20. Représenter le produit 16 obtenu par réaction du composé 15 avec le
chlorure de tosyle (TsCl)
en présence de pyridine.
Justifier l'emploi d'un seul équivalent de chlorure de tosyle et expliquer la
sélectivité de la réaction.
Expliquer l'intérêt de cette transformation.
6/15
Document 2 - Les dithioacétals
Les dithioacétals sont des analogues soufrés des acétals. Ce sont des groupes
protecteurs des
aldéhydes et des cétones. Inertes dans de nombreuses conditions, les
dithioacétals sont obtenus par
réaction d'un aldéhyde où d'une cétone avec un thi1ol, en présence d'une
quantité catalytique d'acide,
en éliminant l'eau du milieu afin de déplacer l'équilibre de la réaction. Le
mécanisme de formation
des dithioacétals est analogue à celui de la formation des acétals :
@
O H (cat) R3S SR3
3 > + H,0
Re + 2 RSH > Re 2
thiol
dithioacétal
Le groupe protecteur peut être éliminé avec des réactifs mercuriques en raison
de la haute affinité des
ions mercure(Il) pour les dérivés soufrés.
En synthèse au laboratoire, les aldéhydes et les cétones sont très couramment
protégés sous forme de
dithioacétals cycliques présentant le motif 1,3-dithiane, par réaction avec le
1,3-propanedithiol :
1,3-propanedlithiol 1=---"----
O H® (cat.) où
X 7
2
OS LS
1 2 -- H,0
RIT R SE
motif 1,3-dithiane
Lorsqu'ils sont issus d'aldéhydes, les dithioacétals cycliques présentant le
motif 1,3-dithiane peuvent
être utilisés dans des réactions de type «umpolung » comme, par exemple, la
réaction de
Corey-Seebach :
UN mu (OU E® ff) Ho À
S ST SS 7 SS Ho" kr E
RH R Li R E
Q21. Proposer un réactif 17 pour la formation de l'époxyde 18.
Proposer un schéma mécanistique rendant compte de la formation de l'époxyde 18.
Q22. Proposer un organométallique 19 pour la formation de l'alcool 20.
Expliquer la régiosélectivité de l'ouverture de l'époxyde 18.
Q23. Représenter les deux carbocations qui peuvent être obtenus lorsque
l'éthylvinyléther 22 est mis
en présence d'un acide.
Indiquer le carbocation le plus stable. Justifier la réponse.
Sachant que la réaction est sous contrôle cinétique et que l'étape
cinétiquement déterminante est la
formation du carbocation et présente un état de transition tardif, indiquer si,
a priori, la formation
majoritaire du composé 23 pouvait être prévue. Justifier la réponse.
Expliquer l'utilité de la formation du composé 23 dans cette synthèse.
Q24. En vous aidant du document 2, représenter le composé 24.
Q25. Indiquer les deux étapes nécessaires afin d'accéder à la serricornine à
partir du composé 24. Les
réactifs et conditions ne sont pas demandés.
7/15
PROBLÈME 2
Le rhodium
Le rhodium est un métal dur et cassant, qui n'est présent dans la croûte
terrestre qu'à raison d'environ
1 mg par tonne de terre : 1l s'agit donc d'un métal rare et coûteux dont la
production mondiale avoisine
actuellement environ vingt-cinq tonnes par an. Il est principalement utilisé en
tant que catalyseur sous
forme pure ou allié au platine. L'alliage platine-rhodium sert également à la
fabrication de
thermocouples pour les mesures de températures élevées.
Dans ce problème, nous nous intéressons à l'extraction du rhodium, à son
utilisation en tant que
catalyseur, ainsi qu'aux propriétés des alliages platine-rhodium.
Partie I - Extraction du rhodium
Le rhodium est un élément chimique de symbole Rh appartenant à la 5° ligne de
la classification
périodique et possédant 9 électrons de valence. Il fut découvert en 1803 par
William Hyde Wollaston à
partir de minerais provenant d'un gisement de platine colombien. Il tire son
nom du mot grec «p66ov »
(rhodon) qui signifie «rose » en raison de la couleur rose-rouge de quelques
composés stables du
rhodium, en particulier de l'hydroxyde de rhodium.
Avec le ruthénium, le palladium, l'osmium, l'iridium et le platine, le rhodium
forme l'ensemble des
« platinoïdes ». On trouve généralement le rhodium au nombre d'oxydation +IIT
avec une configuration
électronique particulièrement stable se terminant en 5s! 4.
Q26. Déterminer le numéro atomique du rhodium ainsi que sa configuration
électronique. Justifier la
réponse.
Q27. Préciser si la configuration électronique de Rh(IIT) est compatible avec
les règles de remplissage
électronique. Justifier la réponse. Indiquer d'où provient sa stabilité
particulière.
Q28. Parmi l'ensemble des platinoïdes, indiquer lequel possède des propriétés
chimiques similaires à
celles du rhodium. Justifier la réponse.
8/15
Q29. En milieu aqueux chlorhydrique (par exemple et en présence de trichlorure
d'aluminium AICB),
le platine (IV) forme majoritairement le complexe stable PtCls"(aqueux).
Préciser la géométrie du
complexe PtCls"_. On indiquera le nom de cette structure géométrique, on
donnera sa représentation de
Cram et on précisera la valeur des angles valenciels
Q30. Le complexe du rhodium (ID) contenant 2 ligands chloro CT (p--2) et 4
ligands aqua H20 (q--4)
(document 3) présente une géométrie similaire à PtCls" : donner le nombre total
de stéréoisomères de
ce complexe, les représenter et préciser la relation de stéréoisomérie qui les
lie.
Q31. Donner, en justifiant succinctement, la formule de chacune des espèces A à
G apparaissant sur
le graphique du document 3.
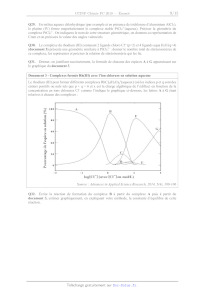
Document 3 - Complexes formés Rh(IIT) avec l'ion chlorure en solution aqueuse
Le rhodium (III) peut former différents complexes RhCI,(H20)4"(aqueux) (où les
indices p et q sont des
entiers positifs ou nuls tels que p + q -- 6 et x est la charge algébrique de
l'édifice) en fonction de la
concentration en 1ons chlorures CT comme l'indique le graphique ci-dessous, les
lettres À à G étant
relatives à chacun des complexes :
100 --------
JO
60
407
Pourcentage de l'espèce en solution (%)
9 _1 û 1 2
log [CI] (avec [CI Ten mol/L)
Source : Advances in Applied Science Research, 2014, 5(4), 100-106
Q32. Écrire la réaction de formation du complexe B à partir du complexe À puis
à partir du
document 3, estimer graphiquement, en expliquant votre méthode, la constante
d'équilibre de cette
réaction.
9/15
Q33. En utilisant les documents 3 et 4, préciser la formule du complexe du
rhodium (III)
prédominante en solution lorsqu'on en extrait environ 90 %.
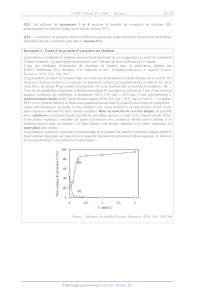
Q34. Commenter en quelques mots les différentes parties du mode opératoire
d'extraction du rhodium
identifiées par des caractères gras dans le document 4.
Document 4 - Étude d'un procédé d'extraction du rhodium
La production mondiale de rhodium provient principalement de sa récupération au
cours de traitement
d'autres minerais. Les principaux producteurs sont l' Afrique du Sud, la Russie
et le Canada.
L'une des méthodes d'extraction du rhodium est étudiée dans la publication
rédigée par
M.H.H. Mahmoud, M.A. Barakat, Y.S. Mahrous et M.F. El-Shahat (Advances in
Applied Science
Research, 2014, 5(4), 100-106) :
1 kg de platine résiduel est récupéré dans des réacteurs de production d'acide
nitrique de la société The
Egyptian Chemical Industries Company. La poussière contient principalement des
oxydes de fer, de la
silice S10), du platine Pt au nombre d'oxydation +[IV et du rhodium Rh au
nombre d'oxydation +IIT.
5 mg de cet échantillon sont portés à ébullition pendant 45 min dans un volume
de 5 mL d'une solution
aqueuse contenant du trichlorure d'aluminium AICI (AÏ*(aq) + 3CI(aq)) à une
concentration C
judicieusement choisie et de l'acide nitrique aqueux HNO: (H*(aq) + NO; (aq)) à
2 mol:L' |. Le platine
Pt(IV) et le rhodium Rh(IIT) se dissolvent quantitativement dans la solution
sous forme de complexes.
Après refroidissement, on ajoute à cette solution 5 mL d'eau distillée et on
obtient alors 10 mL d'une
phase aqueuse contenant les deux métaux à séparer. Dans un matériel de verrerie
adapté, on procède
alors à plusieurs extractions liquide-liquide de cette phase aqueuse à l'aide
d'un volume total de 50 mL
d'une phase organique contenant un agent d'extraction des complexes formés par
le platine et le
rhodium dissous dans du toluène. Les deux phases sont ensuite séparées et la
phase organique est
neutralisée puis séchée.
Le graphique c1-dessous représente le pourcentage de la quantité de matière
extraite de chaque métal M
dans la phase organique par rapport à leur quantité initialement présente en
phase aqueuse, en fonction
de la concentration C en trichlorure d'aluminium.
100
=
A 80
3 Rh
8
& 60
È
%
L=
> 40
[=] à
&
Æ
® 20
5 Pt
È
0 D
0 0.5 1 1.5 2
C (mol/L)
Source : Advances in Applied Science Research, 2014, 5(4), 100-106
10/15
Partie II - Utilisation de complexes de rhodium en tant que catalyseur
Le rhodium est utilisé en tant que catalyseur sous forme de complexe
RhH(CO)(PPh3})2 (où Ph représente
le groupe phényle CéH5) dans la réaction d'hydroformylation qui permet de
synthétiser un aldéhyde à
partir du monoxyde de carbone. Ce procédé, découvert en 1938 par Otto Roelen,
est principalement
utilisé pour produire des aldéhydes comprenant de 3 à 19 atomes de carbone. Le
butanal est le principal
produit synthétisé par cette voie de synthèse (75 % de la production totale par
réaction
d'hydroformylation).
La réaction d'hydroformylation occupe une place privilégiée dans le domaine de
la chimie verte. En
effet, elle répond directement à l'un des principes essentiels d'une chimie
plus respectueuse de
l'environnement : l'économie atomique.
Le cycle catalytique est représenté c1-dessous :
M
. PPT
Ph,P--Rh--H
"
1" se NN
R
| \
| sPPR; Php... N
S | H--rh R CRh-H
ss oc |
PPh,O PPh;
V
|PPh, PF
R | Ph.P--Rh R PRPERR A P
de 2 oc
O
U
CO
Php. L
oc" | OR
PPh,
Q
Schéma 4
Q35. Identifier la nature des espèces T, U, V et W et écrire l'équation-bilan
de la réaction
d'hydroformylation.
Q36. Indiquer les étapes de ce cycle catalytique conduisant à une variation du
nombre d'oxydation du
rhodium Rh en précisant la valeur de cette variation. Proposer un nom pour les
étapes Q -- KR,
R--Set S -- M.
Q37. Lors de cette synthèse, une analyse du milieu par spectroscopie de
résonance magnétique
nucléaire du proton (RMN 'H) montre qu'un isomère de chaîne du produit attendu
est formé en faible
quantité : donner sa formule et identifier l'étape du cycle expliquant sa
formation. Comment qualifier
cette réaction en termes de sélectivité ? Expliquer en quoi la RMN 'H permet de
distinguer les deux
produits i1somères.
11/15
Q38. Expliquer en quoi l'hydroformylation « occupe une place privilégiée dans
la chimie verte »
grâce à « l'économie atomique ».
Partie IIT - Propriétés des alliages platine-rhodium
Q39. Représenter une maille cristallographique de platine ou de rhodium pur.
Démonter à l'appui de
calculs simples que l'alliage entre le platine et le rhodium ne peut pas être
un alliage d'insertion. Justifier
que l'hypothèse d'un alliage de substitution est plausible.
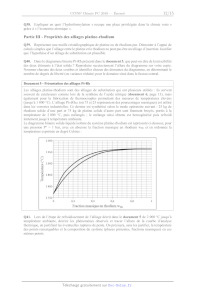
Q40. Dans le diagramme binaire Pt-Rh présenté dans le document 5, que peut-on
dire de la miscibilité
des deux éléments à l'état solide ? Reproduire succinctement l'allure du
diagramme sur votre copie.
Nommer chacune des deux courbes et identifier chacun des domaines du diagramme,
en déterminant le
nombre de degrés de liberté (ou variance réduite) pour le domaine situé dans le
fuseau central.
Document 5 - Présentation des alliages Pt-Rh
Les alliages platine-rhodium sont des alliages de substitution qui ont
plusieurs utilités : 1ls servent
souvent de catalyseurs comme lors de la synthèse de l'acide nitrique (document
6, page 13), mais
également pour la fabrication de thermocouples permettant des mesures de
températures élevées
Gusqu'à 1 800 °C). L'alliage Ptz5Rh25 (où 75 et 25 représentent des
pourcentages massiques) est utilisé
dans les verreries industrielles. Ce dernier est synthétisé selon le mode
opératoire suivant : 25 kg de
rhodium solide d'une part et 75 kg de platine solide d'autre part sont finement
broyés, portés à la
température de 2 000 °C, puis mélangés ; le mélange ainsi obtenu est
homogénéisé puis refroidi
lentement jusqu'à température ambiante.
Le diagramme binaire solide-liquide isobare du système platine-rhodium est
représenté c1-dessous, pour
une pression P° = 1 bar, avec en abscisse la fraction massique en rhodium wrr
et en ordonnée la
température exprimée en degré Celsius :
2 000-
1 950
1 900
1 850-
Température (°C)
1 800"
1 750 +---- D I RE D | ] LT I I TI
0 0,2 0,4 0,6 0,8 1
Fraction massique en rhodium wa:
Q41. Lors de l'étape de refroidissement de l'alliage décrit dans le document 5
de 2 000 °C jusqu'à
température ambiante, décrire les phénomènes observés et tracer l'allure de la
courbe d'analyse
thermique, en justifiant les éventuelles ruptures de pente. On précisera, sans
les justifier, la température
des points remarquables et la composition du système (phases présentes,
fractions massiques) en ces
mêmes points.
12/15
Q42. En raisonnant à partir de la notion d'affinité chimique, discuter du choix
de la faible pression
dans le four à catalyseur O présenté dans le document 6. En utilisant les
données, justifier
l'échauffement observé lors de cette étape.
Document 6 - Synthèse de l'acide nitrique
L'acide nitrique HNO; est un composé très important dans l'industrie chimique.
Il est notamment utilisé
pour fabriquer des engrais comme le nitrate d'ammonium NH4NO3. Son procédé de
synthèse, à partir
de l'ammoniac NH, a été breveté en 1902 par Wilhelm Ostwald ; le schéma
simplifié du procédé
industriel est présenté ci-dessous :
NO Y
NO/HL0 À
NH; © NE @
< O NO/H,0 HNO; O est un four à catalyseur Pt-Rh dans lequel a lieu la combustion de l'ammoniac NH3 à pression constante P -- 1,0 bar et à haute température selon la réaction : 4 NH:(g) + 5 O(£) = 4 NO(£) + 6 HO(e) La température optimale d'action du catalyseur est de 650 °C. IT faut éviter un échauffement excessif et donc avoir une durée de contact très faible d'environ 1 ms. © est un échangeur de chaleur permettant de refroidir les gaz sortants du four © et de préchauffer l'ammoniac entrant dans le four. ® est un réacteur au sein duquel la température du monoxyde d'azote est abaissée à 100 °C, lui permettant de réagir avec le dioxygène atmosphérique selon la réaction : 2 NO(£g) + O(g) = 2 NO:(£) Ce réacteur ®, parfaitement agité de volume V = 100 L et supposé isotherme, est alimenté par un débit volumique constant D = 50 L:min ! en monoxyde d'azote de pression à l'entrée P(NO)o = 1,0 bar. En régime permanent, on observe que la pression P(NO): au sein de ce réacteur est constante au cours du temps. @ est une cuve séparatrice contenant de l'eau dans laquelle le dioxyde d'azote est dissous à température ambiante pour former de l'acide nitrique fumant selon la réaction : 3 NO:(2) + HO(1) = 2 HNO:(aq) + NO(e) 13/15 Document 6 (suite) - Synthèse de l'acide nitrique Afin d'étudier la cinétique de la réaction se déroulant dans le réacteur ®, on réalise au laboratoire deux suivis expérimentaux à 25 °C de la pression en réactifs au cours du temps pour des pressions initiales différentes ; on obtient les résultats suivants : e Expérience 1 : p(NO)o = 24,8 Pa et p(O2)o = 1,24.10* Pa Temps t (min) 1,0 2,0 4,0 8.0 12,0 20,0 30,0 p(NO) (Pa) 23,8 22,8 21,1 18,4 16,1 13,1 10,7 e Expérience 2 : p(NO)o = 1,24.10°* Pa et p(O2)o = 24,8 Pa Temps t (s) 10 20 30 60 120 240 360 p(O>) (Pa) 23,1 21,3 19,8 15,9 10,2 4,2 1,7
On fait l'hypothèse que la vitesse de la réaction s'écrit sous la forme v =
K[NO/[P[O2 |", p et q étant des
nombres quelconques et k étant la constante de vitesse de la réaction.
Le mécanisme proposé pour cette réaction est le suivant :
k
2 NO -- NO; équilibre rapide
--1
NO; + O; +, 2 NO; lente
Source : http://www4.ac-nancy-metz.fr
Q43. En raisonnant à partir de la notion d'affinité chimique, justifier les
conditions de température
permettant de réaliser quantitativement l'oxydation du monoxyde d'azote en
dioxyde d'azote dans le
réacteur ® présenté dans le document 6.
Q44. Pour un gaz parfait, rappeler la relation entre sa pression et sa
concentration molaire. Expliquer
pourquoi chacune des deux expériences 1 et 2 présentées dans le document 6
permet de déterminer l'un
des ordres partiels par rapport à l'un des deux réactifs de la réaction
d'oxydation du monoxyde d'azote.
Q45. À partir des valeurs expérimentales présentées dans le document 6,
montrer, en détaillant la
démarche, que l'ordre partiel par rapport au monoxyde d'azote vaut p = 2. On
admettra que l'ordre
partiel par rapport au dioxygène vaut q= I.
Q46. En détaillant la démarche, vérifier que le mécanisme proposé pour cette
réaction est bien en
accord avec la loi de vitesse déterminée à la question Q45.
Q47. À partir d'un bilan de matière en NO réalisé en régime permanent
stationnaire dans le réacteur ®,
montrer que la vitesse de la réaction vi s'y produisant à la température T1 =
373 K a pour expression :
EL D(P(NO jentrée -- P(NO sortie)
_ 2RTV |
Vi
Q48. Sachant que la pression de NO mesurée en sortie du 1° réacteur est 2,0
fois plus faible que celle
en entrée, déterminer la valeur numérique de la vitesse de la réaction vi se
produisant dans ce réacteur
en utilisant l'expression de la question Q47.
14/15
Données relatives à l'ensemble du sujet
RMN 'H : gamme de déplacements chimiques de quelques hydrogènes
caractéristiques et valeurs
typiques des constantes de couplage "J*
Protons Ô (ppm)
--CH-CH=CH-- 1,5 -- 2,4 Structures 3J (Hz)
JL 2,2 -- 2,6 ed. 4--8
R7 "CH; 7 TK
"
CH CH 10 -- 18
CY 232,8
--CH--N- 3,5 -- 4,2
--CH--O- 3,5 -- 4,8
R-CH=CH-R 4,6 -- 7,0
O
À 9,1 -- 10,3
R H
IR (gamme de fréquences de vibration de quelques liaisons caractéristiques)*
Liaisons v (cm!) Intensité
O-H alcool 3 200 ---3 650 | Intense et large
C=O ester saturé 1 730 -- 1 750 Intense
C=O ester conjugué 1715 -- 1 730 Intense
C=O aldéhyde saturé 1 720 -- 1 740 Intense
C=O cétone saturée 1 705 -- 1 725 Intense
C=O aldéhyde conjugué | 1 680 -- 1 705 Intense
C=O cétone conjuguée 1 665 -- I 885 Intense
C=C alcène 1 645 -- 1 675 Moyenne
C=C alcène conjugué 1 635 -- I 650 Moyenne
*Source : Tables of Spectral Data for Structure Determination of Organic
Compounds 2 Edition, E. Pretsch,
W. Simon, J. Seibl, T. Clerc ; W. Fresenius, J. F. K Hubert, E. Pungor, G. À.
Rechnitz, W. Simon Eds. ; 1989.
Numéros atomiques
Élément CT | Ru | Pd | Os | Ir | Pt
Z 17 | 44 | 46 | 76 | 77 | 78
Données cristallographiques
Espèce Rh Pt
Structure cristallographique à l'état solide | Cubique Faces Centrées | Cubique
Faces Centrées
Paramètre de maille a (pm) 380 392
Enthalpies standard de formation (supposées indépendantes de la température)
Espèce
H20(2)
NH:(g) | NO:(2)
NO(2)
AfH° (kJ.mol !) | -241
8
-- 45,9 33,2
90,2
Constante des gaz parfaits : R = 8,31 J-K_!-mol |
FIN
15/15
