CCINP Chimie 1 PC 2005
| Thème de l'épreuve | Synthèse du Kalihinol C |
| Principaux outils utilisés | chimie organique, solutions aqueuses, oxydoréduction, cristallographie, thermochimie, diagramme d'Ellingham |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)







Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
SESSION 2005 FOCH 108
A
CONCOURS (0MMUNS POlYÏECHNIOUES
EPREUVE SPECIFIQUE - F ILIERE PC
CHIMIE 1
Durée : 4 heures
L'utilisation des calculatrices est autorisée.
Chaque partie est indépendante et dans chaque partie de nombreuses questions
sont
indépendantes.
La stéréochimie des liaisons formées au cours des différentes étapes de la
synthèse organique
n'est pas étudiée.
Toutes les données utiles sont rassemblées àla fin du sujet.
N.B. : Si un candidat est amené à repérer ce qui peut lui sembler être une
erreur d 'e'nonce', il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des initiatives
qu'il a été amené à prendre.
Nous allons nous intéresser à la synthèse d'un précurseur du
Kalihinol C, qui a été isolé à partir d'une éponge en 1984.
Cette molécule fait partie d'une riche famille de diterpénoïdes
marins, appelés les kalihinanes. Plusieurs kalihinanes ont CN ... ()
montré une action antimicrobienne, antifongique et plus 14
particulièrement anti-malaria. Wifi/{
Kalihinol C
1 Etude stéréochimique du Kalihinol C
1.1 Cette molécule est--elle chirale ? Justifier votre réponse.
1.2 Combien de centres asymétriques possède le Kalihinol C ? Donner
laconfiguration absolue
des centres C1, C4, C5 en justifiant votre réponse.
2 Détermination de la structure du produit de départ _2_
Ce composé est obtenu à partir du produit commercial de formule brute CgH1403.
N&BH4
CgH;4O3 C8H1603
1 2
2.1 Calculer le nombre d'insaturations du composé _1_.
Le spectre [R de ce produit a été effectué. Il présente les bandes
caractéristiques suivantes :
1725 et 1750 cm".
2.2 Attribuer les bandes de vibration correspondant à ces valeurs.
Le spectre RMN 1H (à 60 MHZ) de l a été effectué dans CDCl3 ; il présente les
signaux suivants :
2.3 Attribuer les signaux de ce spectre ; justifier leur multiplicité.
3 protons
2 protons
2.4 Déterminer la structure du composé 1.
Par action sélective de NaBH4 le composé 1 se transforme en dérivé _2_ qui
présente une bande large,
caractéristique en IR, à 3300 cm"'.
2.5 Déterminer la structure du composé _2_ . Justifier votre réponse.
3 Etude de la synthèse du triène _8_
Le Kalihinol C est obtenu à partir de la lactone _1_9_ qui elle--même est
obtenue à partir du triène _8_.
Nous allons nous intéresser à la synthèse de ces deux composés, selon le schéma
suivant :
OCH2Ph
...
La structure bicyclique du Kalihinol C est mise en place lors d'une réaction
thermique
1ntramolécula1re du composé &. Celui--ci a été obtenu selon la suite
réactionnelle ci-dessous :
l- LDA (2 éq) / THF, PhCHZO O
C8H1603 - 40°C à NaH, PhCHZBr /'\/"\/k
;_ 2_ Br OSiMe3 Nal, THF, 0°C à /'\/n\o
3-- NaHCO3, aq.
Me3SiO 4 /
CHzPh PhCH2
\
nBuLi/l 6 Cr03
. / - ° ' \
Me3S1O THF' 78 C | Me3SiO /
_ Pourquoi doit-on utiliser 2 équivalents de base
diisopropylamidure de lithium (LDA) '? Proposer un mécanisme pour cette
réaction.
3.1 Donner la structure du composé 3.
La fonction alcool secondaire du dérivé à est ensuite protégée sous la forme
--O--CHz--Ph. Le
composé 5 ainsi obtenu est transformé en alcool primaire _5_. Celui--ci est mis
en réaction en présence
du mélange Cr03, pyridine pour former le composé @.
3.2 Proposer un réactif permettant la formation du dérivé _5_ à partir de 51_.
3.3 Donner la structure du composé _6_ sachant qu'il présente une bande en IR à
1720 cm"'. A
quelle bande de vibration correspond cette valeur ? (On indique qu'aucune bande
vers
3400 cm"1 n'est observée). Nommer la fonction chimique formée.
Le composé Q est traité par une solution composée du réactif ] et de
n--butyllithium en solution dans
le tétrahydrofurane (THF).
3.4 En étudiant la structure du composé & formé, donner la formule topologique
du réactif 1.
Donner l'équation-bilan de la réaction du n--butyllithium sur le dérivé Z .
4 Structure cristalline de la chromite ; obtention de trioxyde de chrome.
Lors de la synthèse du Kalihinol C, au cours du passage du composé _5_ au
composé @, on utilise le
trioxyde de chrome Cr03 dans la pyridine. Le trioxyde de chrome est un oxydant
fort, très utilisé au
laboratoire. Il est obtenu industriellement à partir de la chromite de formule
PexCryOZ qui est le
principal minerai du chrome. Nous nous intéressons dans cette partie à la
structure cristalline de la
chromite (ce qui nous permet de déterminer x y et 2 ainsi que le degré d'
oxydation (t) du chrome
dans le minerai). Puis nous étudierons brièvement les étapes permettant
d'obtenir le trioxyde de
chrome à partir de la chromite.
4.1 La chromite F e,.CryOZ est le principal minerai du chrome. Elle cristallise
dans une structure
que l'on peut décrire de la façon suivante : les ions OZ" forment un réseau
cubique à faces
centrées (cfc), les ions Fe2+ occupent certains sites tétraédriques et les ions
Cr" occupent
certains sites octaédriques.
4.1.1 Représenter la maille conventionnelle du réseau cubique à faces centrées
formé par les
anions OZ". Indiquer la position des sites tétraédriques et des sites
octaédriques dans un
réseau cubique à faces centrées. Préciser sur le schéma la position d'un site
tétraédrique et d'un site octaédrique.
4.1.2 Déterminer le nombre d'ions 02-- par maille.
4.1.3 Sachant que les ions Fe2+ occupent 1/8 des sites tétraédriques et les
ions Crt+ occupent
la moitié des sites octaédriques, déterminer le nombre d'ions Fe2+ par maille
et le
. + .
nombre d'ions Crt par ma111e.
4.1.4 En déduire la formule de la chromite FexCryOz. Quel est le degré
d'oxydation (t) du
chrome dans le cristal ?
4.1.5 Le paramètre de la maille vaut a = 419 pm et le rayon ionique de l'ion
OZ" vaut
r(02") = 140 pm. Dans l'hypothèse où les cations sont tangents aux anions,
calculer le
rayon du plus gros cation que l'on puisse insérer dans un site octaédrique.
Calculer de
même le rayon du plus gros cation que l'on puisse insérer dans un site
tétraédrique.
(On précise que dans la structure les ions 02_ ne sont pas tangents).
4.1.6 En réalité, les rayons ioniques sont les suivants : r(Fe2+) = 76 pm
r(Cr") = 61,5 pm. '
- Comparer ces valeurs aux valeurs calculées à la question précédente.
Commenter.
4.1.7 Calculer la masse volumique de la chromite en kg.m'3 .
4.2 Le procédé industriel permettant l'obtention de trioxyde de chrome CrO3 à
partir de la
chromite met en jeu deux réactions successives :
1) la chromite est traitée à haute température par du carbonate de sodium
Na2CO3 ;
on obtient du chromate de sodium NazCr04.
2) le chromate de sodium NaZCrO4 est traité par de l'acide sulfurique HZSO4 ; on
obtient le trioxyde de chrome CrO3.
4.2.1 Donner la configuration électronique du chrome (on rappelle que cet
élément désobéit
à la règle de Klechkovski). En déduire son degré d'oxydation maximal.
4.2.2 Calculer le nombre d'oxydation du chrome dans le chromate de sodium
Na2CrO4 et
dans le trioxyde de chrome CrO3.
4.2.3 Proposer une structure de Lewis pour l'ion CrO42_ et pour Cr03. La
liaison Cr--O est-
elle plus courte dans Cr042" ou dans Cr03 ?
4.2.4 A l'aide de la méthode VSEPR, prévoir la géométrie de ces deux molécules.
5 Etude de la synthèse de la lactone 19 précurseur du Kalihinol EUR
Nous allons maintenant étudier la formation de la lactone _1_9_.
. \ déprotection
£ chauffage de l'alcool K2Cf2Ü7
-- -------------> 2 ___--> H
_ HZSO4
. / à
MC3SIÛ AOCHZPh
_& H
] MCPBA
l- déprotection @ @
de l'alcool Ph3P--CH1, ]
«_ _1_â ' _ _l_2_
2- oxydation NaNH2, DMSO
EtMgBr, THF, --78°C
2-- H20, HC]
18 ---------->
Par chauffage du triène _8_, le composé 2 est obtenu.
5.1 Donner la structure du composé _9_. Nommer la réaction correspondante. ,
L'alcool silylé est ensuite déprotégé. Le produit obtenu est mis en réaction
avec le mélange
K2Cr207, HzSO4. Le composé l_1_ ainsi obtenu est mis à réagir en présence de
l'acide méta--
chloroperbenzoïque (MCPBA). Le produit & obtenu est mis en présence d'un dérivé
du phosphore
et d'une base.
5.2 Donner la structure des composés _1_1_ et _1_2. Nommer la fonction chimique
obtenue lors de la
formation de 12.
5.3 Donner la structure du composé _1_3_. Quel est le nom de cette réaction '?
Quel est le sous--
produit phosphoré de cette réaction ?
Ce dérivé _1_3_ subit une déprotection de la fonction alcool suivie d'une
réaction d'oxydation. La
cétone 1_4_ ainsi obtenue est ensuite transformée en dérivé l_5_ en une étape,
non détaillée ici.
La réaction suivante s'effectue en deux temps : le bromure d'éthylmagnésium
réagit sur le composé
& puis le réactif ainsi obtenu se condense sur le composé 15. Après hydrolyse,
on obtient le
composé 11.
5.4 Ecrire l'équation--bilan de la réaction du bromure d'éthylmagnésium sur le
composé _1_6_. Cette
réaction est en compétition avec une autre réaction; écrire l'équation-bilan de
cette autre
réaction.
5.5 Ecrire le mécanisme réactionnel de formation du composé _1_7 à partir de la
molécule Q.
Par hydrogénation de 11, en présence de nickel de Raney, le composé 1_8_ est
obtenu.
5.6 Donner la structure de _1_ë.
5.7 Dans des conditions expérimentales non détaillées ici, le Composé Q subit
une réaction
intramoléculaire pour conduire à la molécule finale 12. Proposer un mécanisme
de formation
du composé Q. Il est indiqué que cette réaction est analogue à celle qui se
produirait entre
un alcool et un chlorure d'acyle.
6 Dosagesd'une solution de dichromate de potassium K2Cr207.
La transformation du composé 19 en composé _1_1 nécessite l'utilisation d'une
solution de
dichromate de potassium, acidifiée par l'acide sulfurique. Dans cette partie,
on étudiera la stabilité
des solutions de dichromate de potassium en milieu acide, puis on envisagera
une méthode pour
doser une solution de dichromate de potassium.
6.1 Etude du diagramme potentiel-pH du chrome.
Le diagramme potentiel--pH simplifié du chrome est fourni à la fin de ce
paragraphe (Figure 1). Les
espèces considérées sont Cr (5), Cr2+, Cr", CrZO72--, CrO42" et Cr(OH)3 (5). On
y a superposé les
droites correspondant aux deux couples de l'eau. ]
Le tracé a été réalisé pour une concentration totale en chrome dissous égale à
..."1 mol.L' et en
considérant qu'il y a égalité des concentrations à la frontière entre deux
espèces dissoutes.
6.1.1 En justifiant votre raisonnement, attribuer aux diverses espèces les
différents
domaines repérés par les numéros 1 à 6. Indiquer s'il s'agit de domaines de
prédominance ou d'existence.
6.1.2 Etablir l'équation de la frontière entre Cr3+ et Cr(OH)3 (5).
6.1.3 A partir des données, établir l'équation de la frontière entre Cr(OH)3
(s) et Cr".
6.1.4 Ecrire la demi-équation d'oxydoréduction entre Cr(OH)3 (s) et CrOf'. En
déduire la
pente de la droite séparant leurs domaines.
6.1.5 Que se passe-t--il au point A par élévation du pH ? Ecrire la réaction
correspondante.
6.1.6 On constate expérimentalement que le chrome métal ne réagit pas avec
l'eau dans un
vaste domaine de pH. Expliquez ce phénomène en vous appuyant sur la lecture du
diagramme potentiel--pH.
6.1.7 Ecrire la réaction du dichromate de potassium Cr2072_ sur l'eau. A quelle
condition sur
le pH les solutions de dichromate de potassium sont-elles stables (aucun calcul
n'est
attendu)? En pratique, on utilise parfois au laboratoire des solutions qui
n'obéissent
pas à cette condition ; expliquez pourquoi ceci est possible.
E (en V)
«--
-...
-
........
-._
-...
-__
.--
nu.-_
.--_
....
--
----------------
-._
--._
...,
-..
--__
Q...
|...
un...
-..,
--._
..-
-,,_
°.-
-...
-
......
---_
--.
-.._
__...
-..
nu.--_
---
....
v..._
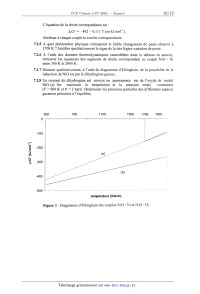
Figure 1 : diagramme potentiel-pH simplifié du chrome pour une concentration
totale en
chrome dissous égale à 10'1 mol.L'l et égalité des concentrations à la
frontière.
6.2 Dosage d'une solution de dichromate de potassium par de la soude décimolaire
On dose v0= 20 mL d'une solution de dichromate de potassium de concentration co
par de la soude
décimolaire. On note v le volume de soude ajouté et c = 10'1 mol.L'1 la
concentration de la soude.
La courbe de dosage est fournie page 8 (Figure 2).
L'acidité des solutions de dichromate de potassium peut être interprétée grâce
à l'équilibre :
Cr2072_ + HgO = 2Cro42* + 2 H+ K=10"4'4
6.2.1 Ecrire la réaction de dosage. Calculer sa constante d'équilibre.
6.2.2 Ecrire la condition réalisée à l'équivalence. Lire sur le diagramme la
valeur du
volume à l'équivalence ; en déduire la concentration de la solution de
d1chromate de
potassium.
6.2.3 Calculer le pH de la solution de dichromate de potassium de concentration
c....
6.2.4 Calculer le pH à la demi--équivalence.
6.2.5 La courbe de dosage est analogue à celle du dosage d'un monoacide faible
par une
base forte. Indiquer, par lecture sur la courbe, quelle serait la valeur du pKa
de ce
monoacide' faible. Commenter la valeur obtenue.
6.3 Dosage d'une solution de dichromate de potassium par de la soude
décimolaire en présence
d'ions Ba". *
Pour améliorer la précision du dosage précédent on ajoute 5 mL d'une solution
de chlorure
de baryum molaire ( 1 mol.L") à la solution précédente (vo= 20 mL) de
dichromate de
potassium de concentration co. On dose la solution obtenue par de la soude
décimolaire. On
note v le volume de soude ajouté etc = 10" mol.L" la concentration de la soude.
6.3.1 Ecrire la réaction qui a lieu quand on ajoute des ions Ba2+ à une
solution de
dichromate de potassium. '
6.3.2 Montrer que cette réaction peut être considérée comme totale. En déduire
que la
solution de dichromate de potassium se comporte alors comme une solution d'acide
fort dont on précisera la concentration.
6.3.3 Indiquer la valeur du volume à l'équivalence.
6.3.4 Calculer, brièvement, le pH de la solution pour v = 0 mL, v = v& / 2, v =
vEUR et v =
1,5.ve. (On admettra, pour cette question, que l'hydroxyde de baryum Ba(OH);
(5) ne
précipite pas au cours du dosage).
6.3.5 Représenter l'allure de la courbe de titrage. Expliquer pourquoi la
précision du titrage
a été améliorée.
6.3.6 Montrer qu'effectivement l'hydroxyde de baryum Ba(OH)Z (s) ne précipite
pas au
cours du dosage.
45.0 .
2.5
V (mL)
Figure 2 : courbe de dosage d'une solution de dichromate de potassium par de la
soude.
7 Obtention du nickel de Sabatier
Au cours de la synthèse du Kalihinol C, lors du passage du composé l_'_/'_ au
composé 1£_3, on réalise
une hydrogénation catalytique en présence de nickel de Raney. Ce type de
réaction a été découvert
par le chimiste français Paul Sabatier qui reçut le prix Nobel de chimie en
1912.
La préparation du nickel de Sabatier s'effectue de la façon suivante :
NiCO3 (s) = NiO (s) + co2 (g) (1)
NiO (S) + Hz (g) = Ni (S) + HzO (g) (2)
7.1 Dissociation thermique du carbonate de nickel
On considère l'équilibre : NiCO3 (s) = NiO (s) + C02 (g)
7.1.1 Définir et déterminer la variance du système physico--chimique envisagé.
L'expérimentateur peut--il choisir la température et la pression pour
lesquelles il y
aura équilibre entre tous les constituants ?
7.1.2 En utilisant les données, calculer l'enthalpie libre standard de cette
réaction à 298 K.
7.1.3 Quelle est l'influence d'une augmentation de la température sur
l'équilibre ? Justifier
succinctement votre réponse.
7.1.4 Quelle est l'influence d'une augmentation de la pression sur l'équilibre
? J ustif1er
succinctement votre réponse.
7.1.5 Calculer l'affinité du système à 298 K
si p(COZ) = 5 bars (a)
si p(COZ) = 10*2 bar (b)
Conclure dans chaque cas sur l'évolution du système.
7.2 Réduction de l'oxyde de nickel par le dihydr0gène
On considère l'équilibre : NiO (s) + Hz (g) = Ni (s) + H20 (g).
La figure 3 représente le diagramme d'Ellingham, entre 300 K et 2000 K, associé
aux couples
NiO / Ni et H20 / H2 (les réactions correspondantes sont ramenées à une mole de
dioxygène).
7.2.1 Quelle approximation fait-on lors de la construction d'un diagramme
d'Ellingham '?
On supposera par la suite que l'on travaille dans le cadre de cette
approximation.
7.2.2 Rappeler la définition de la réaction de formation d'un corps pur
composé, à une
température T.
7.2.3 Ecrire cette réaction dans le cas de NiO (s) (on écrira la réaction pour
une mole de
dioxygène à 300 K).
7.2.4 La figure 3 représente le diagramme «E'Ellingham, entre 300 K et 2000 K,
associé au
couple NiO / Ni. On y a ajouté le diagramme correspondant à la réaction :
2Hz (8) + 03 (g) : 2H20 (8)-
ArG° (kJ.mof')
L'équation de la droite correspondante est :
A.G° = ---- 492 + 0,111 T (en kJ.mol"').
Attribuer à chaque couple la courbe correspondante.
7.2.5 A quel phénomène physique correspond le faible changement de pente
observé à
1708 K ? Justifier qualitativement le signe de la très légère variation de
pente.
7.2.6 A l'aide des données thermodynamiques rassemblées dans le tableau en
annexe,
retrouver les équations des segments de droite correspondant au couple NiO / Ni
entre 300 K et 2000 K.
7. 2. 7 Discuter qualitativement, à l'aide du diagramme d' Ellingham, de la
possibilité de la
réduction de NiO (s) par le dihydrogène gazeux.
7.2.8 Un courant de dihydrogène est envoyé en permanence sur de l'oxyde de
nickel
NiO (s). On maintient la . température et la pression totale constantes
(T = 900 K et P = 2 bars). Déterminer les pressions partielles des différentes
espèces
gazeuses présentes à l'équilibre.
300 700 1 100 1 500 1 708 1900
--100
-200
-300
--400
température (Kelvin)
Figure 3 : Diagramme d'Ellingham des couples NiO / Ni et HzO / H2
ANNEXE
RMN 1H : gamme de déplacements chimiques :
__ -CH2-CH2 -CH2-CO- -CHz-O-COR1 CHR=CRZ
0,90-1,45 1,55-2,10 2,00-3,00 4,50-5,00 5,50--6,00
INFRAROUGE : nombres d'onde de vibration de quelques groupes fonctionnels
Groupe C=O C=O C=O
fonctionnel aldéhyde ester saturé cétone
0 (cm") 3600 3300-3550 1720-1740 1735--1750 1705-1725
Données
Masses molaires : O = 16,0 g.mol°' Fe = 55,8 g.mol" Cr = 52,0 g.mol".
NumérosatomiqueszN:Z=7 O:Z=8 Cr:Z=24
Nombre d'Avogadro NA = 6,022.1023 mol"'.
Constante des gaz parfaits : R = 8,314 J .K".mol'1
Données thermodynamigues à 298 K
3--°Ï=Ë'--QË = 0,06 v (à 298 K)
Potentiels standard d'oxydoréduction à 298 K et à pH = 0
Cr2+/Cr(s) Cr3+/Crz+ Cr2072"/Cr3+ Oz(g)/HZO
E° ...)
sz (Cr(OH)3 (s)) = 31,0
Produit ionique de l'eau : pKe = 14,0
Crzo7z* + HZO = 2 cro42- + 2 H+ K = 1044,4
sz(BaCrO4 (s)) = 9,9
sz (Ba(OH)Z (s)) = 2,3
'température de fusion (°C) A)...H" (kJ. mol ) température d' ébullition (°C)
A...H° désigne l' enthalpie standard de changement d' état.
-------
...--
___--
___-_
AfH° désigne l'enthalpie standard de formation à 298 K.
S° désigne l'entropie molaire standard à 298 K.
Fin de l'énoncé
