CCINP Chimie 1 PC 2004
| Thème de l'épreuve | Étude du Viagra |
| Principaux outils utilisés | chimie organique, orbitales moléculaires, potentiel chimique, diagrammes potentiel-pH, courbes intensité-potentiel, cristallographie, théorie des bandes |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)



Énoncé obtenu par reconnaissance optique des caractères
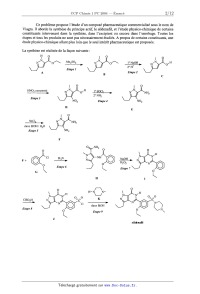
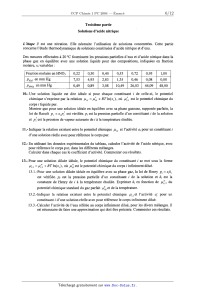
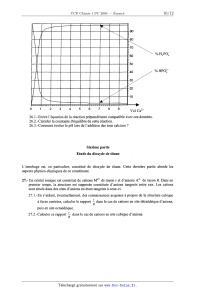
SESSION 2004 . PCCH 108 CONCOURS COMMUNS POlYIECHNIOUES EPREUVE SPECIFIQUE -- FILIERE PC CHIMIE 1 Durée : 4 heures Les calculatrices sont autorisées. Les différentes parties sont indépendantes. Mise en garde Toute démonstration illisible ou incompréhensible sera considérée comme fausse. Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu 'il a été amené à prendre. Ce problème propose l'étude d'un composé pharmaceutique commercialisé sous le nom de Viagra. Il aborde la synthèse du principe actif, le sildenafil, et l'étude physico-chimique de certains constituants intervenant dans la synthèse, dans l'excipient ou encore dans l'enrobage. Toutes les étapes et tous les produits ne sont pas nécessairement étudiés._ A propos de certains constituants, une étude physico--chimique allant plus loin que le seul intérêt pharmaceutique est proposée. La synthèse est réalisée de la façon suivante : H . N N' o/\ M62504 N' o/\ 1° NaOH N,N o'H ------------> --------> 2° H+ Etape 1 A B - Etape 2 C | O HNO3 concentré o SGC] N'N NH2 2° NH3 Etape 3 Etape 4 NO2 D E | 0 ,N SnClz N NH2 dans EtOH/ H20 Etape 5 NH2 F O NH2 O O \ C] EÎ3N | NH F + ___) N O 0 Etape 6 \\ G K H H--N N-- O O\ I 0 K \\ '/ ClSO3H ' s' S\ ----> \ C1 ------.--------> N dans EtOH /» Etape 8 N Etape 9 \ sildenafil Sous sa forme utilisée, ce composé pharmaceutique est constitué d'un noyau et d'un enrobage. Outre le principe actif, le noyau contient les constituants suivants : Cellulose microcristalline, Hydrogénophosphate de calcium anhydre, Croscarrnellose de sodium, Stéarate de magnésium. L'enrobage a la composition suivante : Hypromellose, Dioxyde de titane, Lactose, Triacétine, Laque d'aluminium-indigotine (carmin d'indigo E 131). Première partie Aspects de la synthèse du sildenafil 1.- Dans l'étape 1 , le diméthylsulfate MeZSO4 pourrait être remplacé par l'iodométhane. 1.1.- Proposer un mécanisme pour la synthèse de B à partir de A et de l'iodométhane. Justifier la facile déprotonation de l'ion ammonium formé intermédiairement. 1.2.-- Parmi les solvants possibles du tableau ci-dessous, indiquer, en justifiant, celui qui serait le mieux adapté pour réaliser cette étape. , Alcool benzylique , ,, (phénylméthanol) Acetate d ethyle Cyclohexane relat1ve - Moment d1pola1re 1,7 1,85 en Debye 2.-- Proposer un mécanisme pour la réaction de l'étape 2. 3.-- L 'étape 6 conduit à la synthèse du composé H. 3.1 .-- Proposer un mécanisme pour cette réaction. 3.2.-- Quel est le rôle de la triéthylamine '? 4.- La réaction de l'étape 9 procède par un mécanisme analogue à celui de la formation d'un amide à partir d'une amine et d'un chlorure d'acide (ou chlorure d'acyle). 4.1.- Proposer un mécanisme pour cette réaction. _ 4.2.- La tétrahydropyrazine K possède deux sites réactionnels possibles. Proposer une interprétation pour la régiosélectivité observée. Deuxième partie Méthode de synthèse du composé G Le produit de départ est l'éthoxybenzène noté L. Lo @ L 5.-- La première étape est une nitration de l'éthoxybenzène. 5.1 .-- Indiquer les conditions de cette réaction : réactif, catalyseur éventuel. 5.2.-- La théorie des orbitales frontières peut être utilisée pour prévoir la structure de l'isomère majoritaire. 5.2.1.-- Montrer que dans le cas où un nucléophile réagit avec un électrophile, l'une des interactions entre orbitales frontières est prépondérante. 5.2.2.-- Dans le cadre de cette seule interaction prépondérante, quelle orbitale de l'éthoxybenzène faut--il étudier '? 5.2.3.-- L'éthoxybenzène est modélisé par le phénol. Les diverses orbitales obtenues par un calcul de Hückel pour cette molécule modèle sont indiquées ci-dessous. Les orbitales moléculaires % sont développées sur la base des orbitales atomiques %- : Wk =ZCk,i<0i. Les coefficients sont i , indiqués en respectant la numérotation de la figure suivante : Quel est l'isomère nitré du phénol qui devrait être majoritairement obtenu ? 5.3.- L'isomère 1-éthoxy--4-nitrobenzène, noté M, est isolé. Pour s'assurer à ce stade que la réaction a bien eu lieu, une chromatographie sur couche mince est réalisée. 5.3.1.- Préciser la signification des termes : phase fixe, éluant, solvant. 5.3.2.-- Faire un schéma du dispositif utilisé. 5.3.3.-- Une goutte d'éthoxybenzène et une goutte du produit M, en solution dans l'éthanol, sont déposées sur plaque de silice. La chromatographie est réalisée. Proposer une position relative pour les taches des différents composés en justifiant la réponse. 6.-- Le produit M est mis à réagir avec du dichlore en présence de chlorure d'aluminium. Quel est le produit N ainsi obtenu ? Justifier l'obtention de l'isomère N en utilisant les règles d'Hollemann ; le mécanisme n'est pas demandé. 7 .- Proposer une méthode pour obtenir l'acide 2-éthoxy--S-nitrobenzoïque P à partir de N. NO2 HO P 0 Cd 8.-- Proposer une suite de réactions permettant d'obtenir la molécule souhaitée G à partir de P. Une méthode consiste à passer par un cation diazonium. 9.- Stratégie de synthèse 9.1.- Après chloration de l'éthoxybenzène, les réactions utilisées dans la question 7 et le passage au chlorure d'acide sont réalisés. Quel isomère Q est obtenu majoritairement, en considérant que le groupe éthoxy oriente principalement en position para lors d'une substitution électrophile aromatique ? 9.2.- Quel est l'intérêt de la nitration de L ? 9.3.- Le spectre RMN (à 90 MHZ) de Q, effectué dans CDCl3, présente les signaux suivants : Deplacement chimique Multiplicité Intégration du signal en 0 .m Attribuer les signaux de ce spectre ; justifier en particulier leur multiplicité. Troisième partie Solutions d'acide nitrique L'étape 3 est une nitration. Elle nécessite l'utilisation de solutions concentrées. Cette partie concerne l'étude thermodynamique de solutions constituées d'acide nitrique et d'eau. Des mesures effectuées à 20 °C fournissent les pressions partielles d'eau et d'acide nitrique dans la phase gaz en équilibre avec une solution liquide pour des compositions, indiquées en fraction molaire, x,-- variables : 10.- Une solution liquide est dite idéale si pour chaque constituant i de celle-ci, le potentiel chimique s'exprime par la relation ,u,.,, = ,u,, + RT ln(X,--) , Où ,uZ, est le potentiel chimique du 48,00 corps i liquide pur. Montrer que pour une solution idéale en équilibre avec sa phase gazeuse, supposée parfaite, la loi de Raoult p, = x,.p: est vérifiée. p,-- est la pression partielle d'un constituant i de la solution et p , est la pression de vapeur saturante de i à la température étudiée. 11.- Indiquer la relation existant entre le potentiel chimique y... et l'activité a,-- pour un constituant i d'une solution réelle avec pour référence le corps pur. 12.- En utilisant les données expérimentales du tableau, calculer l'activité de l'acide nitrique, avec pour référence le corps pur, dans les différents mélanges. Calculer dans chaque cas le coefficient d'activité. Commenter ces résultats. 13.- Pour une solution diluée idéale, le potentiel chimique du constituant i se met sous la forme ,a" : ,uff} + RT ln(x,) , où ,uÏ, est le potentiel chimique du corps i infiniment dilué. l3.1.--Pour une solution diluée idéale en équilibre avec sa phase gaz, la loi de Henry p, : xiki est vérifiée. p,-- est la pression partielle d'un constituant i de la solution et k,-- est la constante de Henry de i à la température étudiée. Exprimer k,-- en fonction de ,ulî'j , du . . . - 0 ! potent1el ch1m1que standard du gaz parfa1t ,u,--,g et de la temperature. l3.2.--Indiquer la relation existant entre le potentiel chimique lui,! et l'activité a; pour un constituant i d'une solution réelle avec pour référence le corps infiniment dilué. l3.3.-Calculer l'activité de l'eau référée au corps infiniment dilué, pour les divers mélanges. Il est nécessaire de faire une approximation qui doit être précisée. Commenter ces résultats. Quatrième partie Etude de la réduction par le chlorure stanneux de l'étape 5 Etude thermodynamique Données ° Potentiels redox standard Sn2+ + 2 EUR" : Sn(s) E]0 = --0,14 V SnOz(s)+4H++2 e--= Sn"+2 H20 E? : 0,12V HSnO£ + 3 H+ + 2 e* : Sn(s) + 2 H20 E? = 0,33 V ° Equilibres non redox HSnOQ + 3 H+ : Sn2+ + 2 H20 ' log K4 : 15,7 SnOâ" + 2 H+ = Sn02(s) + H20 log K5 : 24,7 ° Constante de Faraday : F = 96500 C.mol"1 ° Donnée à prendre en compte dans les calculs : EFI 1n10 z_ 0, 06 V ° La température est de 25 °C. Le diagramme E : f(pH) est construit en ne prenant en compte que les espèces suivantes : SnOz(s), Sn", Sn(s), SnOâ'" , HSn05. La convention pour le tracé des frontières est la suivante : frontière entre un solide et un soluté : la concentration du soluté est prise égale à 1 mol.L'1 ; frontière entre deux solutés : le rapport des concentrations est pris égal à un. La courbe en pointillé correspond au systèmeH'"/H; 14.- Classement des espèces Calculer le nombre d'oxydation de l'étain dans chaque composé pris en compte. 15.- Calcul de grandeurs standard 15.1.-Calculer le potentiel redox standard, EË , du couple SnOz/ Sn qui intervient dans l'équation électrochimique : Sn02(s) + 4 H+ + 4 e" : Sn + 2 H20. 15.2.--Calculer le potentiel redox standard, E$ , du couple SnOz/ HSnO£ qui intervient dans l'équation électrochimique : SnOz(s) + H+ + 2 e* : HSnO£ . 16.- Etude de dismutation 16.1.--Les ions stanneux Sn2+ se dismutent en Sn02 et Sn. Calculer le pH au--delà duquel il n'est pas possible de choisir la concentration en Sn2+ égale à 1 mol.L"l. 16.2.-- HSnOQ se dismute en Sn02 et Sn. Calculer le pH en deçà duquel il n'est pas possible de choisir la concentration des ions HSnO£ égale à 1 mol.L"'. 17 .- Frontières verticales 17.1 .-Etablir l'équation de la frontière entre les ions SnOâ' et Sn02(s). 17 .2.-Etablir l'équation de la frontière entre HSnOQ et Sn2+ . Compte tenu de la valeur du pH établie en 16.1, cette frontière apparaît--elle sur le diagramme ? 18.-- Quel est le couple présent entre les deux pH de dismutation ? Etablir l'équation de la frontière correspondante. 19.- Reproduire le diagramme sur votre copie et placer les espèces dans les différents domaines. 20.- Dans la réaction de l'étape 5, montrer, en écrivant l'équation redox correspondante, que le passage de E à F est une réduction. Cette réaction est effectuée à pH % 7. La réduction de E en F est observée. Quelle espèce de l'étain est formée en admettant que SnClz est dissocié en Sn2+ et 2 Cl" ? Stabilité de l'étain Le diagramme E : f(pH) établi permet également d'étudier la stabilité de l'étain. 21.- Les notions de corrosion, d'immunité et de passivation sont définies habituellement pour une concentration totale très faible. En admettant que l'allure du diagramme donné reste la même pour une faible concentration, préciser les domaines de corrosion, d'immunité et de passivation. 22.-- L'étain est--il thermodynamiquement stable à pH : 1 ? S'il n'est pas stable, quelle est l'espèce formée ? 23.-- L'étude thermodynamique doit être complétée par une étude cinétique. Le tableau suivant indique les surtensions minimales qu'il faut imposer à une cathode, en fonction de sa nature, pour obtenir la réduction de H+ en Hz. Nature de la cathode Surtension minimale à imposer pour déceler la 0,19 0,40 réduction de H2 en volts Le système Sn/Sn2+ est rapide. 23.1.-L'étain est-il réellement attaqué par H+ à pH : l ? Justifier la réponse avec un tracé qualitatif des courbes I : f(E) utiles. 23.2.--Dans une solution à pH : 1, une lame d'étain est reliée électriquement à un fil de platine. Construire qualitativement les courbes I : f(E). Indiquer pour chaque électrode les réactions qui ont lieu. 23.3.--Si le platine est remplacé par le cuivre, que se passe-t--il '? Cinquième partie Rôle de l'hydrogénophosphate de calcium présent dans le noyau Le noyau du composé pharmaceutique contient de l'hydrogénophosphate de calcium. Données ° Pour H3PO4 : pKa1 : 2,1 ; pKa2 = 7,2 ; pKa3 : 12,4 ° Les ions calcium donnent un précipité avec les ions phosphates selon : 2 POÎ," + 3 Ca2+ = Ca3(PO4)2(S) ; avec Kf : 1026 (sz : 26). 24.- Quel serait le pH d'une solution contenant initialement 10",2 mol.L"1 d'hydrogénophosphate de sodium '? 25.-A 100 mL de cette solution est ajoutée, sans variation notable de volume, une quantité de 0,2 mmol d'un acide fort. Quel est le nouveau pH '? 26.-- Dans le cas étudié, des ions calcium sont présents. A 10 mL d'une solution contenant 10"2 mol.L"1 d'ions hydrogénophosphate, une solution contenant 0,1 mol.L"1 d'ions calcium est ajoutée progressivement. La courbe donnant la concentration des diverses espèces en fonction du volume d'ions calcium ajouté est indiquée ci--après : i " II II II II Il fil 9Û I'AII IIVIII li...-... 8° 70 IP.-...... 50 %H2...; Il...-..... 5Û "..-...... ,, M...? 30 un 5 5 7- 8 9 VolCa2+ 26.1 .-Ecrire l'équation de la réaction prépondérante compatible avec ces données. 26.2.--Calculer la constante d'équilibre de cette réaction. 26.3.--Comment évolue le pH lors de l'addition des ions calcium '? Sixième partie Etude du dioxyde de titane L'enrobage est, en particulier, constitué de dioxyde de titane. Cette dernière partie aborde les aspects physico-chimiques de ce constituant. 27 .- Un cristal ionique est constitué de cations MZ+ de rayon r et d'anions AZ_ de rayon R. Dans un premier temps, la structure est supposée constituée d'anions tangents entre eux. Les cations sont situés dans des sites d'anions en étant tangents à ceux-ci. 27.1.-En s'aidant, éventuellement, des connaissances acquises à propos de la structure cubique \ I r ' - c , , - . a faces centrees, calculer le rapport ; dans le cas de cat10ns en 51te tetraednque d'amons, puis en site octaédrique. 27.2.-Calculer ce rapport %-- dans le cas de cations en site cubique d'anions. 28.- Dans les cristaux ioniques réels les cations sont tangents aux anions mais les ions de même signe ne sont pas tangents entre eux. 28.1.-Quelle inégalité doit être respectée entre le rapport--% et les valeurs numériques limites calculées ci--dessus pour les occupations tétraédrique, octaédrique et cubique des cations dans les sites d'anions ? 28.2.--Dans le cas où deux coordinences sont possibles sur le critère géométrique défini précédemment, quelle est celle qui est la plus favorable ? 29.- De façon simplifiée, la structure de Ti02, variété rutile, peut être décrite de la façon suivante : les anions 02" forment un arrangement hexagonal et les ions Ti4+ occupent un site octaédrique sur deux. Le schéma suivant représente cette structure en projection dans un plan contenant la base de la maille hexagonale, le paramètre c est la hauteur de cette maille et a la distance la plus courte entre deux anions d'un plan de base. . cation à 30 / 4 . cation à c /4 O anionàc/2 O anionàOouc Le rayon attribué à Ti4+ est égal à 60,5 pm et celui attribué à 02" est égal à 136 pm. 29.1 .--Calculer le rapport % . L'occupation des sites ainsi prévue est--elle en accord avec la structure ? 29.2.-Compte tenu de la stoechiométrie de Ti02, combien de cations entourent directement un anion (coordinence de l'anion) ? 30.-- Des mesures cristallo graphiques permettent d'établir les résultats suivants : a = 296 pm, c = 407 pm. Calculer la masse volumique de TiOz. Données : Masses atomiques : M(Ti) = 47,9 g.mol"', M(O) : 16 g.mol'1 Constante d'Avogadro : NA : 6,02.1023 mol--1. 31.- Donner la structure électronique du titane et de son cation Ti". Donner la structure électronique de l'oxygène et de son anion 02". (Numéro atomique du titane : Z = 22 ; numéro atomique de l'oxygène : Z = 8). 32.-- En utilisant les résultats de la théorie du champ cristallin, indiquer par un schéma, quelle est la levée de dégénérescence des orbitales atomiques d (éventuellement vides) quand un cation est dans un champ octaédrique. 33.- Dans un cristal métallique, les niveaux énergétiques constituent des bandes. Cette notion est applicable à un cristal ionique. Dans le cadre de l'étude du cristal Ti02, seules seront prises en compte les OA 3d du titane après levée de dégénérescence et les OA 2p de l'oxygène. De plus, l'énergie des OA Bd du titane est supérieure à l'énergie des OA 2p de l'oxygène. 33.l.-En admettant que chaque groupe d'orbitales dégénérées donne lieu à une bande et que les bandes ainsi constituées ne se chevauchent pas, construire un schéma de bandes pour Ti02. 33.2.--Le cristal contient N motifs (N très grand). Indiquer, en fonction de N, combien de niveaux contient chacune des bandes. 33.3.-Indiquer le remplissage des bandes. Le dioxyde de titane Ti02 est-il un isolant ou un conducteur ? 33.4.--Ti82 a une structure de bandes voisine mais la bande des orbitales atomiques 3p du soufre chevauche la bande des orbitales atomiques 3d de plus basse énergie du titane. Construire un schéma de bandes pour Ti82 en ne faisant intervenir que les orbitales 3d du titane et 3p du soufre. Le disulfure de titane Ti82 est-il un isolant ou un conducteur ? (Numéro atomique du soufre Z = 16). ' Fin de l'énoncé
