CCINP Chimie 1 PC 2002
| Thème de l'épreuve | Étude de la synthèse de l'équilénine |
| Principaux outils utilisés | cinétique chimique, oxydoréduction, thermochimie, théorie de Hückel, chimie organique |
| Mots clefs | équilénine, orbitales moléculaires |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - -
Énoncé complet
(télécharger le PDF)
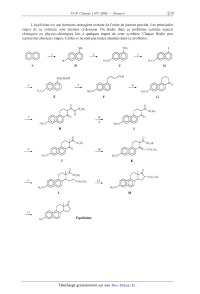





Énoncé obtenu par reconnaissance optique des caractères
A
SESSION2002 CONCOURS (OMMUNS POlYÏECNNIOUIS PCCH108
EPREUVE SPECIFIQUE - FILIERE PC
CHIMIE 1
Durée : 4 heures
Les calculatrices sont autorisées.
Mise en garde
Toute démonstration illisible ou incompréhensible sera considérée comme fausse.
Le candidat attachera la plus grande importance à la clarté, & la précision et
à la concision
de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des
initiatives qu'il a été amené à prendre.
Tournez la page S.V.P.
L'équilénine est une hormone oestrcgène extraite de l'urine de jument gravide.
Les principales
étapes de sa synthèse sont décrites ci--desscus. On étudie dans ce problème
certains aspects
chimiques ou physico--chimiques liés à quelques étapes de cette synthèse.
Chaque flèche peut
représenter plusieurs étapes. Celles-ci ne sont pas toutes étudiées dans ce
problème.
NH2 NH2 1
' @@ 2 @@ 3
--> ----> ------>
HO H3CO H3CO
A B C D
CHZCH20H COZH .
4 @@ 5 @@ 6 @@ O
----------> --> ---->
H3CO H3CO H3CO
E F G
0
. OC2H5
7 8 @@ O
------> ------->
A H3CO
I
0 0
. oc21--15 . OC2H5
9 @@ ° 10 @@
----> ------>
H3CO H3CO
J K
0 0
/
H-
OC2 ) .. C02C2H5
l, @@ C02C2H5 1--2, @@
H3CO H3CO
L M
0
®..
Equilénine
13 ©
------>
HO
Données
° Masses molaires : M(H) = 1 g.mol_1 ; M(C) = 12 g.mol"1 ;M(O) = 16 g.mol'1
' Numéro atomique du fer : Z = 26
° Données thermodynamiques à 298 K
Constante des gaz parfaits : R = 8,31 J.K'1 .mol"1
Constante d'Avogadro : NA = 6,02.1023 mol--1
Potentiels rédox standard : EÎ (HNC)2 / NO) = 0,99 V ; E'; (NO; / HN O,) = 0,94
V
pKA (HNO2 /NOg) = 3,2.
1 - Le passage du naphtalène A au composé B suppose, entre autres réactions,
une nitration d'un
des noyaux aromatiques. Le composé aromatique à nitrer sera désigné par ArH et
dans cette
partie la régiosélectivité ne sera pas envisagée. Le mécanisme de la réaction
de nitration est le
suivant :
HNC, + H,so, <--kk--_Î' H,NO;" + nsc; (1) H,No; --:--'"î_--> 11,0 + No; (2)
No; + ArH --k3--+ ArHNo; (3)
ArHNOË ---'£s----> ArNO2 + H+ (4)
1.1 -- La réaction (1) est rapide (sens direct et inverse) et correspond à un
quasi-équilibre.
1.2-
1.3--
1.4-
Est--il possible d'appliquer l'approximation de l'état quasi stationnaire à
H2NO; ?
La réponse doit être justifiée.
Donner la structure de Lewis de l'intermédiaire NO; .
d [ArH]
La vitesse de disparition, en réacteur fermé, du dérivé ArH est définie par v =
-- d .
t
En admettant qu'il soit possible d'appliquer l'approximation de l'état quasi
stationnaire à
l'intermédiaire NO; , exprimer cette vitesse v en fonction des concentrations
des produits
stables et des constantes de vitesse.
Comment se simplifie cette loi dans le cas d'un dérivé aromatique très réactif ?
2 - La réduction du dérivé nitré en dérivé aminé se fait en milieu acide avec
le fer comme
réducteur. Après purification, il peut être intéressant de tester l'absence de
fer(Il) dans le milieu.
! ° - - \ - , . . 2+ ,
Un test caractenst1que cons1ste a faire réagir les ions Fe avec les ions
hexacyanoferrate(lfl)
Fe(CN)6' ; un solide bleu est obtenu.
2.1 --
Donner la structure électronique des ions Fe2+ et Fe".
Donner la structure électronique des ions Fe(II) et Fe(IH) dans les complexes
Fe(CN){ et Fe(CN){ dans le cadre de la théorie du champ cristallin, avec
l'hypothèse
champ fort (cas de CN' ).
Tournez la page S.V.P.
5-
6-
2.2 - Comparer la stabilisation de ces deux complexes par le champ cristallin,
en admettant que
l'écart énergétique entre les deux niveaux des orbitales d, A... est quasiment
le même pour
les deux complexes. Dans le solide bleu, ce sont les ions Fe(II) et non les
ions Fe(III) qui se
trouvent dans un environnement octaédrique d'ions cyanures. Justifier cette
observation.
2.3 -- Prévoir les propriétés magnétiques de ces complexes.
2.4 -- Les ions Fe3+ et Fe(CN){ réagissent, sans intervention d'autres ions,
pour donner le
solide bleu. Indiquer la formule de ce solide.
Le composé B, à température ambiante et pression atmosphérique, est solide.
C'est un cristal
moléculaire.
3.1 -- Donner deux autres exemples de cristal moléculaire.
3.2 - Quelle est la nature des interactions qui expliquent la cohésion d'un
cristal moléculaire ?
3.3 - Que peut-on dire de la conductivité d'un tel cristal ?
3.4 - Une variété de la glace peut être décrite de la façon suivante : les
atomes d'oxygène
occupent le sommet et le milieu des faces d'un réseau cubique à faces centrées
et en plus
la moitié des sites tétraédriques (construction sur le modèle du diamant, où
les atomes
d'oxygène occupent les positions du carbone). La plus courte distance entre
deux atomes
d'oxygène est de 276 pm. Calculer la masse volumique de ce cristal.
Le composé B est obtenu majoritairement, mais un composé B', également
cristallisé, est formé
très minoritairement.
4.1 - En admettant que B et B' ne forment pas de composés définis, qu'ils sont
totalement
immiscibles à l'état solide et totalement miscibles à l'état liquide, proposer
un schéma
(très lisible) donnant l'allure du diagramme binaire liquide-solide isobare
correspondant.
Indiquer sur ce diagramme la nature des phases et des espèces présentes dans
chaque
domaine. Préciser la signification des points intéressants.
4.2 - Indiquer, en la justifiant, l'allure d'une courbe de refroidissement d'un
mélange
initialement liquide, tel que le premier solide à précipiter soit B.
Le composé B est purifié par recristallisation.
5.1 - Indiquer par des schémas clairs les diverses étapes et le matériel
utilisé lors d'une
recristallisation.
5.2 - Expliquer, à partir du diagramme établi au @ 4.1, comment la mesure du
point de fusion
sur un banc Kofler permet de distinguer un produit pur d'un produit impur.
Une autre application de ces diagrammes binaires liquide-solide est la
cryoscopie. Soit un
solvant S (le benzène) et un soluté P (le phénol). S et P sont totalement
immiscibles à l'état
solide et totalement miscibles à l'état liquide. La phase liquide est
considérée comme idéale. La
température de fusion du benzène, mesurée sous 1 bar, est de 5,5 °C. La
dissolution de 1 g de
phénol dans 100 g de benzène abaisse la température de fusion du mélange de
0,548 °C.
6.1 -- Que signifie solution idéale ? Comment s'exprime le potentiel chimique
d'un constituant i
d'une solution idéale en fonction de la fraction molaire x, ?
6.2 --
6.3 -
6.4 _
6.5 --
6.6 --
6.7 --
'Jï
Ecrire l'égalité des potentiels chimiques du benzéne dans la phase liquide et
dans la phase
solide en faisant apparaître la fraction molaire en benzéne xs, ainsi que des
potentiels
chimiques standard à définir.
d _aÎ_
T
Rappeler la relation donnant dT
, où pf'oe est le potentiel chimique standard du
constituant i dans la phase ça.
En déduire une relation entre lnxs, l'enthalpie de fusion du benzène Afung
supposée
constante, la température de fusion du benzène TS et la température d'équilibre
T.
La quantité de phénol étant très inférieure à celle du benzène, établir, en
justifiant les
approximations qui conviennent, la relation : TS ---- T = AT = stp, dans
laquelle KS est
une grandeur qui ne contient que des données thermodynamiques propres au solvant
(Afung , TS) et xp la fraction molaire en phénol.
Déduire des résultats expérimentaux la valeur numérique de KS.
Application àla détermination d'une constante d'équilibre.
En solution dans le benzène, l'acide acétique (acide éthanoïque), noté AH, se
dimérise
partiellement sous forme (AH)2 selon l'équilibre : 2 AH = (AH)2.
La température de fusion d'une solution de fraction molaire initiale 2.10"2 en
acide
acétique dans le benzène, est de 4,5 °C. On admettra que l'acide acétique n'est
pratiquement pas acide dans ce milieu.
6.7.1 -- Proposer une structure pour le dimère (AH)2. Préciser en particulier
la nature des
liaisons.
6.7.2 - Exprimer les fractions molaires de AH et (AH)2 en fonction de la
fraction oc
d'acide dimérisé (quantité d'acide disparue pour une mole initiale).
6.7.3 - En reprenant les calculs effectués aux @ 6.4 et 6.5, calculer la valeur
de oc.
Expliquer comment passer du composé B au composé C en précisant les réactifs
utilisés.
Le composé C réagit avec l'acide nitreux, préparé dans le milieu réactionnel
par action d'un
acide fort sur le nitrite de sodium, pour donner un cation diazonium.
8.1--
Le diagramme simplifié E = f(pH) de l'azote, ne prenant en compte que les
espèces NO,
NO, et NO; , a l'allure suivante :
E(V)
Tournez la page S.V.P.
V 8.1.1 -- Montrer que l'acide nitreux HN02 se dismute dans l'eau pour tout pH
> 0.
8.1.2 - Calculer: EÊ(NOE /NO) ; EZ(NO; /NO;_) et EÊ(NOQ /NO).
8.1.3 - Indiquer, en reproduisant le diagramme sur votre copie, les domaines de
prépondérance des espèces.
8.2 - Comment est-il possible d'obtenir le composé D à partir du composé C ?
9 - Proposer une synthèse du composé E à partir du composé D, passant par un
organomagnésien
mixte et utilisant un réactif bien choisi. Donner le nom de ce réactif.
10 - Le composé F est transformé en chlorure d'acide correspondant F' par
action du chlorure de
thionyle SOC12. Quel catalyseur faut--il employer pour pasSer de F' au composé
G ? Proposer
un mécanisme pour cette réaction.
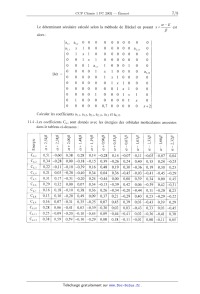
11 - Le composé F' est modélisé par la formule schématisée ci-après où la
numérotation des atomes,
différente de celle proposée habituellement, a été choisie pour des raisons de
commodité :
L'intégrale {"ça Êæjdv est notée <ç0i |H|çpj>.
L'intégrale " çaiçajdv est notée <ç0i la)). Le méthyle est considéré comme un hétéroatome à 2 électrons, l'orbitale atomique correspondante est notée @... (ou ç012), elle a la symétrie convenable pour donner un recouvrement avec l'orbitale atomique 2pZ du carbone 6, notée % (l'axe z'Oz étant perpendiculaire au plan de la molécule). L'atome d'oxygène possède également une orbitale atomique de symétrie 2pZ, notée (pl. Les intégrales suivantes ont les valeurs indiquées : ll.l -Rappeler les significations de a et de ,6 en théorie de Hückel. ll.2 -Rappeler les approximations de la théorie de Hückel. ll.3 -Chaque orbitale moléculaire \Pk est développée sur la base des orbitales atomiques @ selon 12 la relation : "Pk = ZCMÇ[Ji . i=l alors : 0000 0 0 0 0 0 1 0 0 al,] 0 0 0 0 0 a... 0 0 0 0 0000 0000 0001 000 1 355 &6,12 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Dét 0 0 0 0 x 0 0001 0 0,70000 x+2 0 CâlCUlEURf lEURS COEURffiC1EURÏIÎS 31_1, 81_2, 212_1, 32,11, 8575 EURt 36,12- 4 5 3 9 5 11 3 2 9 5 0 5 m......æè o., 2, 2, 2, 4, 3, 2, 2, 2, 4, 3, o, 7 4 0 5 0 2 0 9 9 3 1 1 %© ©"... | G 0: 29 3a A.., O» A..» 2» 7.3 a)» 0» 4» la ......ooooo............oo............ 3 5 9 l 4 9 l 3 3 3 6 00 % M... M..."... |. NU 09 11 11 43 39 39 119 23 43 39 39 07 11 0 6 3 9 6 4 0 3 3 2 l m...Îè i., 4, 3, o, 3, o, 4, 4, o, 4, o, 0, n_u0..._un_u00n_...oon_uon_U QR--© « © || 6 03 23 39 43 09 49 23 29 39 09 49 13 4 6 9 6 O 9 4 11 5 2 4 00 Qmmd+»o 1., 2., l., 3, 0, 3., 3., 2., 4, 0, 4, 1., 00 9 00 4 4 3 6 7 7 O 9 00 äÊ+e 2, 3, 4, 0, 4, i, 2, 3, o., 3, o., o, 4 5 6 4 4 4 6 9 5 9 5 9 @@ _ n_ + 6 19 19 19 3; 23 Av)? "'J? 07 23 39 49 29 8 oo 9 0 0 7 00 9 5 3 0 0 Qoe Y + @ 2: la a): 43 23 03 39 49 a): 0 la la 00 O O 0 11 O O 0 1 1 O 9 %d @@ + 6 3» 0: l., 2» 3» 0» l» 2» 3., A.., 2, 59 oo..._Ï_Ï_...on_Ï_......_ËÏ...O 0 00 l 3 7 2 00 O 7 6 9 9 Qoemd+d 6» 2» l., 0, 1» 3, 1» 1 0 0 0» 5 l 4 2 1 11 6 3 6 00 .\J 00 3...d+e 5, 3, 2, 2, 3, 2, i, 1, i, 2, 2, 3, 0 AU 0 0 O O O O 0 0 0 0 m 1. 2. 3_ 4. s... 6., 7. 8 9. H H... 2299 k k k ...." k k k k k : ,. a . ......CCCCCCCCCCCrQ dans le tableau ei-dessous : 10 11.4 -Les coefficients C... sont donnés avec les énergies des orbitales moléculaires associées k Tournez la page S.V.P. 11.4.1 - Sur quel(s) site(s) de la molécule F ' devrait se faire une substitution électrophile aromatique sous contrôle cinétique ? Justifier la réponse. 11.4.2 -- Comment expliquer alors l'obtention du composé G '? 12 -- Obtention du composé J. 12.1 Justifier la mobilité de l'hydrogène porté par le carbone du cycle lié au groupe --COZC2H5 du composé 1. 12.2 -Proposer une synthèse pour l'obtention du composé J. 13 - Le composé J est transformé en composé K par une réaction de Wittig. Indiquer la suite de réactions à effectuer en partant de J et du 2-chloroacétate d'éthyle Cl--CHz--COZCZH5. Quelle particularité possède le spectre R... du composé K que ne possède pas celui du composé J '? 14 -- Le composé L est cyclisé en composé M en milieu basique. Proposer un mécanisme pour cette cyclisation. lS-Proposer une méthode pour remplacer dans le composé M le groupe --C02C2H5 par un hydrogène. 16 - Combien de stéréoisomères possède l'équilénine '? Fin de l'énoncé
