e3a Physique et Chimie MP 2007
| Thème de l'épreuve | Physique des colloïdes métalliques. Chimie de l'argent et effet photochrome. |
| Principaux outils utilisés | thermodynamique, électrostatique, cristallographie, diagrammes d'Ellingham, thermochimie, cinétique |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
& 3 a
CONCOURS ENSAM - ESTP - ARCHIMEDE
Épreuve de Physique - Chimie MP
durée 4 heures
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, d'une
part il le signale au chef de salle, d'autre part il le signale sur sa copie et
poursuit sa composition
en indiquant les raisons des initiatives qu 'il est amené à prendre.
L'usage de la calculatrice est autorisé
9
)w-
>:fl5
. [_ 4
20JK
............
e 3 a
CONCOURS ENSAM - ESTP - ARCHIMEDE
Épreuve de Physique - Chimie MP
durée 4 heures
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, d'une
part il le signale au chef de salle, d'autre part il le signale sur sa copre et
poursurt sa composrtron
en indiquant les raisons des initiatives qu 'il est amené à prendre.
___--___--
L'usage de la calculatrice est autorisé
Ce problème comporte deux parties totalement indépendantes. La première
partie traite de la physique des colloïdes et aborde quelques notions relatives
à
leurs caractéristiques physiques en milieu ionisé. La seconde partie est
consacrée à
une étude de la chimie de l'argent. Ce métal, dispersé sous forme collo'idale
dans
une matrice de verre, est à l'origine de l'effet photochrome consistant en une
colo-
ration du verre lorsque celui-ci est soumis à un rayonnement visible.
Remargues préliminaires importantes : il est rappelé aux candidat(e)s que :
> Les explications des phénomènes étudiés interviennent dans la notation au même
titre que les calculs ; les résultats exprimés sans unité ne seront pas
comptabilisés.
> Dans tous les calculs, les gaz sont assimilés à des gaz parfaits (leurs
pressions par--
tielles sont notées en caractères italiques). Les indices suivants : (s)
solide, (qu) li--
guide, (9) gaz seront utilisés.
> Les données d'ordre général ainsi que les données thermodynamiques sont
réperto-
riées à la fin de l'énoncé. Un formulaire sur les fonctions hyperboliques est
égale-
ment fourni.
Les colloïdes sont de petites particules solides ou liquides, de géométrie
sphérique,
dispersées dans un milieu support. Les dimensions caractéristiques de ces
particules sont
de l'ordre du micromètre, à mi--chemin entre les échelles macroscopique et
atomique. Dans
la première partie, le support est un liquide.
Les colloïdes servaient dès le Moyen--Âge pour la coloration des verres mais
les étu-
des sur ces systèmes n'ont réellement débuté que dans la deuxième moitié du dix-
neuvième siècle avec les travaux de Faraday, Graham et Selmi. Ces chercheurs se
sont
plus particulièrement intéressés aux précipitations obtenues par adjonction
d'ions dans des
solutions colloïdales, montrant l'importance des phénomènes électriques dans la
configura-
tion de ces systèmes.
Tournez la page S.V.P.
PREMIERE PARTIE:
PHYSIQUE DES COLLOIDES METALLIQUES
Les colloïdes, dotés de propriétés conductrices, portent des charges de surface
qui
leur assurent une stabilité remarquable en solution non ionique. Toutefois,
dans le cas de
solvants ion/sés, des ions de charge opposée aux charges de surface peuvent
s'agglomérer
autour des colloïdes produisant un effet d'écran. Dans leur mouvement aléatoire
au sein
du fluide, les colloïdes écrantés peuvent alors s'agréger en petits amas et
former un préci--
pité.
L'objet de cette partie est l'étude des propriétés électrostatiques des
colloïdes et des
phénomènes conduisant à l'apparition d'agrégats colloïdaux. Dans un souci de
simplification
qui ne remet pas en cause la portée des résultats, les propriétés électriques
des systèmes
sont assimilées à celles du vide. En outre, l'étude de la manière dont les
particules acquiè--
rent leur charge n'est pas abordée dans cette partie.
| I PRELIMINAIRE_S_
A. Calculs de capacités
Dans cette question, quelques résultats généraux concernant les condensateurs
sont établis. Les raisonnements sont menés dans le cadre de l'électrostatique.
A1 - Condensateur plan
Soit un condensateur plan représenté sur la figure 1. L'armature située en 2 = 0
porte une charge Q et est au potentiel V1, tandis que l'armature située en 2 =
a, portant une
charge -- Q, est au potentiel V2. Les charges sont uniformément réparties en
surface.
Soit 8 l'aire des surfaces planes en regard, le diamètre des armatures étant
supposé très
grand devant la distance a. Le potentiel électrique dans l'espace situé entre
les armatures
est décrit parla fonction V.
S
Figure 1
A1*e. Justifier que V n'est fonction que de z et donner l'équation
différentielle à laquelle
obéit V entre les armatures.
>
.;
=(-
U"
Résoudre cette équation en utilisant les conditions aux limites.
>
.».
x-
0
Que vaut le champ électrique entre les armatures ?
A1*d. En appliquant le théorème de Gauss, trouver une deuxième expression du
champ
électrique dans l'espace entre les armatures.
A1*e. Grâce aux deux expressions des champs obtenues et, après avoir défini la
capacité
d'un condensateur, exprimer la capacité C de ce condensateur plan.
A2 - Condensateur sphérique
Un condensateur sphérique est constitué de deux armatures sphériques concentri--
ques de rayons R1 et R2 (figure 2). L'armature de rayon R, ( respectivement RZ
) porte une
charge + Q ( respectivement -- Q ) et est au potentiel V1 ( respectivement V2
). Les charges
sont uniformément réparties en surface.
A2*a. De quelle variable dépend réellement le potentiel V entre les armatures ?
A2*b. Comment sont les lignes de champ entre ces armatures ?
A2*c. En suivant la même démarche qu'au Al , exprimer la capacité C' de ce
condensa-
teur.
A2*d. Dans le cas où R2 --R1 << R,, que devient l'expression de C' '? Peut--on faire un rap- prochement avec le résultat du Al et, si oui, pourquoi ? B. Etude thermodznamique dela charge d'un condensateur Soit un condensateur plan, de capacité C et de volume constant, identique à celui de la question 51 . Il appartient à un circuit (non précisé) dans lequel il se trouve placé en série avec un interrupteur ( K ). Un opérateur peut, à sa guise, fermer ( K ) un court instant trans- férant ainsi une charge dq sur l'une de ses armatures. Dans cette question, lorsque ( K ) est fermé, le condensateur est supposé soumis a une tension constante Vo. B1*a. Donner l'expression du travail élémentaire reçu par le condensateur, noté ôWe, lors- que, sous une tension Vo, sa charge varie de dq. B1*b. La température du système est notée T et la transformation envisagée est supposée isotherme. En appliquant le premier et le deuxième principe de la thermodynamique au système lors de cette transformation élémentaire, montrer que : dU -- Vodq _<_ TdS , où U désigne l'énergie interne et S l'entropie du système. B1*c. La fonction caractéristique G* est définie par : G* = U -- TS -- qV0 . Justifier que l'évolution précédente s'accompagne d'une diminution de G*. Soit une évolution réversible isotherme au cours de laquelle la tension V aux bornes du condensateur de capacité C passe progressivement de 0 à une valeur Vo. Pour celà, un générateur de tension continue réglable est utilisé et la force électromotrice délivrée est ajustée en permanence à la tension V. Il est alors possible d'utiliser la fonction d'état « en- thalpie libre généralisée » G = U -7'S - qV où U, S sont des fonctions d'état et T, V des variables d'état du condensateur. 1 ê_2_._ En supposant que G = 0 quand V = O, montrer que : G(VO) : -------2--CV02. Tournez la page S.V.P. 4 II [ ELECTROSTATIQUE D'UN COLLOÏDE DANS UN SOLVANT IONIS_E_ Cette sous--partie est consacrée à l'étude du potentiel électrique et de la densité vo- lumique de charge électrique au voisinage d'un oolloïde. Cette dernière résulte du compor- tement des ions du solvant dans son environnement proche. Par souci de simplicité, un modèle unidimensionnel est adopté afin de décrire les phénomènes et proximité des interfaces. Ainsi, la surface du col/aide est assimilée à un plan infini ( plan yOz) portant une densité surfacique uniforme de charge 0 positive (figure 3). Le col/aide occupe, dans ce modèle idéal, le demi--espace x < 0. Quant à la solution ionisée, elle s'étend dans le demi--espace x > 0. Les propriétés électriques du
solvant sont
assimilées à celles du vide.
colloïde solvant
F@uoe3
C. Modèle étudié
Cl -- Le collo'ide, un conducteur électrique parfait
C1*a. Que signifie cette propriété ?
C1*b. En déduire que le champ électrique est nul dans le oolloïde.
C1* Expliquer pourquoi, si le collo'ide est chargé, sa charge se répartit à sa
surface.
C1*d. Quelle est la valeur du champ électrique Ê(x=o+) , en x : 0+ ?
?
CZ - Electrostatique du solvant
Le solvant contient des ions positifs et négatifs de charges respectives + Ze
et -- Ze.
( Z définit la valence de l'ion ). De plus, la solution est à l'équilibre
thermique, à la tempéra-
ture T. A l'abscisse x, où le potentiel électrique vaut V(x), le nombre n
d'ions par unité de
volume est donné par la loi de Boltzmann :
Ze v (x) -Ze V (X)
et n(--Ze) = noexp -
kT kT
Il est admis que V(x) --+ 0 quand x --+ +00 et que le potentiel vaut V0 en x =
0, à la surface
du oolloïde.
n(Ze) = noexp[-
C2*a. A partir de l'équation de Poisson de l'électrostatique, établir
l'équation différentielle
entre le potentiel V(x) et la densité volumique de charge p(X) .
Ze v(x)]_
C2*b. Montrer par ailleurs que : p(X) : --2n0 Ze sh[
C2*c. En déduire l'équation différentielle (ED) vérifiée par V(x).
D. Les solutions
D1 -- Cas simplifié Supposons que 0 < Vo << % . D1*a. Simplifier l'expression de p(x) et résoudre l'équation différentielle vérifiée par V(x). Exprimer ensuite le champ électrique dans le solvant, en introduisant, dans le résul- 1 eOkT Ze 2n0 ' Préciser la dimension de £_et donner sa signification physique. tat, la quantité : &: D1*b. Montrer que dans ce cas, la relation entre Vo et 0 est la même que pour un conden- sateur plan d'épaisseur à préciser. D1*c. Application numérique : Considérons une solution d'ions monovalents de concentra- tion 0,01 mol.L", à la température de 300 K. Calculer & et discuter de certaines hypothèses simplificatrices faites dans cette partie sachant que le colloïde est, en réalité, une sphère de rayon 1 pm. Certains potentiels de surface atteignent plusieurs dizaines de millivolts. Commenter. D1*d. Au terme de cette question, commenter le phénomène d'effet d'écran mentionné dans l'introduction de cette partie. D2 - Cas général Comme le suggère la dernière valeur numérique proposée, la Iinéarisation effectuée en C2 n'est pas toujours valable. II faut alors résoudre l'équation (ED) sans simplification. 2 D2*a. Exprimer la quantité %--Ë en fonction du champ E et de sa dérivée ä--ë. x 2 Z DZ*b. Montrer que: EdE= n° esh[--Z--Êf\{-]dv. En déduire l'expression de E en fonction 50 de V, en supposant le champ électrique nul à l'infini. D2*c. Déterminer la densité surfacique de charge 0 en fonction de V0, no, Z, T et des diffé-- rentes constantes du problème. D2*d. Application numérique: Calculer 0 pour V0 = 100 mV dans le cas de colloïdes en équilibre à 300 K dans la même solution qu'au D1*c. Un calcul (non demandé) conduit à l'expression suivante du potentiel V(x) : V (x) : %%Argth {th[îîà{° ]exp[---ÊH. La quantité & a été introduite àla question D1*a. DZ*e. Dans quelle mesure ce résultat est-il conforme aux calculs de la question D1*a ? E. Aspects thermodznamîgues Le système de la question précédente est caractérisé par sa température d'équilibre T et, du point de vue électrique, soit parle potentiel de surface du colloïde Vo, soit par sa charge. La fonction thermodynamique utilisée est I'enthaIpie libre par unité de surface g. _E_1_. Justifier, en s'aidant des résultats établis dans les préliminaires ( l--B ) que, pour une transformation isotherme : VO g(T,VO) = --fo(T,V)dV. (on suppose g(T,O) = O) o Tournez la page S.V.P. ZeV . . E_2._ Montrer que : g(T,VO)= ----16nO kT&sh2[--z--kî°--] et discuter cette expressron lorsque |eVo|<< kT. Commenter cette limite en référence aux résultats obtenus pour un condensateur. Ill I CONDITIONS DE L'AGREGATIONPE COLLOÏDES Les critères d'agrégation entre colloïdes sont de nature énergétique. II faut, en effet, comme dans tout système stable, que la configuration énergétique des colloïdes agrégés soit plus favorable que celle où les colloïdes sont dispersés en solution. Sans l'effet d'écran dû aux ions du solvant, il est clair que la répulsion électrique des colloïdes empêcherait la formation de ces amas. Pour calculer l'énergie d'interaction entre deux colloïdes sphériques identiques, de rayons r et dont les centres sont distants de D (figure 4), utilisons à nouveau un modèle unidimensionnel : soit deux surfaces planes, distantes de L, en regard portant la même densité surfacique de charge 0 et au même potentiel Vo (figure 5). O' 4 D - colloïde ( 1) solvant colloïde (2) 0 ;X Figure 4 Figure 5 modèle F. Energie du système F1 - Validité du modèle F1*a. Exprimer L en fonction des paramètres géométriques introduits dans cette partie. A quelle condition sur la géométrie du système ce modèle unidimensionnel est--il valable ? En procédant comme à la partie Il, obtenir l'équation différentielle vérifiée par V(x). " .; :r-- 5' " _\ :|- 0 " 1*d. Que vaut le champ électrique entre les deux surfaces en x = L/2 ? Ze V (x) ---ch Ze Vm kT kT où E est une constante à déterminer en fonction de no, T, k et so . F1*e. Sachant que V[x=--Ë]=V..., montrer que: E(x)=E1 ch F1*f. Ecrire la relation entre 0, Vo et V.... F2 -- Energie électrique d'interaction A la température T, une première contribution à la densité sufiacique d'énergie élec-- trique d'interaction WR entre les deux colloïdes est définie parla différence entre l'enthalpie libre du système étudié et l'entha/pie qu'il aurait si les deux colloïdes étaient infiniment éloi-- VO gnés l'un de l'autre : wR : --2f [o(V) -- 000 (V)]dV. 000 (V0) correspond à la densité surfa- o 7 cique de charge obtenue à la question D2*c. Des calculs (non demandés ici) conduisent à : wR =--Ê--exp[--£]. (avecB > O)
& &
F2*a. Commenter l'expression de WR.
Si les colloïdes sont suffisamment proches l'un de l'autre, il est légitime de
tenir
compte d'une autre contribution à l'énergie d'interaction de surface entre les
deux colloïdes
valant, pour le modéle unidimensionnel : WA : ----ê--. (A est une constante)
L2
F2*b. Donner, en le justifiant, le signe de A.
G. Critère d'agrégation
L'énergie surfacique w qui gouverne l'évolution et l'équilibre de ces deux
colloïdes
est donc la somme des deux contributions précédentes. Pour comprendre si les
colloïdes
peuvent s'agréger, il est important d'étudier l'évolution de w en fonction de
L. L'expression
de l'énergie surfacique, W(L) : Ëexp[--Ë] ------Ê--, est admise.
Gl - Etude graphique
En introduisant la variable réduite r... = '--'--, l'étude de la fonction
précédente se ra--
mène donc à celle de : y(næ) : exp(--uæ) -- --Ê----%.
%
G1*a. Préciser les limites de y quand |<, tend vers 0 puis vers l'infini. En fonction du paramètre --â--, la fonction étudiée posséde différents comportements comme le montre la figure 6 : W courbe 1 b 2 0 _//æ cour a _________________________ L ll # _ ," courbe 3 _Q_F' ure 6 l | La courbe (2) est obtenue pour une valeur critique du paramètre --â-- notée [EUR] . La c courbe ( 1 ) correspond a une situation pour laquelle EUR-- < -'--ê--] , tandis que la courbe (3) c s'obtient pour -/-\- > [£] .
B B o
G1*b. En utilisant le comportement caractéristique de la courbe (2), déterminer
la valeur
.. [AJ
cntnque --- .
B o
Tournez la page S.V.P.
GZ -- Condition d'agrégation
GZ*a. Quelle conséquence peut--on tirer de l'analyse de ce réseau de courbes
concernant
la possibilité d'existence ou non du phénomène d'agrégation au sein de la
solution
colloïdale ?
GZ*b. Quel commentaire suggère la valeur prise par w quand L tend vers 0 ? Le
modèle
est-il toujours valable ?
DEUXIEME PARTIE:
CHIMIE DE L'ARGENT ET EFFET PHOTOCHROME
Cette deuxième partie débute par une étude élémentaire de la chimie de l'argent,
puis elle débouche sur une application de l'argent introduit sous forme
colloi'dale dans une
matrice de verre et l'utilisation de l'effet photochrome en optique.
| I STRUCTURE ET METALLURGIE DE L'ARGENT
A. Structure
L'argent métallique cristallise dans un système compact cubique à faces centrées
(CFC). Le paramètre dela mai/Ie est noté a tandis que le rayon de l'atome,
supposé sphéri--
que, est noté R.
AL Représenter soigneusement une maille de ce réseau CFC.
A2. A l'aide des données numériques fournies en fin de problème, calculer
numérique--
ment le paramètre de la maille de ce réseau CFC.
A3. Calculer numériquement la valeur de la masse volumique p de l'argent
métallique.
B. Métallurgie de l'argent
L'argent à l'état natif ne constitue pas une source importante de ce métal.
Près dela
moitié dela production mondiale d'argent provient de gisements argentife'res de
plomb et de
zinc. Au cours de l'élaboration industrielle de l'argent, le minerai est broyé
puis enrichi.
L'élimination du zinc s'effectue par distillation autour de 1500 K et l'argent
et le plomb res--
tants sont séparés au cours d'une ultime étape appelée coupe/lation. Celle-ci
consiste à
oxyder le mélange fondu plomb -- argent à une température de 1373 K.
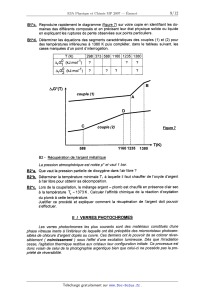
Afin d'étudier la coupe/lation, les diagrammes d'El/ingham relatifs aux couples
ci--
dessous sont représentés sur la figure 7 :
. couple (1) : AgZO/Ag.
. couple (2) : PbO / Pb.
Ces diagrammes ont été construits avec des équations d'oxydation écrites avec un
coefficient stoechiométrique égal à un pour le dioxygène.
B1 - Lecture du diagramme
B1*a. Rappeler ce que signifie l'approximation d'Ellingham.
B1*b. Ecrire les réactions d'oxydation pour les couples étudiés.
9
B1*c. Reproduire rapidement le diagramme (figure 7) sur votre copie en
identifiant les do-
maines des différents composés et en précisant leur état physique solide ou
liquide
en expliquant les ruptures de pente observées aux points particuliers.
B1*d. Déterminer les équations des segments caractéristiques des couples (1) et
(2) pour
des températures inférieures à 1380 K puis compléter, dans le tableau suivant,
les
cases marquées d'un point d'interrogation.
T K
Arc? (kJ.mol'1)
ArGg (kJ.mol'1)
A,G°(T)
Figure 7
; : : : W...
588 11601235 1380
82 - Récupération de l'argent métalligue
La pression atmosphérique est notée p° et vaut 1 bar.
BZ*a. Que vaut la pression partielle de dioxygéne dans l'air libre ?
BZ*b. Déterminer la température minimale T1 à laquelle il faut chauffer de
l'oxyde d'argent
à l'air libre pour obtenir sa décomposition.
BZ*c. Lors de la coupellation, le mélange argent -- plomb est chauffé en
présence d'air sec
à la température T2 : 1373 K. Calculer l'affinité chimique de la réaction
d'oxydation
du plomb à cette température.
Justifier ce procédé et expliquer comment la récupération de l'argent doit
pouvoir
s'effectuer.
II I VERRES PHOTOCHROMES
Les verres photochromes les plus courants sont des matériaux constitués d'une
phase vitreuse inerte à l'intérieur de laquelle ont été précipités des
microcristaux photosen--
sibIes de chlorure d'argent dopés au cuivre. Ces derniers ont le pouvoir de se
colorer réver--
siblement ( noircissement ) sous l'effet d'une excitation lumineuse. Dès que
l'irradiation
cesse, l'agitation thermique restitue aux cristaux leur configuration initiale.
Ce processus est
donc voisin de celui de la photographie argentique bien que celui--ci ne
possède pas la pro--
priété de réversibilité.
Tournez la page S.V.P.
10
hu
Le phénomène est décrit parle bilan suivant : Ag+ + Cu+ Î Ag + Cu2+ .
La coloration des verres photochromes n'est pas instantanée, de même que le re--
tour a la transparence originale (blanchiment ). Pour la phase de blanchiment,
et notam-
ment son aspect cinétique, les ions cuivre jouent un rôle central. Lorsque le
verre photo-
chrome est exposé à une illumination (figure 8), le cuivre est entièrement sous
sa forme
Cu". Lorsque cesse l'illumination, le cuivre revient à son nombre d'oxydation
+1 créant un
défaut de charge négative. Les colloïdes d'argent Ag captent alors ce défaut de
charge né--
gative pour revenir à l'état Ag" redonnant ainsi un aspect transparent initial
au verre.
Dans le modèle proposé pour l'étude cinétique, le défaut de charge négative est
symbolisé par q+ mais il n'intervient pas explicitement dans l'écriture des
lois dela cinétique.
Figure 8
retour à l'équilibre
Le noircissement est dû àla formation de colloïdes d'argent en surface des
microcristaux.
C. Le cristal de chlorure d'argent
Le cristal parfait de chlorure d'argent posséde une structure de type NaCl.
C1*a. Décrire cette structure.
, , . +
1*b. Representer cette structure sur la base du sous--reseau des lOflS Ag .
Ô
C1*c. Sachant que le rayon des ions chlorure est de 180 pm, que la paramètre de
la maille
vaut a = 555 pm et que le contact des ions s'effectue sur l'arête de la maille,
en dé--
duire le rayon des ions Ag+ dans cette structure.
Les microcristaux de chlorure d'argent ne sont pas parfaits et il existe
principalement
deux types de défauts :
- les défauts dus a un désordre thermodynamique correspondant à la migration des
ions Ag+ du réseau vers des sites interstitiels avec l'apparition d'une lacune,
notée V,
sur le réseau. Forme/lement, la création de ces défauts est symbolisée par
l'équilibre
(E) : Ag" = Ag Ï+ VAg, où Ag Ïdésigne les ions argent occupant les sites in-
terstitiels et VAg les lacunes laissées sur le réseau. L'entité {Ag Ï,VAg}
modélise la
formation d'un de ces défauts.
- les défauts dus àla présence d'agents dopants tels que les ions cuivre.
C2*a. Quel type de site interstitiel présente la structure idéale du cristal de
chlorure
d'argent?
C2*b. Combien une maille d'arête a comporte--t--elle de sites interstitiels ?
11
Le nombre moyen de défauts dans un microcristal obéit à la relation suivante :
AfG°E (T)
R T
associées à cet équilibre valent, a 298 K, respectivement 140 kJ.mol' et 90 J.K
1.mol 1.
n2 : nâ exp[-- ], où no =10" par microcristal. L'enthalpie et l'entropie
standard
C2*c. Calculer le nombre moyen de défauts dans un microcristal à 298 K.
Comparer cette
valeur avec celle, proche de l'unité, qui est obtenue dans le cas de la
photographie
argentique.
C2*d. Quelle est l'influence d'une élévation de température sur ce nombre ?
Commenter.
D. Aspects cinétiques
Elément central dans le contrôle cinétique du processus, l'agent dopant cuivre
s'associe aux lacunes évoquées précédemment dans deux configurations
géométriques
différentes de maille, que nous noterons Cu"(A ) et Cu"(B).
Le mécanisme de blanchiment est décrit par les actes élémentaires suivants :
Cu2+ (A)----'£'--Ï-ÎÎ'Î--ë--1---->Cu2+(B)--'ËtËKÊZÊË--9Cu+ + q+ Processus (ou)
Cu2+ (A)-----'ÎÏ-ËîîË---->Cu+ + q+ Processus ( B )
k,, k2, k3 sont les constantes des vitesses de ces réactions ; seules les
espèces Cu'",
Cu"(A) et Cu"(B) interviennent dans les lois de la cinétique.
Pl: Etablir le système différentiel couplé donnant l'évolution temporelle des
concentra--
tions en Cu"(A), Cu2+(B) et Cu'.
Q_2_= Justifier que la concentration totale en Cu2+ obéit à une loi d'évolution
de la forme :
2+ |
[Cu ]tot : D exp(--[k1 + k3]t) + D exp(--k2t) .
(D et D' sont des constantes qu'il est inutile de chercher à déterminer. Pour
un calcul
plus complet, il serait nécessaire de préciser que k2 : k, + k3 )
Une étude expérimentale pour étudier l'influence de la température sur cette
cinéti--
que est résumée sur la figure 9 :
_ 2,9 figure 9
- 3,2
- 3,4
- 3,6
!
L------------l--------------------+----WM--w------w------>
1 IT
D3*a. Rappeler la loi d'Arrhenius.
DS*b. Les résultats de l'étude expérimentale sont-ils conformes à cette loi ?
Tournez la page S.V.P.
12
D3*c. En admettant que les énergies d'activation E... et EA3 sont sensiblement
égales, dé-
terminer les valeurs numériques des énergies d'activation associées à chacune
des
étapes du mécanisme proposé.
D3*d. Donner un ordre de grandeur du délai de blanchiment des verres à une
température
de 300 K et commenter ce résultat.
DONNEES
Pression standard : p° = 1 bar
Composition de l'air : 20% Oz et 80% N2 (pourcentages molaires)
Constantes :
Charge élémentaire : e : 1,6.10'19 C
Constante de Boltzmann : k =1,38.10'23 J.K'1
Constante d'Avogadro : e/i,4 : 6,02.1023 mol"1
Constante molaire des gaz parfaits : R = 8,314 J.mol'1.K'1
Permittivité diélectrique du vide : 80 = 8,84.10'12 F.m'1
Elément argent :
Numéro atomique : Z = 47
Masse molaire : M = 107,9 g.mol'1
Rayon métallique : R.... = 144 pm
Rappel sur les fonctions hyperboliques :
ch2 (x) --- sh2 (x) =1
ch(2x)=1+2 sh2 (x) = 2 ch2 (x)--1
2 th(x)
1------ th2 (x)
[ch(x) dx : sh(x) et jsh(x)dx : ch(x) , à une constante additive près.
sh(2x) : 2 sh(x)ch(x) :
Expression du Iaplacien scalaire :
2 2
en coordonnées cylindriques : AV == Î__Y_[ÊY_] --1--ê--\2--/-- Ê--\2--/-
rôr âr r2 39 32
, .. 1 @ 23V 1 @ sineav 1 azv
en coordonnees s hen ues: AV=------ r ---- ---- ----------------- + ------------
p q r2 Ôl'[ Ôf]+FSÏHÔÔÔ[ r 39] r23in296@2
Grandeurs thermodynamiques :
Lf,...(kJ.mol'1) Densité T...S(K)
A,H°(kJ.mol") S°(J.K'1.mol'1)
235
380
588
160
42,5 11,3
121,3
64,8
66,5
205,0
-31,1
51
-219,1 11,7
__(O 50
01 \I
O 01
%» .???
.::--" Om
FIN DE L'EPREUVE
