A2019 --- CHIMIE MP
Cm
Concours commun
Mines-Ponts
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT Atlantique, ENSAE PARISTECH,
CHIMIE PARISTECH.
Concours Centrale-Supélec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVEP.
CONCOURS 2019
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 1 heure 30 minutes
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - MP
L'énoncé de cette épreuve comporte 7 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
À 2019 CHIMIE MP
DEBUT DE L'ENONCE
Les batteries lithium-soufre
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
La technologie des batteries rechargeables est en constante évolution pour
répondre à des
exigences de plus en plus fortes en termes de densité d'énergie, vitesse de
recharge, limitation
de l'auto-décharge, durabilité et sécurité. Ces exigences parfois
contradictoires poussent à
leur limite certains matériaux qui subissent des transformations importantes
lors des cycles,
sans oublier l'échauffement important qui peut se produire. Parmi les multiples
systèmes
prometteurs étudiés par la communauté scientifique, les batteries
lithium-soufre ont attiré une
attention particulière ces dernières années en raison d'une densité d'énergie
théorique
beaucoup plus élevée que celle des batteries Li-ion classiques et d'un coût
plus faible, le
soufre étant bon marché.
1- Etablir la configuration électronique de l'atome de soufre dans l'état
fondamental. Quel
anion peut-il former ?
La structure cristallographique de la phase stable du soufre à température et
pression
ambiantes est orthorhombique, la maille élémentaire est un parallélépipède
rectangle de
paramètres a=1,0 nm, b=1,3 nm et c--2,4 nm. La maille élémentaire contient 16
unités S,. La
masse volumique de cette phase est d'environ 2,1 g. cm".
2- Déterminer k.
De façon schématique, les batteries lithium-soufre sont constituées d'une anode
de lithium,
d'une cathode de soufre élémentaire (dispersé dans du carbone conducteur) et
d'un
électrolyte organique permettant le transfert des ions Li jusqu'à la cathode où
ils précipitent
avec les sulfures résultant de la réduction du soufre.
3- Ecrire l'équation de la réaction de décharge et calculer la tension standard
en circuit
ouvert de la batterie à 298 K. Commenter sachant que la tension nominale de
batteries Li-1on
est de l'ordre de 3.6 V.
4- Calculer la capacité spécifique théorique (en Ah.g') du matériau de cathode.
Comparer avec des matériaux typiques de cathode de batteries Li-ion dont la
capacité
spécifique théorique est de l'ordre de 300 mAh.g".
5- En supposant le lithium et le soufre en proportions stoechiométriques,
évaluer la
variation relative du volume total des phases solides entre l'état totalement
chargé et l'état
totalement déchargé. Commenter brièvement ce résultat.
Page 1/7
Chimie 2019 - Filière MP
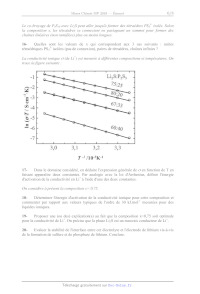
La courbe de la première décharge de la batterie a l'allure suivante :
tension /V
N
N
LS
N
O
i
+
0 0,5 1,0 1,5
nombre d'électrons échangés par atome de soufre
1,8
6- Quelle fraction de la capacité spécifique théorique récupère-t-on ?
En réalité, le soufre ne se réduit pas directement sous forme de sulfure simple
mais de
polysulfures Si", avec 21.
Différentes stratégies sont envisagées pour résoudre le problème dû à la
navette des
polysulfures. Les électrolytes solides constituent l'approche la plus radicale.
Ils présentent
également l'avantage d'éviter les problèmes de sécurité des électrolytes
organiques
potentiellement inflammables, mais au prix d'une conductivité de Li" plus
faible. Parmi ces
électrolytes solides, les verres de formule générale (Li2S),(P25S;)1. avec
0,6