Mines Chimie MP 2017
| Thème de l'épreuve | Autour du silicium |
| Principaux outils utilisés | cristallographie, diagrammes E-pH, oxydoréduction, thermodynamique |
| Mots clefs | silicium, silice, batterie air-silicium, électrodéposition, liquide ionique, sels fondus |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
A2017 CHIMIE MP
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT Atlantique (ex Télécom Bretagne),
ENSAE PARISTECH.
Concours Centrale-Supelec (Cycle International),
Concours Mines-Télécom, Concours Commun TPE/EIVP.
CONCOURS 2017
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 1 heure 30 minutes
L'usage de la calculatrice et de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - MP
L'énoncé de cette épreuve comporte 6 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant
les
raisons des initiatives qu'il est amené à prendre.
A 2017 CHIMIE MP
DEBUT DE L'ENONCE
Autour du silicium
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
Le silicium (Si) est l'élément situé à la 3ème ligne et 14ème colonne de la
classification
périodique à 18 colonnes.
A) Structure électronique-cristallographie
1Etablir la configuration électronique de l'atome de silicium dans son état
fondamental
en rappelant les règles appliquées. Quel est le nombre d'électrons de valence
du silicium ?
Certaines molécules à base de silicium peuvent être hypervalentes, c'est-à-dire
que leur
valence est supérieure à celle attendue. C'est le cas par exemple de [SiF5] et
[SiF6]2 .
2-
Donner la représentation de Lewis de ces 2 molécules.
Le silicium cristallise selon la structure diamant rappelée ci-après. Les
atomes sont disposés
en structure cubique à faces centrées avec occupation d'un site tétraédrique
sur deux. Dans la
représentation les nuances de gris traduisent un effet de relief, les atomes
les plus en avant
étant les plus foncés.
3Rappeler la définition de la coordinence et la donner dans cette structure.
Donner le
nombre d'atomes dans la maille représentée.
4-
Calculer la valeur du paramètre de maille en expliquant la méthode.
5-
Calculer la masse volumique du silicium.
Page 1/6
Chimie 2017 - Filière MP
B) Diagramme potentiel-pH.
On donne ci-après le diagramme potentiel-pH du système silicium-eau à 298 K.
Les espèces
présentes sont Si(s), H4SiO4, H3SiO4 et H2SiO42 . Les coordonnées (pH; E/V) des
points
remarquables sont les suivantes:
D(0,0 ; -0,996 V) ; E(9,8 ; -1,584 V) ; F(13,1 ; -1,832 V) et G(14,0 ; -1,913 V)
#"
$"
%"
!"
6En justifiant la réponse, affecter à chaque domaine numéroté de 1 à 4 du
diagramme
l'espèce correspondante.
La droite (DE) a pour équation E = a + b.pH+ c.log(C2) , C2 correspondant à la
concentration de l'espèce 2.
7-
Déterminer les valeurs de a, b et c.
8-
Quelle est la concentration de tracé utilisée pour établir ce diagramme ?
9En justifiant la réponse, déterminer les pK des constantes d'acidité (qu'on
notera pKa1
et pKa2) des couples acido-basiques du système étudié.
10-
Calculer les pentes des droites (EF) et (FG).
Page 2/ 6
Chimie 2017 - Filière MP
C) Batterie air-silicium.
La batterie air-silicium fonctionne selon le schéma suivant:
67$82,9*'
:;'
('
!"#"$"%&'
)#*$+,-#.+*'
#"/%"0*'"-1"/%*'
$2,3-1*'4-,*%5'
L'électrolyte, un liquide ionique, est constitué d'un cation non précisé et de
2 anions: (HF)2F
-
-
et (HF)3F , qui seront les seuls anions à considérer dans l'écriture de
réactions.
11Ecrire les demi-équations à chaque électrode en prenant bien garde au fait
que le
milieu n'est pas aqueux.
12Ecrire l'équation de précipitation du solide formé dans l'électrolyte. En
déduire
l'équation globale de la pile.
La durée de vie de la pile est limitée par le fait que ce solide se dépose sur
la surface de
l'électrode de carbone poreux. Le schéma suivant représente ce dépôt dans des
conditions de
a) faible courant de décharge et b) de fort courant de décharge.
!"#$%&'%()"!('
!"#$%&'%()"!('
*+,-".&'
*+,-".
,-".
".&'
13Commenter les différences observées, à votre avis quel est le cas le plus
favorable
pour la durée de vie de la pile ? Justifier.
Page 3/6
Chimie 2017 - Filière MP
D) Electrodéposition de silicium en sels fondus
L'électrodéposition est une méthode envisageable pour produire du silicium
polycristallin
pour les cellules solaires. Elle peut se faire en sels fondus KF-KCl à haute
température
(923K) selon le schéma suivant:
!"#!$%&$'
()*+$%,-*'+&%#,.*'
On alimente le système en dissolvant SiCl4 pour former SiF62- qui se réduit à
la cathode.
14-
Quel est le gaz dégagé à l'anode ? Justifier.
On effectue une électrodéposition avec une densité de courant cathodique jc de
100 mA/cm2.
15Exprimer la vitesse de croissance de l'épaisseur de silicium déposé en
fonction de la
densité de courant et de la masse volumique du silicium, en supposant le
substrat plan et la
couche de silicium non poreuse. Faire l'application numérique en considérant
que le silicium
est de structure diamant.
E) Oxydation du silicium
L'oxydation en surface du silicium est une étape importante dans la réalisation
de circuits
intégrés au silicium en jouant notamment un rôle d'isolation électrique et de
passivation. Le
silicium peut être oxydé en présence de dioxygène selon la réaction:
Si(s) + O2(g) = SiO2(s)
16Evaluer et commenter l'ordre de grandeur de la constante d'équilibre à 298K
(qu'on
notera K°). Comment varie-t-elle avec la température ?
La loi cinétique de la croissance de l'épaisseur x de la couche de silice sur
une surface de
silicium exposée à une atmosphère contenant du dioxygène s'écrit:
x2 +Ax = Bt
Page 4/ 6
Chimie 2017 - Filière MP
17Montrer qu'on peut considérer qu'il existe deux régimes de croissance selon
l'épaisseur
de la couche et les interpréter qualitativement.
Le carbure de silicium SiC peut être obtenu par carboréduction de la silice.
Par analogie
avec les phénomènes de corrosion en milieu humide, on peut observer deux types
d'oxydation
de ce matériau: une oxydation passive et une oxydation active. Les équilibres
en jeu sont les
suivants:
(1) SiC(s)+O2(g) = SiO(g) + CO(g)
(2) SiC(s)+3/2 O2(g)= SiO2(s) +CO(g)
18-
Quelle réaction correspond à l'oxydation passive ? Justifier.
19Indiquer les deux paramètres principaux qui vont avoir un rôle déterminant
sur le
régime d'oxydation observé.
20Décrire le mode d'oxydation passif du carbure de silicium à l'aide d'un
schéma faisant
apparaître les interfaces et les flux de gaz.
Données :
Constante d'Avogadro : NA= 6,0.1023 mol-1.
Constante des gaz parfaits :R= 8,3 J.K-1.mol-1
Constante de Faraday : F= 96500 C.mol-1
RT
ln10 = 0,06V
Constante de Nernst à 298 K :
F
Rayon atomique du silicium: rSi =118 pm
M(Si)= 28g/mol
E°(H4SiO4(aq)/Si(s)) = -0,951 V à pH=0
Enthalpies standard de formation et entropies standard (à 298 K):
Si(s)
O2(g)
SiO2(s)
Approximations numériques :
Sm° (J.K-1.mol-1)
19
205
47
fH° (kJ.mol-1)
0
0
-904
2
10
7
3
7
4
Page 5/6
Chimie 2017 - Filière MP
2,5
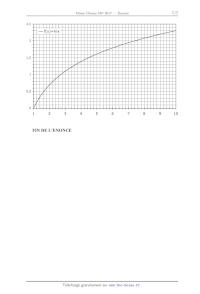
f(x)=lnx
2
1,5
1
0,5
0
1
2
3
4
5
FIN DE L'ENONCE
Page 6/ 6
6
7
8
9
10
