Mines Chimie MP 2016
| Thème de l'épreuve | Le béton |
| Principaux outils utilisés | cristallographie, solutions aqueuses, oxydoréduction, diagrammes E-pH, courbes courant-potentiel, thermodynamique |
| Mots clefs | béton, ciment, Tafel |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
A 2016 CHIMIE MP
École des PONTS ParisTech,
ISAE-SUPAERO, ENSTA ParisTech,
TÉLÉCOM ParisTech, MINES ParisTech,
MINES Saint-Etienne, MINES Nancy,
TÉLÉCOM Bretagne, ENSAE ParisTech (Filière MP)
CONCOURS 2016
EPREUVE DE CHIMIE
Filière : MP
Durée de l'épreuve : 1 heure 30 minutes
L'usage d'ordinateur ou de calculatrice est interdit.
Sujet mis à la disposition des concours :
Concours Commun TPE/EIVP, Concours Mines-Télécom, Concours Centrale-Supélec
(Cycle international)
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2016-Filière MP
Cet énoncé comporte 8 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il est invité à le
signaler sur sa copie et à poursuivre sa composition en expliquant les raisons
des initiatives qu'il aura
été amené à prendre.
DEBUT DE L'ENONCE
le béton
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
Ce problème s'intéresse à l'étude de quelques propriétés physico-chimiques du
ciment et des
bétons armés. Le clinker est le principal constituant d'un ciment, il est
obtenu à partir d'un
mélange de 80% de calcaire (CaCO3(s)) et de 20% d'argile (silicoaluminates). Le
ciment est
principalement utilisé pour fabriquer le béton qui est un mélange de ciment,
sable, granulats
et eau. Le béton forme après la « prise » une véritable roche artificielle. La
« prise » est le
phénomène de durcissement en présence d'eau.
Page 1/8
Tournez la page S.V.P.
Chimie 2016 - Filière MP
A) Prise d'un béton.
Le ciment est modélisé par la seule espèce [Ca3SiO5](s). La réaction à
l'origine de la
« prise » est volontairement simplifiée sous la forme suivante :
2 [Ca3SiO5](s) + 6 H2O (liq) = [Ca3Si2O7, 3H2O](s) + 3 Ca(OH)2(s)
(1)
On mélange rapidement m1=228 g de ciment et m2=90 g d'eau liquide dans un
calorimètre et
on place un dispositif de mesure de la température. On mesure une élévation de
la
température : !!"#$%&!.
1En supposant la réaction totale, indiquer quel est le réactif limitant et
calculer les
quantités de matière en chacune des espèces présentes en fin d'évolution.
2Le système constitué par le calorimètre et son contenu sont supposés en
évolution
adiabatique. Estimer la valeur de l'enthalpie standard de réaction !!
!!!associée à l'équationbilan (1). On négligera la capacité thermique du
calorimètre.
B) basicité d'un béton.
L'hydroxyde de calcium Ca(OH)2(s) confère à l'eau qui se trouve dans les pores
du béton
(solution interstitielle) un caractère fortement basique. On étudie une
solution aqueuse
recueillie à la surface du béton après la prise, modélisée par une solution
contenant des ions
Ca2+ et OH (compte tenu de la solubilité de l'hydroxyde de calcium). Le volume
prélevé est
-
égal à V0=100,0 mL, il est titré par une solution d'acide chlorhydrique
concentré (H3O+, Cl )
de concentration c=0,50 mol.L-1. Le titrage est suivi par conductimétrie
(mesure de la
conductivité ) de la solution titrée en fonction du volume v de titrant ajouté.
Le résultat
expérimental est présenté ci-après.
Page 2/ 8
Chimie 2016 - Filière MP
!#&$"
"*+,-.%
!#&"
!#%$"
!#%"
!#!$"
!"
!"
!#&"
!#'"
!#("
!#)"
%"
%#&"
%#'"
%#("
%#)"
&"
3-
/"*-0"
Ecrire la réaction de titrage et indiquer la valeur de sa constante d'équilibre
à 298 K.
4-
Quel est le pH de la solution prélevée à la surface du béton ?
5Justifier qualitativement (sans calcul) mais de façon détaillée l'allure de la
courbe
conductimétrique ! ! ! ! !obtenue.
6Calculer grâce aux données le rapport des pentes des deux droites et vérifier
le résultat
à l'aide du graphique.
7Dessiner l'allure de la courbe qui aurait été obtenue à l'occasion d'un suivi
pHmétrique, préciser la valeur du pH au point équivalent.
C) carbonatation d'un béton.
Le dioxyde de carbone présent dans l'atmosphère peut se dissoudre en solution
aqueuse.
Dans le cas des solutions basiques il se dissout sous forme d'ions carbonate
CO32-. Lorsque le
phénomène se produit sur un béton, les ions carbonate issus du dioxyde de
carbone peuvent
remplacer les ions HO de l'hydroxyde de calcium (formation de CaCO3(s)). On
parle alors
de carbonatation d'un béton, conduisant à une fragilisation de sa structure. On
étudie dans
cette partie le carbonate de calcium (de type calcite).
8Rappeler les règles générales permettant d'établir la configuration
électronique d'un
atome dans l'état fondamental et les appliquer à l'atome de calcium. Pourquoi
le calcium
forme-t-il des ions Ca2+ de façon privilégiée ?
Page 3/8
Tournez la page S.V.P.
Chimie 2016 - Filière MP
9Etablir, en justifiant rapidement, le diagramme de prédominance des espèces en
solution du carbone : H2CO3 (aq); HCO3 (aq); CO32-(aq). Justifier que dans le
cas du béton, le
dioxyde du carbone dissous en surface se trouve bien sous la forme de carbonate.
10A l'aide des données, montrer alors que la carbonatation du béton est
thermodynamiquement favorisée.
11En faisant une hypothèse simple qu'on justifiera, exprimer l'évolution du
produit de
solubilité de la calcite avec la température. La calcite est-elle plus soluble
à chaud ou à froid ?
12Retrouver par le calcul l'ordre de grandeur du produit de solubilité de la
calcite fourni
dans la table.
13Donner un exemple d'utilisation en chimie de la faible solubilité du
carbonate de
calcium par rapport à son hydroxyde.
14Donner un schéma de Lewis de l'ion carbonate. Cet ion possède-t-il un moment
dipolaire permanent ? Justifier.
15La masse volumique de la calcite est de 2,7.103 kg.m-3. Calculer son volume
formulaire (volume occupé par une unité de formule).
La structure cristallographique de l'hydroxyde de calcium (portlandite) peut
être décrite
comme un empilement de feuillets. Dans la figure suivante ne sont représentés
que les atomes
de calcium: ils dessinent un maillage hexagonal dans chaque feuillet. La
distance entre deux
atomes de calcium voisins dans un feuillet est de 0,36 nm et la distance entre
deux feuillets
voisins de 0,49nm.
16Calculer le volume formulaire de la portlandite. Comment se traduit sa
transformation
en calcite en termes de changement de volume ?
D) corrosion d'un béton armé.
Un béton armé contient des armatures internes en acier (alliage fer-carbone qui
sera
modélisé par le seul fer). Une éventuelle corrosion peut avoir lieu par
réaction entre
l'armature en fer et l'eau (ou avec le dioxygène dissous).
Page 4/ 8
Chimie 2016 - Filière MP
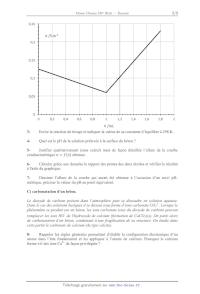
Le diagramme potentiel-pH du fer est donné (en traits gras), pour une
concentration de tracé
égale à 10-2 mol.L-1. Il fait intervenir les espèces Fe(s), Fe2+, Fe3+,
FeOOH(s) et Fe3O4(s).
Les traits pointillés correspondent au diagramme potentiel-pH de l'eau.
17-
Quels sont les degrés d'oxydation du fer dans les solides considérés ?
18Attribuer à chaque domaine du diagramme une espèce du fer. Expliquer le
raisonnement.
19Ecrire l'équation-bilan de la réaction concernant le fer métallique en
présence d'eau et
en absence de dioxygène dissous, dans un milieu fortement basique.
20On observe que dans un béton armé sain (non carbonaté) on risque peu la
corrosion
des armatures métalliques internes. Expliquer et nommer le phénomène ainsi
observé.
La carbonatation du béton est un phénomène susceptible d'initier la corrosion,
car il est
associé à une diminution du pH des solutions interstitielles. On étudie le
phénomène sur un
béton armé carbonaté. L'étude est menée à partir de courbes densité de
courant-potentiel. La
figure suivante représente les courbes relatives à l'oxydation du fer en ions
Fe2+ et à la
réduction de l'eau en dihydrogène.
Page 5/8
Tournez la page S.V.P.
Chimie 2016 - Filière MP
!$%&'(#
!"#
21Reproduire la figure et associer à chaque courbe le phénomène correspondant.
Justifier
notamment par l'écriture de demi-équations d'oxydoréduction. Faire figurer la
position du
potentiel de corrosion Ecor et de la densité de courant de corrosion jcor.
Les valeurs de potentiel mis en jeu dans les phénomènes de corrosion
correspondent souvent
au domaine de validité de l'approximation de Tafel : les courbes densité de
courant-potentiel
sont alors généralement des exponentielles et on a la relation ! ! !!! ! !! !"#
! .
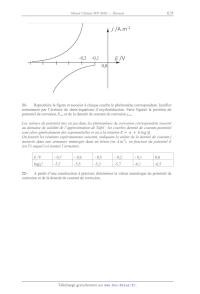
On fournit les résultats expérimentaux suivants, indiquant la valeur de la
densité de courant j
mesurée dans une armature immergée dans un béton (en A.m-2), en fonction du
potentiel E
(en V) auquel est soumis l'armature.
E /V
- 0,7
- 0,6
- 0,5
- 0,2
- 0,1
0,0
!"# !
-5,7
-5,5
-5,3
-5,7
-6,1
-6,5
22A partir d'une construction à préciser, déterminer la valeur numérique du
potentiel de
corrosion et de la densité de courant de corrosion.
Page 6/ 8
Chimie 2016 - Filière MP
Données :
Constante d'Avogadro : NA= 6,0.1023 mol-1.
Constante des gaz parfaits :R= 8,3 J.K-1.mol-1
Constante de Faraday : F= 96500 C.mol-1
RT
ln10 = 0,06V
Constante de Nernst à 298 K :
F
Numéros atomiques : 6 (C) ; 8 (O) ; 20 (Ca).
Masses molaires : Ca : 40 g.mol-1 ; Fe : 55 g.mol-1 ; Si : 28 g.mol-1
Masse volumique du fer : =8000 kg.m-3.
Capacités thermiques molaires à pression constante Cp,m (en J.K-1.mol-1) :
composé
Ca(OH)2(s)
[Ca3Si2O7, 3H2O](s)
H2O(liq)
Cp,m
80
340
75
0
Conductivités ioniques molaires (en mS.m2.mol-1)
Ion
H+(aq)
Cl-(aq)
HO-(aq)
0
35,0
7,6
19,8
Constantes d'acidité : pKa1 (CO2, H2O/ HCO3-) = 6,4 ; pKa2 (HCO3-/CO32-) = 10,4
Produit de solubilité : Ks(CaCO3)= 3.10-9, Ks(Ca(OH)2)= 5.10-6
Enthalpies standard de formation et entropies standard (à 298 K):
fH° (kJ.mol-1)
Sm° (J.K-1.mol-1)
Ca2+ (aq)
- 543
- 53
CaCO3 (s) (calcite)
- 1207
93
CO32- (aq)
- 677
- 57
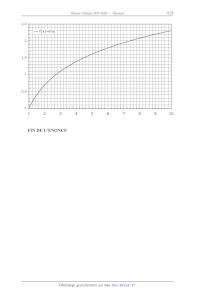
Approximations numériques :
2
10
7
Page 7/8
3
7
4
Tournez la page S.V.P.
Chimie 2016 - Filière MP
2,5
f(x)=lnx
2
1,5
1
0,5
0
1
2
3
4
5
FIN DE L'ENONCE
Page 8/ 8
6
7
8
9
10
