Mines Chimie MP 2015
| Thème de l'épreuve | Métallurgie du lithium |
| Principaux outils utilisés | cristallographie, solutions aqueuses, oxydoréduction, courbes courant-potentiel, thermodynamique |
| Mots clefs | lithium, pile, électrolyse |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
A 2015 Chimie MP
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIERE TSI)
CONCOURS D'ADMISSION 2015
EPREUVE DE CHIMIE
Filière : MP
Durée de l'épreuve : 1 heure 30 minutes
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis à la disposition des concours :
Cycle International, (FROHV GHV 0LQHV TELECOM INT, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2015-Filière MP
Cet énoncé comporte 6 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il est invité à le
signaler sur sa copie et à poursuivre sa composition en expliquant les raisons
des initiatives qu'il aura
été amené à prendre.
DEBUT DE L'ENONCE
Métallurgie du lithium
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
Le sujet vise à commenter et approfondir le contenu d'un article scientifique
concernant le
lithium et sa métallurgie.
Référence de l'article : BLAZY Pierre, JDID El-Aïd, « Métallurgie du lithium »,
Techniques
de l'ingénieur, 2011
Dans un souci de simplification, certaines parties de l'article ont été éludées
et certains
termes modifiés pour rendre les raccords intelligibles, sans que le contenu
scientifique ne soit
changé.
Les 3 parties du sujet sont indépendantes.
Page 1/6
Tournez la page S.V.P.
Chimie 2015 - Filière MP
A) Généralités
Document 1 : Extrait de l'article
« Le lithium a été découvert en 1817 par Johann August Arfvedson dans un
silicate
d'aluminium naturel : la pétalite. Jöns Jacob Berzelius donna au nouvel élément
le nom de
lithium (du grec lithos = pierre) pour rappeler son origine minérale.[...] Le
développement de
nouvelles applications du lithium dans les années 1970 à 1975 a relancé les
exploitations
minières en Australie, au Canada, au Zimbabwe et en Chine. [...].
Les propriétés atomiques du lithium sont les suivantes :
- rayon métallique, 155 pm ;
- rayon ionique de Li+, 60 pm.
L'énergie d'ionisation du lithium (5,39 eV) est plus élevée que celles des
autres métaux de sa
colonne et son potentiel d'électrode est relativement bas (! 3,02 V) [...].
Les propriétés physiques du métal sont les suivantes :
- masse atomique, 6,951 g.mol-1 ;
- masse volumique, 0,53 g.cm-3 ;
- température de fusion, 180°C ;
- température d'ébullition, 1336°C.
Il existe deux isotopes stables du lithium, !!!" et !!!" . [...].
Le lithium métallique réagit peu avec l'eau ».
1Rappeler les règles générales permettant d'établir la configuration
électronique d'un
atome dans l'état fondamental et les appliquer à l'atome de lithium. A quelle
famille chimique
appartient-il ?
2Justifier que « l'énergie d'ionisation du lithium (5,39 eV) est plus élevée
que celles
des autres métaux de sa colonne ».
3« son potentiel d'électrode est relativement bas ». Quelle application du
lithium tire
profit de cette propriété ?
4Déterminer l'abondance relative des deux isotopes du lithium (on négligera la
présence d'autres isotopes).
Le lithium métallique cristallise dans une maille cubique centrée (les atomes
de lithium
occupent les sommets d'un cube et son centre).
5Représenter la maille du lithium, déterminer le nombre d'atomes par maille
ainsi que
la coordinence du lithium dans la maille, après avoir défini cette notion.
6-
Déterminer la valeur du paramètre de la maille.
Page 2/ 6
Chimie 2015 - Filière MP
Le lithium réagit avec l'eau en milieu acide pour donner des ions lithium.
7Ecrire l'équation (1) de la réaction du lithium avec l'eau en milieu acide en
prenant un
coefficient stoechiométrique de 1 pour le lithium.
8-
Evaluer la constante d'équilibre de la réaction (1). La réaction est-elle
attendue totale ?
9-
Proposer une interprétation de l'assertion « Le lithium réagit peu avec l'eau ».
10Donner l'allure des courbes courant-potentiel permettant de décrire les
caractéristiques
de la réaction (1).
B) Elaboration du lithium à partir du minerai : passage par des composés
intermédiaires.
Document 2 : Extrait des « Techniques de l'ingénieur »
« Le lithium est présent dans la lithosphère à une concentration de l'ordre de
60 ppm. Il existe
plus d'une centaine d'espèces minérales contenant Li, dont environ 25 titrent
plus de 2% en
Li2O.
Les trois principaux minéraux du lithium sont des aluminosilicates (exemple :
le spodumène
de formule {4SiO2.Al2O3.Li2O}).[...].
Le spodumène est broyé dans un broyeur à boulets dans lequel est ajouté de
l'acide sulfurique
H2SO4 à 93% en excès par rapport à la stoechiométrie de la réaction
ci-dessous.[...]. Cette
lixiviation avec de l'eau met en solution le lithium.
{4SiO2.Al2O3.Li2O} + 8 H+ = 2 Li+ + 2 Al3+ + 4 SiO2 + 4 H2O (2)
Les impuretés Mg, Ca, Al et Fe sont précipitées par neutralisation à la chaux,
puis le lithium
est précipité par du carbonate de sodium Na2CO3 à l'état de carbonate de
lithium. [...].
Le carbonate de lithium purifié est transformé en chlorure par réaction avec
l'acide
chlorhydrique.
11En considérant la réaction (2) comme totale, quel est le volume minimal
d'acide
sulfurique à 93% nécessaire pour dissoudre 1 mole de spodumène ? Pour
simplifier on
considérera que les 2 acidités sont fortes.
12Sous quelle forme les impuretés précipitent-elles lors de la neutralisation à
la chaux ?
Pourquoi le lithium ne précipite-t-il pas lors de cette étape ?
13Lors de l'étape de précipitation des impuretés, que l'on assimilera aux seuls
ions
aluminium, calculer le pH à atteindre pour commencer à précipiter les ions
aluminium ainsi
que le pH à atteindre pour précipiter 99,9 % des ions aluminium initialement
présents (on
considérera une solution initiale contenant des ions Li+ à 0,1 mol.L-1 et
l'impureté Al3+ à
hauteur de 1% en quantité de matière ; on négligera la dilution).
Page 3/6
Tournez la page S.V.P.
Chimie 2015 - Filière MP
Le carbonate de lithium est un composé peu soluble dans l'eau. Sa solubilité
est de l'ordre de
0,2 mol.L-1 à 20°C et de 0,1 mol.L-1 à 100°C.
14Le carbonate de lithium est-il plus ou moins soluble que le carbonate de
sodium ?
Justifier.
15-
Ecrire l'équation de la réaction (3) de dissolution du carbonate de lithium.
16-
La réaction (3) est-elle endo ou exothermique ? Justifier.
17En déduire le signe d'une grandeur thermodynamique caractéristique de la
réaction
(3), grandeur dont on précisera le nom.
18Déterminer la valeur de cette grandeur thermodynamique (on pourra introduire
des
simplifications dans l'application numérique).
C) Elaboration du lithium à partir du minerai : électrolyse.
Document 3 : Extrait des « Techniques de l'ingénieur »
« Le lithium métal est obtenu par électrolyse ignée de son chlorure. [...].
L'électrolyse
s'effectue dans une cellule de type Down comparable à la cellule produisant le
sodium. Cette
cellule comprend :
- une cuve en acier revêtue entièrement de briques réfractaires et calorifugées
;
- quatre anodes en graphite dont une seule est représentée sur le schéma ;
- une cathode annulaire entourant les anodes ;
- quatre diaphragmes en toile métallique situés entre les électrodes pour
empêcher la
recombinaison entre le lithium et le dichlore ;
- un collecteur, une sorte de cloche portant les diaphragmes, placé au dessus
des
anodes, qui recueille séparément le lithium et le dichlore.
Le chlorure de lithium est alimenté en continu dans la cellule ; le débit est
réglé de sorte que
le niveau reste constant. [...].
Dans les cellules les plus récentes, les conditions d'électrolyse sont les
suivantes : pour une
densité de courant de 6 à 7 kA.m-2, la tension est de l'ordre de 6 à 7,5 V.
[...].
Une cellule d'électrolyse produit 275 kg de lithium et 1400 kg de dichlore par
jour et la
consommation électrique est de 30 à 35 kWh.kg-1 de lithium.
Page 4/ 6
Chimie 2015 -- Filière MP
Schéma simplifié de l 'électrolyseur :
Electrode a
(Pôle négatifl
7 7
////////Æ W///////Æ
Diaphragme en toile métallique \ Electrode b
(Pôle positif)
En complément d information, une électrolyse ignée signifie que le chlorure de
lithium est
électrolyse sous forme de sel fondu, la température d électrolyse étant
comprise entre 400 et
460 °C. Le lithium métal est également obtenu à l 'état liquide. Le milieu dans
l 'électrolyseur
est parfaitement anhydre. On considérera le chlorure de lithium comme étant
totalement
dissocié (LiÎCl') à la température d électrolyse. La densité de courant
indiquée est donnée
pour l électrode où apparaît le lithium. La consommation électrique indiquée
prend en
compte le fonctionnement de l électrolyse et le chauflage de la cellule.
19- Déterminer, en justifiant, les réactions à l'anode et à la cathode ainsi
que l'équation
globale de la réaction d'électrolyse.
20- Nommer les espèces chimiques 1 à 4 et affecter les termes d'anode et de
cathode aux
électrodes a et b.
21- Estimer la tension minimale d'électrolyse. Quel phénomène permet
d'interpréter
l'écart entre la valeur calculée et la valeur indiquée dans le document 3 ?
22- Vérifier que les masses de lithium et de dichlore obtenues, indiquées dans
le document
3, sont bien cohérentes entre elles.
23- Montrer que les données du document 3 permettent de retrouver par calcul
une valeur
légèrement sous--estimée de la consommation électrique. Comment interpréter
l'écart entre la
valeur calculée et la valeur indiquée dans le document 3 ?
Page 5/6 Tournez la page S.V.P.
Chimie 2015 - Filière MP
Données :
Constante d'Avogadro : NA= 6,0.1023 mol-1.
Constante des gaz parfaits :R= 8,3 J.K-1.mol-1
Constante de Faraday : F= 96500 C.mol-1
RT
ln10 = 0,06V
Constante de Nernst à 298 K :
F
Masses molaires : H : 1,0 g.mol-1 ; C : 12,0 g.mol-1 ; O : 16,0 g.mol-1 ; Cl :
35,5 g.mol-1
H2SO4 : 98 g.mol-1
Densité d'une solution d'acide sulfurique à 93% en masse : " 2
Produit de solubilité à 25°C : Al(OH)3(s) : Ks " 10-33
Potentiels standard à 25°C et pH = 0 :
Li+(aq)/Li(s) : - 3,0 V H+(aq)/H2(g) : 0,0 V Cl2(g)/Cl-(aq) : 1,4 V
Dans un souci de simplification, on utilisera ces valeurs de potentiel sur
l'ensemble du sujet
quelles que soient les phases des espèces et la température.
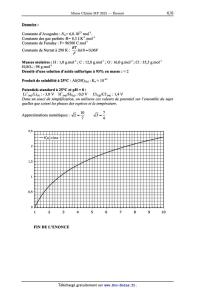
Approximations numériques :
2"
10
7
3"
7
4
2,5
f(x)=lnx
2
1,5
1
0,5
0
1
2
3
4
5
FIN DE L'ENONCE
Page 6/ 6
6
7
8
9
10
