Mines Chimie MP 2002
| Thème de l'épreuve | Étude de l'élément plomb |
| Principaux outils utilisés | diagrammes binaires, diagrammes d'Ellingham, thermochimie, diagrammes potentiel-pH, oxydoréduction, cristallographie |
| Mots clefs | plomb, métallurgie, accumulateurs au plomb |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
]. 2063--A
A 2002 Chimie MP
ECOLE NATIONALE DES PONTS ET CHAUSSEES.
ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE,
DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT--ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNICATIONS DE BRETAGNE.
ECOLE POLYTECHNIQUE ( Filière TSI ).
CONCOURS D'ADMISSION 2002
EPREUVE DE CHIMIE
Filière : MP
(Durée de l'épreuve : 1 heure 30 minutes)
(L'usage d'ordinateur ou de calculatrice est interdit)
Sujet mis àla disposition des concours : Cycle International, ENSTIM, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2002--Filière MP
Cet énoncé comporte 6 pages de texte et un document annexe à rendre avec la
copie.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur
sa copie et poursuit sa composition en expliquant les raisons des initiatives
qu'il est amené à prendre.
DEBUT DE L'ENONCE
LE PLOMB
Ce problème comporte différentes parties totalement indépendantes.
Toute réponse non justifiée ne sera pas prise en compte.
Le plomb constitue 0,014 % en masse de la croûte terrestre, ce qui le place
parmi les métaux
industriels. Sa métallurgie, très ancienne, est importante du fait de la grande
variété d'utilisation de
ce métal ou de ses dérivés : alliages (par exemple pour la soudure},
accumulateurs, protection contre
les radiations ionisantes...
' L'objet de ce problème est l'étude de la méthode industrielle d'élaboration
du plomb par voie sèche
ou pyrométallurgie, ainsi que de deux exemples d'utilisation de ce métal.
A Elaboration du plomb par pyrométallurgie
A--I Le minerai
Le procédé d'élaboration du plomb par voie sèche repose sur l'extraction et
l'exploitation d'un minerai, le
sulfine de plomb PbS ou galène qui possède une structure de type chlorure de
sodium.
Page 1/6 Tournez la page, S.V.P.
Chimie 2002 - Filière MP
1- Représenter la maille conventionnelle du réseau cristallin de la galène.
2-- Définir le terme « coordinence » et donner la coordinence des ions dans
cette structure.
3-- Montrer que la connaissance de la masse volumique p de ce solide permet la
détermination du paramètre a de
la maille : on établira, pour cela, la relation existant entre p et a.
4-- Peut--on prévoir une structure de type chlorure de sodium d'après les
valeurs des rayons ioniques r(Pb2+) = 118
pm et r(s2') = 184 pm ?
Données: Jî=1,41,J5=1,73
A--II Le grillage de la galène
La première étape du procédé industriel d'élaboration du plomb consiste en une
étape de grillage de la galène
selon la réaction, effectuée à 700°C :
2 PbS(s) + 3 02(g) : 2 PbO(s) + 2 SOz(g)
5- Définir la variance d'un système. Calculer la variance d'un système à
l'équilibre contenant PbS, 02, PbO et
802. Que peut--on déduire de cette valeur ?
6- Calculer l'enthalpie standard de la réaction à la température considérée. La
réaction est--elle endothermique ou
exothermique ?
7-- Quelle est l'influence de la température sur la constante d'équilibre de
cette réaction ?
8-- Donner l'expression de l'affmité chimique pour la réaction de grillage de
la galène. En déduire l'influence, sur
cet équilibre, de la pression totale imposée sur le mélange réactionnel.
Pouvait-on prévoir qualitativement ce
résultat '?
A-III Réduction de l'oxyde de plomb
L'oxyde de plomb PbO est réduit dans un haut-foumeau en présence de coke. Deux
réducteurs peuvent
intervenir : le carbone et le monoxyde de carbone. L'étude des réactions
correspondantes est réalisée à l'aide du
diagramme d'Ellingham donné en annexe (fig.]).
9-- Rappeler en quoi consiste l'approximation d'Ellingham et justifier le fait
que le diagramme comporte un
ensemble de segments de droite.
Sur la figure 1 sont représentées les droites d'Ellingham relatives aux couples
CO(g)/ C(s) [courbe (a)], C02(g) /
C(s) [courbe (b)] et COZ® / CO® [courbe (c)].
10-- Que peut-on dire de la stabilité du monoxyde de carbone '? Montrer que le
diagramme d'Ellingham du
carbone et de ses oxydes peut se simplifier. Le diagramme simplifié sera
utilisé dans la suite du problème.
Réduction par le carbone
11- a) Déterminer, en exploitant le diagramme d'Ellingham, la température à
partir de laquelle la réduction de
l'oxyde de plomb par le carbone est possible dans les conditions standard.
b) Ecrire l'équation--bilan de la réaction correspondante pour T<600 K. Exprimer son enthalpie libre standard de réaction en fonction de la température. Quelle est la température d'inversion Ti de cette réaction ? Que dire de la valeur de la constante d'équilibre si T < Ti ? Si T >
Ti '?
c) Montrer que, si la pression est fixée à la valeur PCO2 = P" = 1 bar, la
donnée des enthalpies libres
Page 2/6
Chimie 2002 -- Filière MP
standard des réactions de formation des oxydes permet effectivement la
prévision du sens d'évolution de la
réaction étudiée en b). On supposera les phases condensées pures.
Réduction par le monoxyde de carbone
12- Discuter, en utilisant le diagramme d'Ellingham, la possibilité de réduire
l'oxyde de plomb par le monoxyde
de carbone.
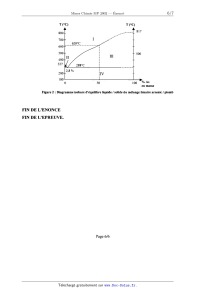
B Les alliages arsenic/plomb
Ces alliages sont utilisés en particulier pour fabriquer des plombs de chasse
(alliage à 1 % d'arsenic). La figure 2
donnée en annexe représente le diagramme isobare d'équilibre solide/liquide du
mélange binaire arsenic/plomb.
13- Indiquer l'état physique et la nature des phases présentes pour chacun des
quatre domaines du diagramme.
Les alliages plomb/arsenic sont-ils homogènes ou hétérogènes ?
14- Comment nomme-t-on l'alliage contenant 2,8 % d'arsenic en masse ? Quelle
est sa particularité ?
15- Tracer schématiquement les courbes de refroidissement correspondant à deux
mélanges liquides contenant
respectivement 2,8% et 50% en masse d'arsenic.
C Les accumulateurs au plomb
On supposera dans toute cette partie que l'on peut assimiler activité et
concentration et que la température est
fixée à 25°C.
On se propose d'étudier le fonctionnement d'un accumulateur au plomb, assimilé
à une pile électrochimique
réversible. Celui--ci comporte deux électrodes constituées respectivement:
- d'une lame de plomb,
- d'une couche de dioxyde de plomb PbOZ déposée sur une électrode inerte de
plomb.
L'électrolyte est une solution concentrée d'acide sulfurique de pH inférieur à
0,5.
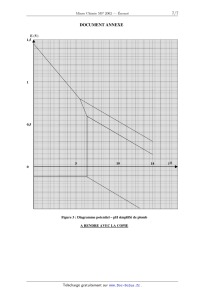
C-I Diagramme potentiel-pH
La figure 3 donne le diagramme E = f(pH) simplifié du plomb.
16-- Indi uer sur ce dia amme (document annexe ui est à rendre avec la co ie),
les domaines de
q gr 2+'l P
prédominance ou d'existence des espèces suivantes : Pb , Pb, PbO, PbOz, Pb3O4.
17-- Déterminer le potentiel standard du couple PbOz/ Pb2+ d'après le diagramme
potentiel-pH, sachant que le
tracé est réalisé en prenant une concentration ce en plomb égale à l mol.L".
18-- Tracer, sur le même graphe, le diagramme potentiel--pH relatif aux couples
de l'eau. On considérera que la
pression partielle des espèces gazeuses est égale à 1 bar.
19-- 3) Que peut-on dire de la stabilité du plomb en milieu aqueux ?. Ecrire
l'équation-bilan de la (ou des)
réaction(s) susceptible(s) de se produire.
b) Ecrire l'équation-bilan de la réaction thermodynamiquement permise entre Pb
et PbOz à pH acide.
Comment nomme-t-on une telle réaction ?
c) Que peut-on dire a priori de la cinétique des réactions étudiées aux
questions 19 a) et 19 b) ? Pourquoi
peut-on observer une décharge de l'accumulateur si celui--ci n'est pas utilisé
pendant une durée
suffisamment longue ?
Page 3/6 Tournez la page, S.V.P.
Chimie 2002 -- Filière MP
C-II Fonctionnement de l'accumulatenr au plomb
20-- Quelles sont les espèces majoritaires présentes dans une solution d'acide
sulfurique concentrée de pH
inférieur à 0,5 ?
21- a) En milieu sulfurique, les ions Pb2+ sont en équilibre avec le sulfate de
plomb très peu soluble. Ecrire
l'équation-bilan de la réaction de formation de PbSO4 en faisant intervenir les
espèces prépondérantes dans
le milieu dont le pH est inférieur à 0,5. Donner l'expression de sa constante
d'équilibre, ainsi que la valeur
numérique correspondante.
b) Montrer que la concentration en ions Pb2+ est imposée dans un milieu
sulfi1rique concentré. Quelle en est
la valeur numérique ?
22-- a) Quelle est la borne positive de l'accumulateur ?
b) Exprimer sa force électromotrice e à courant nul en fonction du pH.
c) Pourquoi a--t-on intérêt à utiliser de l'acide sulfiuique relativement
concentré comme électrolyte ?
(1) Ecrire l'équation-bilan de la réaction de décharge de l'accumulateur : on
veillera à faire intervenir les
espèces prépondérantes dans le milieu.
23- a) Comment recharge--t-on un tel accumulateur ? Quelles sont les réactions
qui se produisent ?
b) Sachant que l'accumulateur est scellé, expliquer pourquoi il existe une
limite de tension à imposer lors
de la recharge.
Données
Dans tous les calculs, les gaz seront assimilés à des gaz parfaits et les
phases solides seront considérées comme
non miscibles. Les indices (s) et (g) désignent respectivement les espèces en
phase solide et en phase gazeuse.
0 Enthalpies standard de formation à 298 K (en kJ.mol°l ) :
Ces grandeurs seront supposées constantes dans l'intervalle de température
considéré.
...
"...
0 Enthalpies libres standard de réaction :
C(s) + 02(g) : C02(g) ArGol : - 393 " 0,003T (kJ.mol")
2 Pb(s) + 02(g) = 2 PbO(s) A,G°2 = -- 438 + 0,202T (kJ.mol") pour T 5 [O, 600 K]
0 Constante d'acidité (à 25°C) :
HZSO4 : première acidité forte, pKAZ = 1,9
0 Produit de solubilité (à 25°C) :
pK,(PbSOÙ = 7,8
0 Potentiels redox standard (à pH = 0 et 25°C) :
...
...=0 06 à 25°C.
On considérera que F
Page 4/6
Chimie 2002 - Filière MP
FIGURES
A.G_l______ (k__Ï_.mol")
::.-=:--:-: 'äî:ä:äi" :::äFOEËË ':OE":äï'=
===== "'='" ===-fifi
Ëë I:'=::: "' .:::=:==== ' -
":?"
_ :
:.
.... ...__.__._
.
.
::
:...
::
::": ' "::
:=:=" ' '
:::... .. "': ":"." {
_ :ä;Ëëfiä...f" ::: ___=_.Îî_________:_:: _:_gg:... Ë=Ë'ä' ': .: :::-::: .::ä::
0 :::..::ËEË=Ë"':Ë:............:Ë=Ë" "===" "'@:ËE' "E.ÈËEËE.__ :.....
.....::--':' "==:_E=: ...:...Ê::Ë:......:ËË
:::-.:". "': .:::"":: .:: :--:::æ:. .'"':: ' ___====_____...__ .:::
:.::.:::.:::-- : "': "::..':' ':" ' :::--
""'"Ëä' .....ËËËEËËÏ..ËÏLÎ"' :: -"fi- "'..ä..-" ::::ä:äê'äïäëîïï.m:--m ::.
_____.;Z'...'ä:-::-;Ê"'"_ "'""
::.::::::ä::: '";___;:___ "...:":::ä:::ä::ä:ä::fl.. :::..... ..."-.:::Ëfläää
..::___::::ä_::j .::.":::::::ä::"_ "ä::::.?:fi:?ä.'ä::ä':ä::ä... :::: :::_::_.
:::: ::
_::::::"'::::::fl ::::'::' Hä::äï::::ä:?fli :::::':ä'":: Ë:""":'_
:::ä:::::ää"""""""flh- "::::"::::::":.--. '
_200 ïä«...:-:"------ë":-ä-fi f :fusmn de PbO
m=_m:"...--:-Ë'=_È...MuËÊ-äË--ääfl"ää
' ...jä"..:ä...ää:àfi: .::::."":':::: :::: .....äëëä____...: ___._. .:äääiää
::ä:
i'.. .IL'LII.... ...... ...--... . ." ......IIIII.III H...... " ...-.... .....
...:-..: Il...-...... ...
fi:".:::::æ ::::g" _:::Ë:_ ': :::-::"... ""'-""::::m:::::::::m:::::äi-::::
I..
:::::::...:...:......4:::- :.-::=-:::::: . "=::::---...--:-::::::: :::;.:_::-::
'" :--::--::----: :::: i!:im:fi.=ä :......
::.=":::.: __...._.:------...---=
"-'EE':':äËËEËËË:EË.:-ËËE::-':::::'E--ZäË:EäË""EEEE':OE:E"J'...-"::
=..Æ====fl=m=.::::ë"ä:m-- ::
III... .: l'...". "III...." . .."...IIIIIIIIIII ... ..."..IIIIIIIIIII !.5=
l...lllll."ll"ll'lll .. II.... Il...... ... . :n::u...u ......
".Ê::E .--=.==ËIIIIII=IIË=È:l .:. .. I...: Il Il...-..=.. ...-..=-- .:..
...l..=I ..."... ..=.-III.- ..I.=== ..
""'=':»--::...ä-'-:...=....---Ë-:fi:-.:«='"------Ë...:ËË=- ":::--=='?
"n'-"::"..ËË ---:::Ë::"=-==:m =::=:::-:
wë:r::. ::::::&...ääl:ä:£ëäää:"'ä:äää:äfi ": ::::äf'ää:ä:::::::::ä":::"" :=-
:::ËËÆËËEOE .Ë::: ::.:ËE::::"___
....-.................... ......... ... ::Ëw...:æ:::æ..:æ::æä:æä::::
::::æ:::ä::æ::æ: ::Ë:Ë::::::::.
3 00.- II.... à::l.:::::::: mu:ununus=tnnnn ......mufi id.....:.lg'fil .
-- . Il...-I...... Il.....l'... ...-...... IS... .. ...... ......I.".I=IIII .
I...... .. I...... .. ...-..... ...!...- Il...--IE...
'=="="::"""""..."'"" "'"===-ËIË==ËE"ÈË=.:uugnur<':=ËËËËEÊËË=ËËËË=""Ë=ËË? ::::ä: "' ':iä: :::::=:: .ËËEË__ ...äi:ä::::...:æ: .ï?:::z::..äää ...:.........:::.::..w .:......mæm:::æ:::......:m.::......! "':::...:":: _ :::--::--:-:--- ::::::::::--...:: :::::::::=* .:::::::m: ::::::::æ:::a::::æ:::::::::fl::::::::::-.::::::::::.:::::::.m .....i:::::::::'i:...ä:: " "="" 'EEF::".Z':äiü*£*äëä::äiEiäifiëîä!äiäiëäëäëä::::äëä=!::äiëä!--====-==-===Ëiäë::iäëäiëëäiäi:::?!äîEE' -=="=:=ä'ë=" äEäiæ:ä'... """ "::::::::::m:::::::=:::::::::::::::::=:=:::::::::::::::::::::::::::ä .::. ":äü:æ:::._ :::?" "'='... '" ...-........-.....................I'SIIIIIII.IIII.I ......-........IIIIIIIII.hS.II ...-I......II.Il...-I.....IIII "'--..... ...-...... . ......I....Iu mm::- .::: .::::::ä:ä:ä:':ä:ä:ä:"ää::::'.':. .ä:::::::===:::::::ä::ää:ää.ä::£:ää:äfl::ä:::::::::ääää:::::äfl":ää._ .__:::_ ::;:::::....::W: .. ll.lil . . ..!I'i... .."....Iu.:::l:fllll I.... .... ......IIIIIII.IIIËFI!......I "II""II'SIIIIIIIIOEIIIIIII .Il... ...: |. .. "I'. l . ..=.-I'd....-......III-..".IIIIIIIIII .... ... ...-.........-.....---.'.l...lll.ll."=nlll"lmu ::mu:unn:uunnumnwn=lllluu ... :..... ::::fi'::===lll===mnnu===nu g__::ggggggïgg_fl __ :-...-:::::::::::::::::==:::==: .::.::::::::::::::::::::::::::::::-:::::'"'"".::: "Ë:"":" _::__::- . ":::": '"':: -'""'""'""::."'"""""::::::...:.::"::: :::::::::::::::w::::::'""'" :'5?=':""--"OE:ä. :::-.: "a:-w..."- '::. .::...._: l.llllllllll:lllllllII==IlI==I'IIIIl I.IIIIII III III===.;--IIIIIIIII=:IIIIm III-IIIIIII=IIIIII :IIIIIIIIIII.'I IIII "...:-=IIIIII--rlçg=ll .Il-==IIII' il III-I . II.II III.... "'":"ä:::::ääääîä:ää:ä::'ääiäi:::--:::äëääâ::.:ä:ääi==fi=iä:ää=ä'ë::..:äâä'äälääääæ «-:...%:.--E:"---'"""" '500 -E'.'i-"-:.flë'"""'ë:'"ä"Täufi:"""u""ä...'ä'ä*ï"a""mn""n .:::":--::':__::":ä:' Ë=::::=ä=ääfl= ':'==î=ä::ä=äiëËËË£äËEË:-.ÊËEËËË:ËË :::::::. ":.""'"":::::...::::--:::-::::::::::.Ë........:::ËEË:Ë:Ë::: "' .::-.: ::.:a: :fl:::::ä"':::""::ää__i___ä:ä:' .Æ:-:::ä=ä====e=mm===:========ä=ä:==ä=:mäaæefl:rmm ':- ":."::":'"' .. ...-=-:::...::-.......:: ===Ë'ÆEË:äËEËËE:Ëäiäëiä:::::ääääääë -='---':.. ::-:===.-----:==9--=-----" -=========--==--===== :""..."Êuä"m'"...u"" Figurel Diagramme d' Ellingham ======::::::m:m--îî=ä'ë-ËEË::äË:Ë""" lIl.=IIIIII...I....Il.lll."l:Èîä:ä:lu.:=========æ. '==I=III= "Ë=Ê=Ë=Ë=ËÎÈÎ=Î==Ë=IIOEOE === ..======= Page 5/6 Tournez la page, S.V.P. Chimie 2002 - Filière MP T (°C) T (°C) 800 -------- 700 I " 600 """"""""""""""" 500 500 327 r 288°C 2,8 % 200 100 0 50 100 % AS en masse | l I 1 l 400 : l | | l : ! Figure 2 : Diagramme isobare d'équilibre liquide / solide du mélange binaire arseuic / plomb FIN DE L'ENONCE FIN DE L'EPREUVE. Page 6/6 DOCUMENT ANNEXE E (V) Figure 3 : Diagramme potentiel -- pH simplifié de plomb A RENDRE AVEC LA COPIE
