CCINP Chimie MP 2007
| Thème de l'épreuve | Éthanol: pouvoir calorifique et constante d'équilibre d'estérification |
| Principaux outils utilisés | atomistique, thermochimie, solutions aqueuses, oxydoréduction |
| Mots clefs | éthanol |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
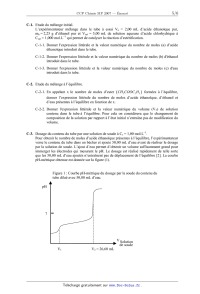
SESSION 2007 ); EDHEÜLIRE EÜH"IU"«I'E PÛLVTEEHHIÛUE5-- EPREUVE SPECIFIQUE -- FILIERE MP CHIMIE Durée : 2 heures Les calculatrices sont autorisées *** NB : Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre. *** L'ETHANOL : POUVOIR CALORIFIQUE ET DETERMINATION DE LA CONSTANTE D'EQUILIBRE DE SA REACTION D'ESTERIFICATION PAR L'ACIDE ETHANOIQUE A. ETUDE D'ATOMES ET DE MOLECULES INTERVENANT DANS LA REACTION D'ESTERIFICATION Données spécifiques àla partie A . Masse molaire atomique de l'isotope 162C : 12,00000 g-moÎ'. . Masse molaire atomique de l'isotope 163C : 13,00335 g-moÎ'. . Numéro atomique de l'oxygène : 8. A-1. Indiquer la configuration électronique dans son état fondamental : A-l-l. De l'atome d'oxygène. A-l-2. De l'atome de carbone. A-2. Le carbone à l'état naturel est constitué principalement par les isotopes 162EUR et 163 C . A-2-l. Que signifient l'indice 6 et l'exposant 13 relatifs à l'isotope 163 C ? A-2-2. Combien de neutrons le noyau de l'isotope 163 C contient-il ? 1/6 A-3. A-2-3. Déduire de la masse molaire atomique du carbone à l'état naturel (12,01115 g-moÎ') : A-2-3-1. Sa fraction molaire en isotope 163 C . A-2-3-2. Sa fraction massique en isotope 163 C . Etude de la molécule d'eau. A-3-1. Ecrire la représentation de Lewis de la molécule d'eau et en déduire sa formule VSEPR (AXnEp). A-3-2. Déduire de la question A-3-1 la géométrie de la molécule d'eau. La dessiner en faisant apparaître les doublets liants et les doublets non liants éventuels. A-3-3. La molécule d'eau présente-t--elle un moment dipolaire Î9 non nul ou nul? Justifier votre réponse. . Etude de la molécule d'acide éthanoïque CH3 COOH. A-4-1. Ecrire la représentation de Lewis de l'acide éthanoïque. A-4-2. Déduire de la question A-4-1 la formule VSEPR (AXnEp) : A-4-2-1. De l'atome de carbone (atome C2) lié à 3 atomes d'hydrogène et à l'autre atome de carbone (atome C1). A-4-2-2. De l'atome de carbone (atome C1) lié à 2 atomes d'oxygène et à l'autre atome de carbone (atome C2). A-4-3. Dans la molécule d'acide éthanoïque 4 atomes sont toujours coplanaires : quels sont ces atomes ? Justifier votre réponse. A-4-4. En justifiant votre réponse indiquer la valeur de l'angle ÏÎCÊ . B. POUVOIR CALORIFIQUE DE L'ETHANOL ET TEMPERATURE DE ROSEE DES GAZ DE COMBUSTION Données spécifiques àla partie B Composition molaire de l'air : 21 % de dioxygène et 79 % de diazote. Capacité calorifique massique à pression constante de l'eau liquide : cp,eau = 4 180 J-kg_l--K_l. Chaleur latente de vaporisation de l'eau à 40°C : LV(4OoC) = 43 340 J--moÎ'. L'échangeur de chaleur est isobare (P0 = 1 bar). Tous les gaz (ou vapeurs) sont parfaits. Masse molaire de l'éthanol : 46,07 g-moÎ'. T(K)=0 (°C)+273,15 1bar=105Pa. Pression de vapeur saturante, en pascal, de l'eau en fonction de sa température T exprimée en 3816 44 kelvin : Psat = ex 23,1964 -- _" . eau(T) p( T--46,13 ) 2/6 Enthalpie standard de Capacité calorifique molaire Composé formation isobare AfH;SOC( J-mol_l) (:p (J-mol_l-K_l) Ethanol liquide - 276 520 110,5 Dioxygène gaz 0 29,5 Diazote gaz 0 29,1 Dioxyde de carbone gaz - 393 500 38,7 Eau vapeur - 241 810 37,7 B-1. Ecrire l'équation bilan de la réaction [1] de combustion, en présence de dioxygène, d'une mole d'éthanol liquide (C2H5OH) en dioxyde de carbone gazeux et en vapeur d'eau. B-2. Calculer l'enthalpie standard à 25°C de la réaction [1] : AÏQIHËZSOC). B-3. On appelle pouvoir calorifique inférieur (PCI) d'un combustible, la chaleur libérée, à 25°C et 1 bar, lors de la réaction de combustion quand l'eau est formée à l'état vapeur. Calculer le PCI de l'éthanol exprimé en kJ-kg_l. B-4. Un brûleur est alimenté à pression constante (P0 = 1 bar) et à 25°C par 4 moles d'éthanol liquide et par 100 moles d'air. La réaction de combustion est totale et conduit à la formation de dioxyde de carbone et de vapeur d'eau. B-4-1. Calculer le nombre de moles de chaque composé dans le mélange sortant du brûleur. B-4-2. Calculer la pression partielle de l'eau dans ce mélange B-4-3. En considérant que l'intégralité de la chaleur de combustion est reçue par les gaz de combustion, déterminer la température T1 des gaz sortant du brûleur. B-4-4. A la sortie du brûleur les gaz circulent dans un échangeur de chaleur d'où ils ressortent à 110°C et au sein duquel ils cèdent de la chaleur à de l'eau liquide dont la température augmente de 15°C à 40°C. B-4-4-1. Calculer la quantité de chaleur échangée par les gaz de combustion. B-4-4-2. Calculer la masse d'eau liquide chauffée par les gaz de combustion. B-4-5 . En refroidissant suffisamment les gaz de combustion dans l'échangeur de chaleur on peut liquéf1er une partie de l'eau formée lors de la réaction de combustion. B-4-5-1. Déterminer la température de rosée des gaz de combustion (température pour laquelle la première goutte d'eau liquide apparait). B-4-5-2. Dans le cas où la température de sortie de l'échangeur de chaleur des gaz de combustion est égale à 40°C : B-4-5-2-1. Calculer le nombre de moles d'eau liquide formée. B-4-5-2-2. Calculer la quantité de chaleur échangée par les gaz de combustion au sein de l'échangeur. C. ETUDE DE L'EQUILIBRE D'ESTERIFICATION Données spécifiques àla partie C 0 Masse molaire (g.moÎ') : acide éthanoïque M& = 60,05 ; éthanol Mb = 46,07 ; eau MC = 18,02 ; chlorure d'hydrogène MHc1 = 36,46. 3/6 0 Masse volumique à 25°C (g.mL_l) : acide éthanoïque p& = 1,042 ; éthanol pb = 0,786 ; solution aqueuse d'acide chlorhydrique molaire (Ccat = 1,000 mol . L_1) : p...= 1,016. 0 La température est égale à 25°C. Toutes les constantes d'équilibre sont données à 25°C. 0 Produit ionique de l'eau : KEUR =10_14. - Constante d'acidité du couple CH,COOH / CH,COO :K, = 10--4=75. . L'éthanol (C,H 5OH ) et l'éthanoate d'éthyle (CH3COOC2HS) n'ont pas de propriété acido- basique dans l'eau. 0 L'activité des espèces en solution aqueuse intervenant dans les réactions acido-basiques sera assimilée à leur concentration exprimée en mole.L_1 . 0 On considérera que les mélanges se comportent comme des solutions idéales et qu'il y a donc additivité des volumes. 0 Dans le tube à essai comme dans le bécher il n'y a qu'une seule phase. ' Indicateurs colorés : Indicateur coloré Intervalle Couleur de la Couleur de la de virage (pH) forme acide forme basique Jaune de métanil 1,2 - 2,8 violet jaune Hélianthine 3,1 - 4,4 rouge jaune orangé Bleu de bromophénol 3,0 - 4,6 jaune bleu Vert de bromocrésol 3,8 - 5,4 jaune bleu Rouge de méthyle 4,2 - 6,2 rouge jaune Bleu de bromothymol 6,0 - 7,6 jaune bleu Phénolphtaléine 8,0 - 9,9 incolore rouge . Le chlorure d'argent est un sel peu soluble dans l'eau : K°S = 10--9'50 . 0 El . = 0,800 volt. g /Ag 0 L'activité d'un solide pur est égale à l'unité. - F = 96 484 C--moÎ'. . Constante des gaz parfaits : R = 8,3145 J-mol_l-K_l. . T (K) = 0 (°C) + 273,15. La formation de l'éthanoate d'éthyle CH3COOC2H5 à partir d'acide éthanoïque CH3COOH et d'éthanol C2H5OH met en jeu l'équilibre traduit par l'équation bilan [2]. CH3COOH + C2H5OH (-- CH3COOC2H5 + H20 [2] % [H,O] [CH,COOC,H,] [CH,COOH] [C,H,OH] La constante d'équilibre apparente K s'écrit : K = Pour étudier l'équilibre [2] un expérimentateur mélange dans un tube à essai les différents réactifs et il attend plusieurs jours afin que l'équilibre soit établi. Il réalise ensuite un dosage pour obtenir le nombre de moles d'acide éthanoïque présent à l'équilibre ce qui lui permet de calculer la valeur numérique de la constante d'équilibre apparente K. 4/6 C-1. Etude du mélange initial. L'expérimentateur mélange dans le tube à essai Va = 2,00 mL d'acide éthanoïque pur, mb = 2,25 g d'éthanol pur et Vcat = 5,00 mL de solution aqueuse d'acide chlorhydrique à C... = 1,000 mol.L_1 qui permet de catalyser la réaction d'estérification. C-l-l. Donner l'expression littérale et la valeur numérique du nombre de moles (a) d'acide éthanoïque introduit dans le tube. C-l-2. Donner l'expression littérale et la valeur numérique du nombre de moles (b) d'éthanol introduit dans le tube. C-l-3. Donner l'expression littérale et la valeur numérique du nombre de moles (c) d'eau introduit dans le tube. . Etude du mélange à l'équilibre. C-2-l. En appelant x le nombre de moles d'ester (CH3COOC2HS) formées à l'équilibre, donner l'expression littérale du nombre de moles d'acide éthanoïque, d'éthanol et d'eau présentes à l'équilibre en fonction de x. C-2-2. Donner l'expression littérale et la valeur numérique du volume (VT) de solution contenu dans le tube à l'équilibre. Pour cela on considérera que le changement de composition de la solution par rapport à l'état initial n'entraîne pas de modification du volume. . Dosage du contenu du tube par une solution de soude à CS = 1,00 mol.L_l. Pour obtenir le nombre de moles d'acide éthanoïque présentes à l'équilibre, l'expérimentateur verse le contenu du tube dans un bécher et ajoute 50,00 mL d'eau avant de réaliser le dosage par la solution de soude. L'ajout d'eau permet d'obtenir un volume suffisamment grand pour immerger les électrodes qui mesurent le pH. Le dosage est réalisé rapidement de telle sorte que les 50,00 mL d'eau ajoutés n'entraînent pas de déplacement de l'équilibre [2]. La courbe pH-métrique obtenue est donnée sur la figure (1). Figure 1 : Courbe pH-métrique du dosage par la soude du contenu du tube dilué avec 50,00 mL d'eau. A V . Solution > de soude V1 V2 = 26,60 mL 5/6 C-3-l. C-3-2. C-3-3. c-3-4. L'acide chlorhydrique utilisé comme catalyseur est dosé en premier. C-3-l-l. Ecrire l'équation bilan traduisant la réaction de dosage. C-3-1-2. Calculer le volume équivalent de solution de soude V1 nécessaire pour atteindre cette première équivalence. Après V1, la solution de soude versée permet le dosage de l'acide éthanoïque présent à l'équilibre. Pendant ce dosage il n'y a pas déplacement de l'équilibre [2]. C-3-2-1. Ecrire l'équation bilan traduisant la réaction de dosage. C-3-2-2. En déduire l'expression littérale, en fonction notamment de V2, et la valeur numérique du nombre de moles d'acide éthanoïque présent dans le tube à l'équilibre. Etude de la première équivalence. C-3-3-1. Donner l'expression littérale et la valeur numérique de la concentration molaire C1= [CH3COOH] + [CH3COO_] dans le bécher à la première équivalence. C-3-3-2. Calculer la valeur du pH à la première équivalence. C-3-3-3. Quel indicateur coloré peut être utilisé pour détecter cette équivalence ? Justifier votre réponse. Constante d'équilibre apparente de la réaction d'estérification. C-3-4-1. Déduire de C-3-2-2. la valeur numérique du nombre de moles d'ester, d'éthanol et d'eau présentes à l'équilibre dans le tube. C-3-4-2. Calculer la valeur numérique de la constante d'équilibre apparente K. . Pour mesurer le pH d'une solution, on mesure la différence de potentiel entre une électrode de verre et une électrode de référence. Le potentiel d'électrode de l'électrode de verre dépend du pH et le potentiel d'électrode de l'électrode de référence est constant. Une électrode de référence souvent utilisée est obtenue en plongeant un fil d'argent recouvert de chlorure d'argent dans une solution d'acide chlorhydrique où l'activité des ions chlorure (Cl--) est constante et égale à l. C-4- l . C-4-2. 043. 044. Calculer l'activité des ions Ag+ présents dans la solution contenue dans l'électrode de référence. Ecrire la demi-équation électronique du couple redox fonctionnant à l'électrode de référence. Donner l'expression littérale du potentiel d'électrode de l'électrode de référence Calculer la valeur numérique, à 25°C, du potentiel d'électrode de l'électrode de référence. Fin de l'énoncé. 6/6
