CCINP Chimie MP 2003
| Thème de l'épreuve | Synthèse en solution et en phase solide de pigments destinés à la peinture |
| Principaux outils utilisés | thermochimie, solutions aqueuses, diagrammes binaires |
| Mots clefs | jaune de chrome, blanc de zinc, bleu de Prusse, pinène |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)





Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
SESSION 2003 | MPCH 10
CONCOURS (OMMUNS POlYTECHNIOUES
EPREUVE SPECIFIQUE - F ILIERE MP
CHIMIE
Durée : 2 heures
Les calculatrices sont autorisées
***
NB : Le candidat attachera la plus grande importance à la clarté, à la
précision et à la concision de la
rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le signalera sur sa
copie et devra poursuivre sa composition en expliquant les raisons des
initiatives qu'il a été amené à
prendre.
***
La peinture, artistique ou non, fait appel à la chimie. Actuellement, de
nombreux produits
organiques sont utilisés dans ce domaine. Autrefois, c'était essentiellement
des produits minéraux.
Cela constitue le thème de ce problème.
Une peinture est composée d'un liant (huile de lin par exemple) lui conférant
sa dureté après
séchage et de pigments, vecteurs de la couleur, véhiculés à l'aide d'un solvant
(essence de
térébenthine par exemple).
, Dans ce problème, on aborde les préparations, les propriétés et les dangers
de ces divers
composants :
I. Pigment bleu : bleu de Prusse.
II. Pigment jaune : chromate de plomb.
III.A Pigments blancs : oxyde de zinc, oxyde de titane.
III.B Préparation du blanc de zinc.
IV .A Essence de térébenthine.
IV .B Distillation du pinène.
Les parties I, Il, HLA, III.B, IV.A et IV.B sont indépendantes.
On ne considérera que les réactions proposées dont on fournit les constantes
d'équilibre.
PARTIE I -- Pigment bleu
Le bleu de Prusse est un précipité F CN Fe obtenu ar réaction de F CN 4-- sur
Fe3+
6 3 4 P 6
selon :
3Fe(CN){ + 4Fe3+ <--_--_--> [Fe(CN)6]3Fe4(S) .
On s'intéresse à la chimie ou à l'électrochimie des espèces utilisées pour
cette synthèse :
1%", Fe", Fe( CN )4", Fe( CN à", CN", HCN .
1. Quelle est la valeur du potentiel d'une électrode de platine plongeant dans
une solution
[Fe2+ ] : [Fe3+ ]=1 mol.L_1 ?
2. Quelle est la valeur du potentiel d'une électrode de fer plongeant dans
cette même solution ?
3. On se place, dans la suite de cette partiel, à un pH où HCN est négligeable
devant CN ".
Quel est le potentiel standard apparent du couple F e(+ IH)/Fe(+ Il) en
présence de CN ' ?
4. A une concentration de 10"'2 mol.L'1 , Fe(CN)Ê" est--elle une espèce
dangereuse dans la
mesure où elle peut libérer du CN ' ?
La limite légale admissible est de 1 ug.L"1 de CN ".
5. Une personne a ingéré du CN ". On veut la traiter avec un sel de F e2+ ou F
e3 +.
Lequel est le plus efficace à concentration égale pour diminuer la quantité de
CN ' libre ?
PARTIE II --- Pigment jaune
Le « jaune de chrome » est obtenu par action du chromate CrO4-- sur un sel de
plomb Pb2+ . Par
précipitation dans l'eau, on obtient Pb CrO4 .
L'ion chromate a un caractère basique dans le couple HCrO}/Cr0f .
1. A quel pH opérer pour que CrO4_ soit prépondérant ?
2. Après précipitation et filtration PbCr04 est lavé. Quelle est la teneur en
plomb de cette eau de
lavage (pH : 7) ? Cette eau dépasse-t--elle la norme légale de 50 ug.L"1 en
plomb ?
3. Dans les ouvrages de peinture, on déconseille de mélanger le jaune de chrome
et le sulfure de
manganèse rose, ce qui donne une teinte couleur chair (très utile pour peindre
des visages).
Pourquoi ?
PARTIE III. A -- Pigments blancs
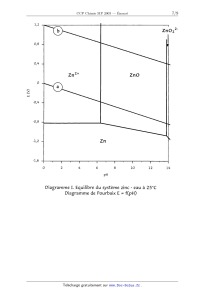
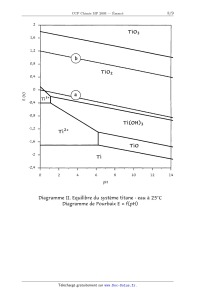
On donne les diagrammes de Pourbaix de Zn et Ti dans l'eau à 25°C (diagrammes I
et II). Les
concentrations des espèces solubles sont de 10"2 mol.L"l. Les droites limitant
les domaines de
réduction et d'oxydation de l'eau sont notées a et b respectivement.
Sur un tableau, on veut savoir si le pigment blanc est obtenu à partir de ZnO
(avant 1920) ou
T 102 (après 1920), ce qui permettrait de confirmer son époque.
1. En utilisant des réactifs classiques de la chimie (acides, bases, oxydants,
réducteurs), indiquez
une méthode pour différencier Zn0 de T 102.
2. Les pigments blancs des tableaux modernes dureront-ils plus longtemps que
ceux des anciens
indépendamment des considérations cinétiques ?
PARTIE III. B -- Préparation du blanc de zinc ZnO
On fait réagir ZnS solide et 02 gazeux. Il se forme ZnO solide et 802 gazeux.
1. Equilibrer l'équation de réaction.
2. La réaction est-elle favorisée dans le sens de la formation de ZnO et S02 à
T : 298K ?
3. Quelle est la valeur de l'enthalpie standard de réaction à 298K ?
4
. Pour faciliter le démarrage de la réaction, on se propose de travailler à
1000K . Quelles sont
alors les valeurs de A,.H° (T = 1000 K ) et A,.G" (T = 1000 K ) ?
$"
Quelle est la valeur de la constante d'équilibre K 0 à 1000 K ? La réaction
est--elle totale ?
6. L'énergie thermique libérée lors de l'oxydation d'une mole de ZnS
permet-elle d'élever la
température au moins à 1000K d'une nouvelle mole de ZnS et de la quantité d'air
correspondant à la stoechiométrie ? On suppose que l'on travaille à P : cte et
que
T initiale = 298 K.
7. Dans ces conditions, à quelle température Te y a--t-il équilibre entre la
chaleur dégagée par la
réaction et celle nécessaire à l'élévation de température des réactifs de 298K
à T, (réaction
auto--entretenue) ?
PARTIE IV.A -- Essence de térébenthine
L'essence de térébenthine est constituée de pinène C...H16 et de produits
lourds moins volatils
dont on négligera l'effet dans ce problème.
Le pinène, selon la température T (K ), présente une tension de vapeur P(hPa)
donnée par la
relation:
lnf(hPa) = 16,0481-- 3326'67
RIO--64,97 '
De même la tension de vapeur de l'eau est donnée par la relation :
5176,44
ln IîhPa) = 20,809 "" _]ÎK_)--
1. Est--il dangereux de travailler (peinture d'un tableau) dans un local où
l'essence de térébenthine
est à l'air libre, T : 298K ? La limite à ne pas dépasser est de 5 g.m"' . On
assimile la vapeur
saturante à un gaz parfait. Quelle solution envisagez--vous ?
2. Dans quel domaine de température doit-on travailler pour éviter tout danger ?
3. Pour purifier l'essence de térébenthine, on se propose d'entraîner le pinène
dans un courant de
vapeur dans un appareillage correspondant au schéma ci--dessous, fonctionnant à
la pression
atmosphérique (1013 h Pa) :
Condenseur de vapeurs
Pinène liquide
Eau liquide
Chauffage
Eau, pinène, produits lourds
On recueille ainsi en B de l'eau et du pinène liquides. Eau et pinène liquides
ne sont pas
miscibles quelle que soit la température.
Quelle est la variance au niveau du récipient A '? Que peut--on en déduire pour
la valeur de la
température T ?
4. Calculer la température en A en °C à il °C près.
5. Quel est le rapport des masses de pinène et d'eau du mélange recueilli en B
s'ils sont assimilés
à des gaz parfaits à l'état vapeur ?
6. Quelle masse minimale d'eau doit--on introduire en A si l'on veut recueillir
1000 g de pinène en
B ?
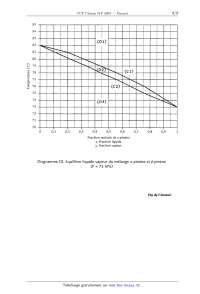
PARTIE IV.B ---- Distillation du pinène
En fait, le pinène obtenu est composé d'un mélange de deux isomères :
l'a--pinène et le B--pinène
de formule C...H16. Le diagramme III, isobare tracé à la pression de 73 kPa
présente l'évolution
de la température en fonction de la composition molaire en a--pinène pour un
mélange a--pinène
B--pinène.
1. Quelle est la température d'ébullition de l'a--pinène pur teba et celle du
B--pinène pur tebB ?
2. On considère un mélange de 280 g d'a--pinène et 720 g de B--pinène. Sous
quelle forme se
trouve ce mélange si on le porte à des températures successives de t= 76 °C ,
t= 80 °C ,
t = 81 °C et t = 83 °C ? Préciser alors les domaines d'existence des
différentes phases D1, D2,
D3. Quel est le nom des courbes C1 et C2 figurant sur le diagramme III ?
3. Lors d'une distillation du mélange précédent, à quelle température teb
observe--t-on l'apparition
de la première bulle de vapeur ?
Les premières gouttes de liquide ainsi recueillies sont--elles plus riches en
oc--pinène ou en
B--pinène '? Quelle est leur composition en fraction molaire ?
Données :
- On assimile les activités aux concentrations.
. Les potentiels sont indiqués par rapport à l'électrode standard à hydrogène.
. Sans mention contraire, les expériences sont réalisées à 25 °C.
Potentiels standards :
EoFe2+/Fe : °O'44 V
EC 24. : +0,77 V
Fe3+ /Fe
Produits de solubilité :
Bleu de Prusse [F e(CN )6 ]3 F 64 formé par réaction de Fe3+ avec [F e(CN )6]4_
Ks = 3,210"41
]
Pb Cr 0%? Pb2+ + Cr 04" Ks2 = 1()*13
(jaune)
MnS(s) :? Mn2+ + S2" Ks3 = 10"9'6
(rose)
PbS(S) {__--> Pb2+ + S'" _ Ks4 = 10--27,8
(bleu noir)
Constantes de dissociation :
Fe(CN)ËÇ : Fe3+ + 6 CN" K°d1 = 10"42
Fe(CN)6" 22 Fe2+ + 6CN" K°d2 = 10"35
HCN <_--> CN"+H+ K°a1=6,3.10_10
HCrO{ 2 CrO4'+H+ K° =10--6,4
Masses atomiques :
H =1 g.mofl
C=12 g.mol"1
N=l4g.mol"1
O=16 g.mol"1
Pb =207 g.moÎ1
_R--T--1nx = ËÎ--ln10.logx : 0,06logx à 298 K.
F F
ln logarithme népérien.
log logarithme à base 10.
Données thermodmamigues à T = 298 K
___-__--
___--__--
C p indépendant de la température.
Air = mélange 1 volume 02 + 4 volumes N2
R = 8,31 J.mol"l .K-1
ZnO sublimation à tsubl : 1800 °C
ZnS fusion à tfan : 1850 °C
E (V)
1,2
0,8
0,4
-0,4
-O,8
-1,2
-l,6
b ZHOZZ'
Zn2+ ZnO
pH
Diagramme I. Equilibre du système zinc - eau à 25°C
Diagramme de Pourbaix E : f(pH)
E {V)
1,6
1,2
0,8
0,4
-0,4
-0,8
-1,2
-1,6
-z,z+
'!
Diagramme II. Equilibre du système titane - eau à 25°C
pH
Diagramme de Pourbaix E : f(pH)
T103
TiOz
TF"
"1
Ti(OH)3
' Ti2+
_ TiO .
_ T\--
T 1 ' | ' l i
0 2 6 10 12
14
Température (°C)
00
UI
\]
'--l
\]
O
84 ----
83 nuuu ---------
& uunu (... ------uu
81 S\:a---- "un----
79 "flux.--"num"
78 "un"- 'a_ (... un--
77 "nu--nm _uuu
% "un--u @ a__uuu
73 uuuu ">." "un--&
72 ------u----u----u
-----_----__----
""un--"un"--
O
__O
|__|
O
N
0,3
_O
4:
0,5
0
O'\
O
\]
_O
00
O
KD
'--l
Fraction molaire de a-pinène
x, fraction liquide
y, fraction vapeur
Diagramme III. Equilibre liquide vapeur du mélange a--pinène et B-pinène
(P = 73 hPa)
Fin de l'énoncé.
