CCINP Chimie MP 2002
| Thème de l'épreuve | Piles à combustible. Production de silicium ultra-pur. |
| Principaux outils utilisés | cristallographie, oxydoréduction, thermochimie, diagrammes d'Ellingham, diagrammes binaires |
| Mots clefs | pile à combustible, silicium, trichlorosilane |
Corrigé
:👈 gratuite pour tous les corrigés si tu crées un compte
👈 l'accès aux indications de tous les corrigés ne coûte que 1 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - -
👈 gratuite pour ce corrigé si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
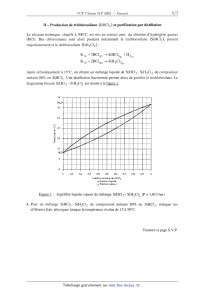
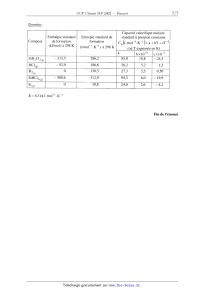
SESSION 2002 A MPCHIO CONCOURS (OMMUNS POLYÏECHNIOUES EPREUVE SPECIFIQUE - FILIERE MP CHIMIE Durée : 2 heures Les calculatrices sont autorisées. *** NB : Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre. *** Une feuille de papier millimètré doit être distribuée avec le sujet. Les parties AI, All, BI, B11 et BIII sont indépendantes. PARTIE A -- Pile à combustible I -- Stockage du dihydrogène Le dihydrogène peut être stocké sous différentes formes : -- à l'état gazeux sous pression, -- à l'état liquide à basse température, -- à l'état condensé sous forme d'hydrure ionique. On se propose ici, d'étudier une technique de stockage : l'adsorption du dihydrogène par le composé inter--métallique FeTi : FeTi (solide) + %- H2 (gaz) «: FeTiH... (solide) ArH° = --33,4 k J mol--1 L'alliage FeTi a une structure cubique simple : la maille élémentaire est cubique et comporte un atome de titane à chaque sommet du cube et un atome de fer au centre du cube. 1. Représenter cette maille élémentaire ; citer un composé ionique ayant une structure de ce type. Dans les composés inter--métalliques FeTi, seuls les sites formés par deux atomes de fer et quatre atomes de titane peuvent être occupés par des atomes d'hydrogène. Tournez la page S.V.P. 2. Représenter à partir d'une maille cubique simple d'atomes de titane, les positions des atomes de fer et les sites octaédriques susceptibles d'accueillir des atomes d'hydrogène. 3. En déduire la formule stoechiométrîque de l'hydrure contenant le maximum théorique d'hydrogène. 4. En réalité, l'adsorption maximale d'hydrogène correspond à l'hydrure FeTiH.... En admettant que la maille reste encore cubique, calculer la capacité volumique d'adsorption de dihydrogène par le composé inter--métallique FeTi (on exprimera cette capacité en kg d'hydrogène par m3 d' hydrure). Données : Masses atomiques (g.moi") : H : 1 Fe : 55,8 Ti : 47,9 Paramètre de la maille cubique FeTi : a = 298 pm Nombre d'Avogadro : N A = 6,02 1023 mol--1 II -- Réaction mise en oeuvre dans la pile à combustible Dans certaines piles à combustible, on utilise le dihydrogène comme combustible et le dioxygène comme comburant. La réaction globale de la pile a pour équation--bilan : l H2+502 _) H20... 1. Donner l'expression de la constante d'équilibre K° correspondant à cette réaction. Cette réaction est, en fait, l'association de deux demi--réactions d'oxydoréduction mettant en jeu les couples redox (H+/H2) et (02/H20). 2. Ecrire les équations des deux demi-réactions électroniques d'oxydoréduction. 3. Les deux demi--réactions ont lieu sur deux électrodes. Indiquer la réaction cathodique et la réaction anodique. 4. Donner l'expression du potentiel d'oxydoréduction pour les deux couples (à 25°C). 5. Exprimer la constante d'équilibre K° en fonction des potentiels standards des couples (H+/H2) et (02 /HZO). Calculer sa valeur et commenter. Données : E°(H+ /H2)= OV E°(OZ/HZO)=LZ3V à 25°C, I--{--'Î--'lnlO = 0,059V . F PARTIE B -- Production de silicium ultra-pur Le silicium peut être produit par réduction du dioxyde de silicium. Toutefois la pureté obtenue n'est pas suffisante pour des applications microélectroniques. Pour atteindre cette pureté, des opérations supplémentaires sont nécessaires. Parmi les nombreux procédés industriels existants, une possibilité de production du silicium ultra--pur passe par un intermédiaire : le trichlorosilane. Les étapes successives sont : 1. Réduction du dioxyde de silicium. 11. Production de trichlorosilane (SiHC13) et purification par distillation. Ill. Réduction du SiHC13 en présence d'hydrogène. On se propose d'étudier successivement ces trois étapes. I -- Réduction du dioxyde de silicium La réduction du dioxyde de silicium Si02 peut être effectuée par le carbure de calcium CaC2. On se propose d'étudier cette réaction dans le domaine de température 298--2000 K où les seuls composés présentant un changement de phase sont le silicium Si et le dioxyde de silicium Si02. Dans cette partie, on supposera en première approximation que l'enthalpie standard ArH° et l'entropie standard ArS° des réactions considérées ne dépendent pas de la température en dehors de tout changement de phase (approximation d'Ellingham). 1. Expliquer les valeurs nulles de AfH° observées dans le tableau de données. Oxydation du carbure de calcium. 2. La réaction d'oxydation du carbure de calcium conduit à la formation d'oxyde de carbone (CO) et d'oxyde de calcium (Ca0). Ecrire l'équation--bilan de cette réaction pour une mole de dioxygène. 3. Exprimer l'enthalpie libre standard de réaction A,GÏ' (T) pour le domaine de température 298--2000K. Oxydation du silicium. 4. Calculer l'entropie standard de fusion du silicium à 1683 K et du dioxyde de silicium à 1883 K. 5. En tenant compte des différents états physiques du silicium et du dioxyde de silicium dans l'intervalle de température 298--2000 K, établir les expressions de l'enthalpie libre standard ArGâ (T) de la réaction : Si +o2 --> Si02 Tournez la page S.V.P. Réduction du dioxyde de silicium parle carbure de calcium. 6. Ecrire l'équation-bilan de cette réaction pour une mole de dioxyde de silicium. 7. Tracer sur un graphe, l'évolution de ArGÏ'(T) et ArGÊ(T) dans le domaine de température de 298 à 2000 K. L'échelle suivante sera adoptée : 1 cm pour 100 K et 2 cm pour 100 kJ/mol. 8. A partir du tracé précédent, en déduire, par simple lecture, le domaine de température où la réduction du dioxyde de silicium par le carbure de calcium conduit à la production de silicium à la pression de 1 bar. 9. Calculer une valeur plus précise de la température précédemment lue sur le diagramme. 10. Dans un réacteur de 8 litres, préalablement vidé, on introduit 24 g de Si02 solide et 30 g de CaC2 solide. La température est maintenue à 1730 K. Indiquer l'état physique des produits de la réaction. Calculer les masses des différents constituants du mélange à l'équilibre, ainsi que la pression de la phase gazeuse. 11. Doit-on prendre des précautions particulières d'une part, pour refroidir le silicium liquide jusqu'à la température ambiante et d'autre part, pour son stockage ? Données : Composé Enthalpie standard de formation Entropie standard absolue à 298 K, _ à 298 K, AfH° (kimi--1) s°(J.K"1.morl) -- 877,4 CO (gaz) -- 110,5 197 6 (3210 (solide) --- 635,1 Masse atomiques (g.moÎ') : Si : 28,1 0 : 16,0 C : 12,0 Ca: 40,1 Constante des gaz parfaits : R = 8,314J.K"'mol"' Changement d'état : - fusion du silicium: Tfusion =1683K ; Afusi0nH° = 46,0 ki.mo1"1 - fusion du dioxyde de silicium : Tfusion = 1883K ; AfusionH° : 8,5 kJ.moï1 Il -- Production de trichlorosilane (SiHCI3) et purification par distillation Le silicium technique, chauffé à 300°C, est mis en contact avec du chlorure d'hydrogène gazeux (HCl). Des chlorosilanes sont alors produits notamment le trichlorosilane (SiHCl3), présent majoritairement et le dichlorosilane (SiH2C12) : Si (8) + 3HCl(g) -+ 51H013® + H2® s1(S) + 2HCl(g) -+ SiH2C12OE) Après refroidissement à 15°C, on obtient un mélange liquide de SiHC13, SiH2C12 de composition molaire 80% en SiHCl3. Une distillation fractionnée permet alors de purifier le trichlorosilane. Le diagramme binaire SiHCl3 --SiH2C12 est donné à la figure 1. Température [°C) 1 0,2 0,3 0 ,4 0,5 0,6 0,? 0,8 0,9 1 0 0, Fraction molaire de SiHC|5 x,Fraction liquide y, Fraction vapeur Figure 1 : Equilibre liquide vapeur du mélange SiHC13 --SiH2C12 (P = 1,013 bar) 1. Pour un mélange SiHCl3--SiH2CI2 de composition molaire 80% en SiHC13, indiquer les différents états physiques lorsque la température évolue de 15 à 30°C. Tournez la page S.V.P. 2. L'objectif est de produire du SiHCl3 pur. L'obtient-on au résidu ou au distillat ? A quelle température doit-on maintenir le bouilleur ? 3. La tête de colonne ainsi que le condenseur sont maintenus à 15°C. Quelle est la composition du distillat '? 4. Calculer graphiquement le nombre de plateaux de la colonne entre l'alimentation et la tête de colonne puis entre l'alimentation et le pied de colonne. III -- Réduction de trichlorosilane (SiHCl3) en présence d'hydrogène A lOOO°C, le trichlorosilane ultra-pur est réduit par l'hydrogène, suivant la réaction : SiHCl3 + H2 -> Si + 3HCl (g) (g) (S) (g) Le silicium ultra-pur, produit par cette réaction, est déposé sur un barreau de silicium. 1. Calculer l'enthalpie standard et l'entropie standard de la réaction à 298 K. 2. Calculer l'enthalpie standard et l'entropie standard de la réaction à lOOO°C. 3. En déduire les valeurs de l'enthalpie libre standard et la constante d'équilibre de la réaction à IOOO°C. 4. Etablir l'expression du rapport des activités H, en fonction des pressions partielles des différents gaz présents. En calculant la valeur de H pour les conditions initiales, la réaction souhaitée a--t-- elle lieu ? 5. Etablir l'expression de la constante d'équilibre en fonction du coefficient de dissociation oc de SiHCI3, de B (rapport du nombre de mole initial de H2 sur le nombre de mole initial de SiHCl3, [?> Z 1) et de la pression totale PT. 6. Pour une pression totale de 1 bar et pour 6 = 1, calculer la valeur du coefficient de dissociation et les pressions partielles à l'équilibre. 7. Qualitativement, que se passe--t-il à température et pression constantes lorsque l'hydrogène est introduit en excès dans le réacteur ? Calculer la valeur du coefficient de dissociation à l'équilibre pour 5:10. 8. Qualitativement, que se passe-t-il lorsque la réaction est effectuée sous pression réduite '? Calculer la valeur du coefficient de dissociation à l'équilibre pour B =1 et PT : O,lbar . 9. Quelle utilisation peut-on faire du chlorure d'hydrogène (HCl) produit ? Données : Capacité calorifique molaire standard à pression constante cp (J.morl.K--l)= a + bT +cT"2 Composé . (où T ex orimée en K) ___--__- SiHCla(g) --488,6 312,9 6,0 --19,9 M R =8,314J.mol_l.K--l Enthalpie standard de formation (kJ/mol) à 298 K Entropie standard de formation (J mol--1 .K"1) à 298 K Fin de l'énoncé
