Mines Chimie PC 2000
| Thème de l'épreuve | Chimie physique ; synthèse du Lilial |
| Principaux outils utilisés | atomistique, cristallographie, solutions aqueuses, thermochimie, chimie organique |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
A 2000 Chimie PC
ECOLE NATIONALE DES PONTS ET CHAUSSEES,
ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE,
DE TECHNIQUES AVANOEES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT--ETIENNE, DES MINES DE NANCY,
DES TEOECOMMUNIÇAÜONS DE BRETAGNE
ECOLE POLYTECHNIQUE (F [LIBRE TSI)
CONCOURS D'ADMISSION 2000
CHIMIE
Filière : PC
(Durée de l'épreuve : 4 heures)
Sujet mis à disposition des concours:
ENSTIM, INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2000 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'énoncé de cette épreuve, particulière aux candidats de la filière PC,
comporte 10 pages.
0 Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas établi, mais qui serait
utile dans la poursuite de l'épreuve.
. Les candidats ne devront pas hésiter à formuler des commentaires succincts
qui leur sembleront pertinents,
même si l'énoncé ne le demande pas explicitement, à condition qu'ils
s'inscrivent dans le programme du
concours et soient en rapport avec le problème posé.
. Le barème tiendra compte de la longueur de l'énoncé.
. Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une
erreur d'énoncé, il le signale sur sa
copie et poursuit sa composition en expliquant les raisons des initiatives
qu'il est amené à prendre.
DEBUT DE L'ENONCE
PARTIE A : CHIMIE PHYSIQUE
Les questions 1 et Il prennent leurs exemples dans les propriétés du potassium,
la question Ill traite des équilibres
de complexation avec un exemple emprunté à la chimie du mercure. Les trois
questions sont indépendantes.
I Atomistique :
1. Quelle est la configuration électronique du potassium dans l'état
fondamental ? Indiquer la place du potassium
(K, Z=19) dans la classification périodique. Donner le nom d'un autre élément
de la même colonne.
2. On rappelle les règles de Slater, permettant d'estimer l'énergie orbitalaire
associée aux nombres quantiques n
* 2
Z ,] .
et I par: £(n,l)=--I3,6{ (? )] _en eV (I eV= 1.6 10 '9 J).
[1 .
La charge effective Z* est obtenue par la formule : Z* = Z -- 6 où Z est le
nombre réel de protons et 0 est la
constante d'écran obtenue grâce au tableau 1 ci-dessous.
Le nombre quantique apparent n* est obtenu à partir du nombre quantique
principal n grâce au tableau 2.
Tournez la page S.V.P.
Tableau 1 : effet d'écran exercé sur l'électron i de la couche et par
l'électronj de la couche B, selon les sous--
couches respectives où se situent ces deux électrons
Montrer que, dans le cas particulier du potassium, l'énergie d'ionisation est
égale à --8(4,0)
Evaluer l'énergie d'ionisation pour le potassium. La valeur expérimentale est
4,34 eV. Commenter.
3. Le potassium cristallise dans le réseau cubique centré : décrire ce système.
Calculer la masse volumique et la compacité du potassium solide.
Données : «/5 = 1,7 ; masse atomique du potassium : 39 g.mol'l ; paramètre de
maille du potassium : a=532 pm ;
Constante d'Avogadro : N : 6.0 1023 mol".
Il Neutralisation d'effluents par une solution d'hydroxyde de potassium :
Certaines industries, notamment celle du traitement des métaux, mais aussi les
tanneries, produisent comme
effluents des solutions aqueuses chargées de sels de métaux lourds. Le premier
traitement d'épuration consiste à
effectuer la précipitation de ces métaux sous forme d'hydroxydes. Nous allons
nous intéresser à la neutralisation
d'un effluent contenant du cuivre (chlorure de cuivre") et de l'aluminium
(chlorure d'aluminium), dont les
réactions de précipitation sont :
Cuâ; + 20H;q __), Cu(OH)2
Aiâq+ + 3 OH;q ""--'E Ai(OH)3
\ . - , . 3+
On supposera que les seules especes alumm1ques presentes en solution sont :
A1(H20)6 aq que l'on notera Aläâr
et AI(OH) , qui sont reliées par un équilibre dépendant du pH :
4 aq
Ali; + 4 on;q _'(__ A1(0H);aq
Les constantes KE, Kî, [34 de ces équilibres sont données par :
ng = ng(Cu(0H)2) = --1og([Cuÿg][ong]2) = 19
ng = pKS(AI(OH)3) = --1og([Aiâgllong]3) = 33
[A](0H)g ...,]
---- =34
lAlï llOH£q l4
108(fl4) : 108
Page 2 sur 10
On simule ce processus au laboratoire de la façon suivante :
- dans un bécher, on verse 100 mL d'une solution A de potasse de concentration
0.01 mol.L'1
- à l'aide d'une burette, on ajoute progressivement une solution B contenant
des ions Cu2+, Al3+et NO; dont la
concentration est 0.1 mol.L'l pour chacun des 2 cations. Le pH de cette
solution B est de 3.
On relève en continu le pH et on dose les espèces en solution sur des
prélèvements de volume négligeable.
Le graphe du pH en fonction du volume de solution B ajouté est donné sur la
figure 1 ci dessous.
La concentration totale en aluminium dissout est tracée, en fonction du volume
de solution B ajouté, sur la
figure 2.
La concentration totale en cuivre dissout est tracée, en fonction du volume de
solution B ajouté, sur la figure 3.
Figure 1 : Relevé du pH en fonction du volume de solution B ajouté
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
Volume de solution B ajouté (mL)
Page 3 sur 10 Tournez la page S.V.P.
Figure 2 : Concentration totale en aluminium dissout en fonction du volume de
solution B
ajouté :
1.80E-03
1.60E-03
1.40E-03
1.20E-03
1.00E-03
8.00E-04
0 Al (mollL)
6.00E-04
4.00E-04
2.00E-04
0.00E+00
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
Volume de solution B ajouté (mL)
Figure 3 : Concentration totale en cuivre dissout en fonction du volume de
solution B ajouté :
4.50E-03
4.00E-03
3.50E-03
3.00E--03
2.50E-03
2.00E-03
0 Cu (mollL)
1 .50E-03
1.00E-03
5.00E-04
0.00E+OO '
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0
Volume de solution B ajouté (mL)
Page 4 sur 10
4. On s'intéresse tout d'abord à la solution initiale simulant l'effiuent à
traiter :
Montrer qu'elle est stable, c'est-à-dire que la précipitation des hydroxydes ne
s'y produit pas spontanément.
Montrer que la concentration en ions hydronium (H+) est négligeable devant la
concentration en cations
métalliques. On négligera l'effet des ions hydronium de l'effluent dans toute
la suite du problème.
On distingue sur la courbe de variation du pH en fonction du volume d'effiuent
ajouté (figure ]) plusieurs zones,
numérotées de I à IV, qui correspondent à des systèmes réactionnels différents
que nous allons chercher à
comprendre.
5. Zone [
Donner la forme majoritaire sous laquelle se trouve l'aluminium dissout dans la
zone 1
Décrire l'équilibre, impliquant des ions CH, de solubilisation de Al(OH)3 en
cette espèce majoritaire. En
calculer la constante Kg. On donnera l'expression littérale en fonction des
concentrations, puis en fonction des
grandeurs définies dans l'énoncé et enfin le logarithme de la valeur numérique.
Montrer qu'il ne se forme qu'un seul précipité dans la zone 1 et l'identifier.
Montrer que ce précipité se forme dès que la première goutte d'effiuent, d'un
volume égal à 0,05mL, est ajoutée.
6. Zone 11
Montrer, en prenant l'exemple du point de coordonnées (Volume ajouté : 2 mL, pH
: 8), que la zone Il
correspond à deux précipités.
Connaissant le volume ajouté (1,6 mL), justifier la valeur du pH du point
séparant la zone 1 de la zone II. On
donne : log...(l,6) : 0,2.
Montrer que, dans cette zone II, les deux réactions prépondérantes font
uniquement intervenir des espèces
contenant un élément métallique.
Identifier l'espèce aluminique soluble prépondérante dans la zone II : en
déduire la composition qualitative de la
solution obtenue si on interrompt l'ajout d'effiuent dans la zone II. Expliquer
la forme de la courbe de
concentration totale d'élément aluminium en solution en fonction du volume
ajouté (courbe 2) dans les zones 1
et II.
7. Zone 111
Sans effectuer de calcul d'équilibre, justifier que le volume de 2,0 mL marque
la transition de la zone Il à la zone
111.
Dans la zone Ill, la concentration en cuivre soluble, présentée sur la courbe
3, augmente fortement avec le
volume d'effiuent versé : expliquer ce phénomène en écrivant les réactions
prépondérantes dans cette zone.
Expliquer aussi pourquoi le pH varie peu dans cette zone.
8. Zone IV
Décrire les phénomènes intervenant dans la zone IV.
9. Proposer une méthode de séparation des hydroxydes d'une part et de la
solution aqueuse d'autre part.
10. L'aluminium n'est as toxi ue c'est même un reduit de traitement des eaux
très utilisé), alors que les sels de
P q P
cuivre sont fortement nuisibles pour l'environnement : à quel rapport (volume
ajouté)/(volume initial de solution
d'hydroxyde de potassium) faut-il arrêter le processus ?
Page 5 sur 10 Tournez la page S.V.P.
III Complexes en solution aqueuse
On considère une solution aqueuse contenant :
- du phénol que l'on notera ROI--I
- un sel mercurique (nitrate de mercure")
On donne les constantes d'équilibre suivantes :
pKa (ROH/RO') = 9,9
sz(Hg(RO)Ù = 20,1
La solution (C) considérée est obtenue comme suit : un volume de 100 mL d'une
solution de phénol (noté R-
0H) de concentration 0.02 mol.L'l est additionné à un volume de 100 mL d'une
solution de nitrate de mercure Il
de concentration 0.01 mol.L" à T=298 K.
11. La réaction ayant lieu en solution est la suivante :
2 R-OH..., + Hg2+(aq) ----> Hg(R-O)z (Solide) +2 H+(aq)
Calculer sa constante d'équilibre et son enthalpie libre standard de réaction.
En considérant la réaction ci-dessus comme prépondérante, établir l'équation
donnant de façon implicite la
composition à l'équilibre et la résoudre dans le cas particulier des valeurs
numériques de l'énoncé.
On utilisera les indications suivantes :
Log... (2) = 0.3 ; ln 2 = 0.69 ; RT = 2500 J.mol'1 à T = 298 K.
(a--x)3-2x2 = 0 a pour racine positive : x = 0.233 10'3 pour a = 5 103.
12. Lors de la réaction, on observe une augmentation de la température du
mélange de 0.047°C. La capacité
calorifique massique de la solution est : Cp = 4.2 J.g".K" et sa masse
volumique : p = 1000 kgm'3.
a--Evaluer l'enthalpie de la réaction considérée
b-A partir de l'état d'équilibre précédent, on augmente la température, dans
quel sens se déplacera--t-il ?
Page 6 sur 10
PARTIE B : SYNTHESE D'UN PARFUM : LE LILIAL
L'industrie de la parfumerie utilise de plus en plus des produits de synthèse.
Le lilial, noté A, dont la production
dépasse les 1000 tonnes/ un fait partie de ces produits.
La synthèse du lilial racémique a fait l'objet de nombreux brevets. Un travail
assez récent (D. Enders - 1990)
décrit l'obtention d'énanti0mères pratiquement purs.
Nous allons examiner ci--dessous deux grandes voies de synthèse 1 et II de ce
composé A.
Ces deux parties sont indépendantes.
/0
B - I SYNTHESE DU LILIAL A PARTIR DE L'ALDEHYDE B.
L'aldéhyde B est une des matières premières possibles pour préparer le lilial.
Cette synthèse sera examinée après
l' étude et la caractérisation de B.
I - 1 ETUDE DES COMPOSES A ET B
]. Indiquer le nombre de carbones asymétriques, notés*, que comporte le lilial
A ? En déduire le nombre de
stéréo-isomères et préciser leur relation de stéréo-isomérie.
2. Représenter ces stéréo-isomères en perspective de Gram et donner leur
configuration selon les règles de Cahn,
lngold et Prelog (CIP).
3. Quelle est la configuration de l'aldéhyde B ?
4. Quelles liaisons fonctionnelles les plus caractéristiques du composé B
pourrait--t-on visualiser en spectroscopie
infra-rouge (IR) ?
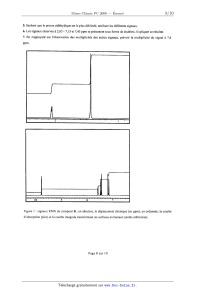
Le spectre de RMN de B (C14H180) ci-dessous est représenté en deux parties pour
une meilleure lisibilité : de
l à 2,3 ppm et de 7 à 10 ppm (les valeurs de 8 figurant en abscisse). La courbe
d'intégration figure sur ce spectre
qui a été obtenu par simulation à partir d'un logiciel.
Page 7 sur ... Tournez la page S.V.P.
5. Sachant que le proton aldéhydique est le plus déblindé, attribuer les
différents signaux.
6. Les signaux observés à 2,05 - 7,15 et 7,45 ppm se présentent sous forme de
doublets. Expliquer ce résultat.
7. En s'appuyant sur l'observation des multiplicités des autres signaux,
prévoir la multiplicité du signal à 7,6
Figure ] : signaux RMN du composé B ; en abscisse, le déplacement chimique (en
ppm), en ordonnée, la courbe
d'absorption (pics) et la courbe intégrale transformant les surfaces en hauteur
(unités arbitraires).
Page 8 sur 10
I - 2. SYNTHESE DU LILIAL A PARTIR DE B
8. Le lilial peut être obtenu à partir de l'aldéhyde B à partir d'une réaction
classique. Laquelle ?
9. La précédente réaction peut-elle avoir lieu sur d'autres sites de B ? dans
quelles conditions ? Comment peut-
on contrôler la régiosélectivité ?
10. B peut être obtenu par réaction de crotonisation en milieu eau-méthanol et
en présence de soude. Quels
seront les composés carbonylés nécessaires pour réaliser cette crotonisation ?
11. Donner le mécanisme détaillé de la précédente réaction.
B - Il SYNTHESE DU LILIAL A PARTIR DE L'ALDEHYDE C
Le lilial a également été préparé à partir du composé C suivant :
O
H
Cet aldéhyde C peut être obtenu à partir de propénal et de tert--butylbenzène
Nota Bene : le tert - butyl est le groupement -C (CHg)3 .
Il -- 1 SYNTHESE DU TERT-BUTYLBENZENE
12. Décrire la préparation du tert-butylbenzène à partir du benzène : indiquer
les produits de départ, le catalyseur
éventuel, le mécanisme.
13. Cette synthèse du tert-butylbenzène (liquide, température d'ébullition E =
169°C) peut être effectuée dans le
benzène (E = 80°C). Quel peut être l'intérêt d'utiliser un excès de benzène ?
Comment peut-on isoler le produit
final ? Décrire l'ensemble des opérations nécessaires dès la fm de la réaction.
Il -- 2 FORMATION DU COMPOSE C
14. La condensation du propénal sur le tert-butylbenzène est effectuée en
présence d'acides de Lewis. Il s'agit
d'une substitution électrophile. Pourquoi observe-t-on une substitution
préférentielle en para ?
15. Ecrire la réaction d'un proton avec le propénal.
On s'intéresse maintenant au propénal protoné :
Détailler la structure du propénal protoné en écrivant les formules mésomères
associées.
Le propénal protoné réagit avec le tert-butylbenzène pour donner C et on
suppose qu'on peut appliquer
l'approximation des orbitales frontières.
Nommer l'orbitale moléculaire du propénal protoné à considérer pour déterminer
la régiosélectivité de la
réaction.
En considérant la structure de C décrite ci-dessous, indiquer quel est l'atome
sur lequel l'orbitale mentionnée ci-
dessus est la plus développée.
Page 9 sur 10 Tournez la page S.V.P.
Parmi ces deux réactifs : organocuprate(lithié), organolithien, lequel
donnerait la même régiosélectivité lors
d'une attaque sur le propénal ?
II - 3 SYNTHESE DU LILIAL A PARTIR DE L'ALDEHYDE C
Un lilial optiquement actif peut être préparé selon la méthodologie suivante
(l'écriture de l'aldéhyde C et du lilial
ayant été simplifiée) :
16. A quel type de réaction classique vous fait penser la réaction de formation
de E ? Connaissez vous l'usage en
analyse qualitative organique de ce type de réaction ?
17. Proposer un mécanisme de formation de ce composé E en symbolisant
l'hétérocycle D par A-NH;.
Montrer qu'un pH trop élevé ou trop bas défavorise la réaction, et qu'il existe
des conditions optimales de pH
pour effectuer cette réaction.
18. Indiquer pourquoi la réactivité d'une double liaison carbone - azote est
proche de celle d'un carbonyle.
Proposer une méthode d'obtention du composé F à partir de E. On explicitera les
raisons de la réactivité
observée, sans tenir compte de la stéréochimie, et on précisera les réactifs
nécessaires.
19. Un composé de type A placé en milieu alcalin tend à se racémiser. Indiquer
le mécanisme de cette réaction
et expliquer ce phénomène.
FIN DE L'ENONCE.
FIN DE L'EPREUVE.
Page 10 sur 10