e3a Chimie PC 2007
| Thème de l'épreuve | Le bore |
| Principaux outils utilisés | atomistique, thermochimie, diagramme d'Ellingham, solutions aqueuses, oxydoréduction, chimie organique |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)





Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
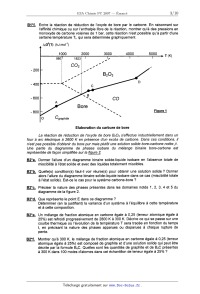
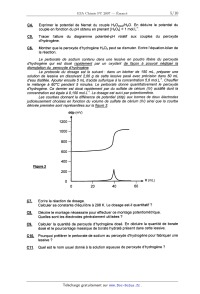
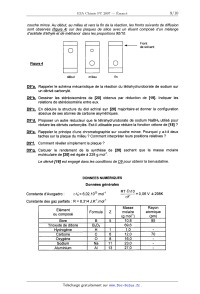
CONCOURS ENSAM - ESTP - ARCHIMEDE Épreuve de Chimie PC durée 3 heures Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, d'une _ part il le signale au chef de salle, d'autre part il le signale sur sa copie et poursuit sa composition en indiquant les raisons des initiatives qu'il est amené à prendre. L'usage de la calculatrice est autorisé 06PE CONCOURS ENSAM - ESTP - ARCHIMEDE Épreuve de Chimie PC durée 3 heures Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, d'une _ part il le signale au chef de salle, d'autre part il le signale sur sa copie et poursuit sa composrflon en indiquant les raisons des initiatives qu'il est amené à prendre. " L'usage de la calculatrice est autorisé Ce problème traite de différents aspects de la chimie du bore. La première partie concerne l'élément bore et ses voisins dans la classification périodique. La deuxième partie est centrée sur l'élaboration du carbure de bore (ralentisseur neutronique dans l'industrie nucléaire). Une troisième partie étudie un composé du bore présent dans un agent de blanchiment des lessives. Enfin, la dernière partie propose quelques applications du bore en chimie organique. Ces différentes parties sont totalement indépendantes les unes des autres. Remargues préliminaires importantes : . Les explications qualitatives des phénomènes interviennent dans la notation au même titre que les calculs. . Les résultats numériques sans unité ou avec une unité fausse ne seront pas comptabilisés. . Les gaz sont assimilés à des gaz parfaits et les phases solides sont non miscibles. . Les composés intervenant dans la synthèse organique sont nommés par un nombre écrit entre crochets et en caractères gras : [7] par exemple ; pour alléger l'écriture, les candidats peuvent ne faire figurer, lors dela description d'un mécanisme, que la partie « utile » qui intervient dans la réaction considérée. - Les données numériques sont répertoriées àla fin du problème. Le bore -- découvert en 1808 par Sir H. DAVY -- est un métalloi'de noir, brillant et dur. Il se combine avec de nombreux métaux pour former des boruoes. Les principaux composés du bore sont sous forme de borates et de perborates: ils entrent dans la fabrication de détergents, d'émaux, de céramiques et verres (Pyrex®) ainsi que d'engrais. Ils servent également de laitiers fusibles en métallurgie et de flux pour la soudure et le brasage. Tournez la page S.V.P. PREMIERE PARTIE : ETUDE DU BORE ET DE SES VOISINS A1. Donner la configuration électronique du bore dans son état fondamental. Enoncer le principe de Pauli, les régles de Klechkowski et de Hund. A2. En déduire les différents états d'oxydation du bore. Dans le tableau suivant sont données que/ques propriétés caractéristiques des éléments dela colonne du bore : Rayon Energie de première Electronégativité atomi--ue m ionisation kJ.mol'1 de Paulin- 85 801 2,0 Al 125 578 1,6 Elément 130 579 1,8 155 558 1,8 190 589 1,6 A3*a. Rappeler la définition de l'énergie de première ionisation et celle de l'affinité électronique. Comment évolue globalement l'énergie d'ionisation le long d'une ligne ou d'une colonne du tableau périodique ? (aucune justification n'est demandée) A3*b. Rappeler la définition de l'électronégativité de Mulliken. Comment évolue t-elle dans une colonne de la classification ? (aucune justification n'est demandée) A3*c. Le bore se démarque des autres éléments de sa colonne, qui sont tous des métaux. Pour cette raison et compte tenu de sa place dans le tableau périodique, il est parfois qualifié de « métallo'n'de ». Justifier qualitativement ce terme en utilisant les données du tableau précédent. DEUXIEME PARTIE: ELABORATION DU CARBURE DE BORE Le carbure de bore est un absorbant neutronique très utilisé du fait de sa forte teneur en bore, de sa stabilité chimique et de son caractère réfractaire : aussi l'industrie nucléaire française en consomme--t--e/Ie plusieurs tonnes par an. La synthèse du carbure de bore de formule 846 est réalisée dans un four à arc électrique. Réduction de l'oxyde de bore par le carbone B1*a. Rappeler l'approximation d'Ellingham. La figure 1 suivante représente le diagramme d'Eliingham associé au couple 8203 / B (en gras). En pointi/Ié, a été ajouté le diagramme du carbone, mettant en jeu les couples C02(g) / C(S, COQ) / CM et COz(g)/ C(s). Le diagramme est construit pour des équations d'oxydations écrites avec un coefficient stoechiométrique égal à un pour le dioxygène. B1*b. Ecrire les équations--bilans de la formation des oxydes CO et 8203. B1*c. Préciser les phénomènes à l'origine des changements de pente aux points A, B, C et D. B1*d. Justifier qualitativement le changement de pente observé en C. B1*e. Calculer la pente des segments OA et AB. B1*f. Ecrire la réaction de réduction de l'oxyde de bore par le carbone. En raisonnant sur l'affinité chimique ou sur l'enthalpie libre de la réaction, montrer qu'à des pressions en monoxyde de carbone voisines de 1 bar, cette réaction n'est possible qu'à partir d'une certaine température Ti, qui sera déterminée graphiquement. A,G°(T) (kJ.mol") 1000 2000 3000 4000 5000 T (K) 980ÿ 1823â , , £ / COQ , ' , - 200 , » ' , '? 5203 ..... ' ' D - 400 "< \ \ c \ \ \ B - 600 ' \ \ CD A \ \ \ Bore \ \ - 800 ' \ \ Eiggr_e_1 \ O Cgraphite \ Elaboration du carbure de bore La réaction de réduction de l'oxyde de bore 8203 s'effectue industrie/lement dans un four à arc électrique à 2600 K en présence d'un excès de carbone. Dans ces conditions, il n'est pas possible d'obtenir du bare pur mais plutôt une solution solide bare--carbone notée 5. Une partie du diagramme de phases isobare du mélange binaire bare-carbone est représentée de façon simplifiée sur la figure 2. BZ*a. Donner l'allure d'un diagramme binaire solide--liquide isobare en l'absence totale de miscibilité à l'état solide et avec des liquides totalement miscibles. BZ*b. Quelle(s) condition(s) faut-il voir réunie(s) pour obtenir une solution solide ? Donner alors l'allure du diagramme binaire solide--liquide isobare dans ce cas (miscibilité totale à l'état solide). Est-ce le cas pour le système carbone-bore ? BZ*c. Préciser la nature des phases présentes dans les domaines notés 1, 2, 3, 4 et 5 du diagramme de la figure 2. BZ*d. Que représente le point E dans ce diagramme ? Déterminer (en la justifiant) la variance d'un système à l'équilibre à cette température et à cette composition. BZ*e. Un mélange de traction atomique en carbone égale à 0,25 (teneur atomique égale à 25%) est refroidi progressivement de 2800 K à 300 K. Décrire ce qui se passe sur une courbe thermique où l'évolution de la température T sera tracée en fonction du temps t, en précisant la nature des phases apparues ou disparues à chaque rupture de pente. BZ*f. Montrer qu'à 300 K, le mélange de fraction atomique en carbone égale à 0,25 (teneur atomique égale à 25%) est composé de graphite et d'une solution solide qui peut être décrite par la formule B4C. Quelles sont les quantités de graphite et de B4C présentes à 300 K dans 100 moles d'atomes dans cet échantillon de teneur égale à 25% ? Tournez la page S.V.P. BZ*g. Calculer la variance d'un système à l'équilibre au point F. En déduire l'allure de la courbe thermique correspondant au refroidissement d'un liquide dont la composition est celle de F. Température (K) F 4 2763 ------------------------ A \ 3 E B B + Graphite bore + p 0 10 2° 30 40 / 100 2348 ' Teneur atomique de carbone en % Zoom : 2346 Figure 2 TROISIEME PARTIE: UTILISATION DU BORE DANS UN AGENT DE BLANCHIMENT Les lessives classiques contiennent de nombreux agents de blanchiment dont certains oxydants. II s'agit le plus souvent de perborate de sodium tétrahydraté de formule : Na803, 4H20. Ce composé est stable à température ambiante mais s'hydrolyse à 60°C en libérant du peroxyde d'hydrogène H202 qui est l'agent réel de blanchiment. C'est «l'oxygène actif » que vantent de nombreuses publicités. Rappelons que le bore est moins électronégatif que l'oxygène. _ç_1; Ecrire le schéma de Lewis en admettant le squelette 0800. Quels sont les nombres d'oxydation des éléments dans l'ion perborate ? C2 Ecrire la réaction d'oxydo-réduction conduisant à la formation du peroxyde d'hydrogène H202, sachant que NaBO;, est réduit en NaBOZ. (dans les questions suivantes, il ne sera pas tenu compte de l'acidité de H202) C3 Exprimer le potentiel de Nernst du couple Oz(g,/HZOZ(aq). En déduire le potentiel du couple en fonction du pH obtenu en prenant p02 = 1 bar et [H202] = 1 mol.L". C4. Exprimer le potentiel de Nernst du couple H202(aq)leO. En déduire le potentiel du couple en fonction du pH obtenu en prenant [H202] = 1 mol.L". _çâ._ Tracer l'allure du diagramme potentiel-pH relatif aux couples du peroxyde d'hydrogène. C6. Montrer que le peroxyde d'hydrogène H202 peut se dismuter. Ecrire l'équation-bilan de la réaction. Le perborate de sodium contenu dans une lessive en poudre libère du peroxyde d'hydrogène qui est dosé rapidement par un oxydant de façon à pouvoir négliger la dismutation du peroxyde d'hydrogène. Le protocole du dosage est le suivant : dans un bécher de 150 mL, préparer une solution de lessive en dissolvant 2,00 g de cette lessive pesé avec précision dans 50 mL d'eau distillée. Ajouter ensuite 5 mL d'acide sulfurique à la concentration 5,0 mol. L". Chauffer le mélange à 60°C pendant 5 minutes. Le perborate donne quantitativement le peroxyde d'hydrogène. Ce dernier est dosé rapidement par du sulfate de cérium (IV) acidifié dont la concentration est égale à 0,100 mol.L". Le dosage est suivi par potentiométrie. Les courbes donnant la différence de potentiel (ddp) aux bornes de deux électrodes judicieusement choisies en fonction du volume de sulfate de cérium (I V) ainsi que la courbe dérivée première sont représentées sur la figure 3. ddp (mV) 1200 1000 800 600 400 200 0 0 20 40 60 Figure 3 _ç_7_._ Ecrire la réaction de dosage. Calculer sa constante d'équilibre à 298 K. Le dosage est-il quantitatif ? _çâ Décrire le montage nécessaire pour effectuer ce montage potentiométrique. Quelles sont les électrodes généralement utilisées ? ç_g Calculer la quantité de peroxyde d'hydrogène dosé. En déduire la quantité de borate dosé et le pourcentage massique de borate hydraté présent dans cette lessive. C10 Pourquoi préférer le perborate de sodium au peroxyde d'hydrogène pour fabriquer une lessive ? _Ç_1_1_. Quel est le nom usuel donné à la solution aqueuse de peroxyde d'hydrogène ? Tournez la page S.V.P. QUATRIEME PARTIE : UTILISATION DU BORE EN CHIMIE ORGANIQUE Cette partie décrit la synthèse de la bervastatine, molécule de la famille des statines. Les statines sont des médicaments hypocholestérolémiants qui font baisser le taux de cholestérol dans le sang. Cette synthèse met en jeu une étape clé diastéréosélective utilisant un dérivé du bore comme agent diastéréodirecteur efficace sur les hydroxycétones. Cette réaction est étudiée en QQ. Les composés seront notés entre crochets. Le phénol [ 1] réagit avec l'anhydride éthanoïque [2], en présence de pyridine [3]. Après agitation et chauffage à 80°C, le composé [4] est obtenu selon le bilan. ' @--;»+ JUL fi_....©... [2] Le composé [4] présente en RMN 1 H un multiplet a 7,91 ppm intégrant 5 protons et un singulet à 2,59 ppm intégrant 3 protons. D1*a. Préciser la structure de [4] en interprétant le spectre RMN. D1*b. Nommer la réaction mise en jeu et donner le mécanisme de la formation de [4]. D1*c. Quel est le rôle de la pyridine '? D1*d. Cette réaction ne peut pas être facilement réalisée avec l'acide éthanoïque et une catalyse par l'acide sulfurique. Expliquer pourquoi. Le chauffage de [4] en présence de chlorure d'aluminium AIC/3 conduit au composé [5] dont la structure est donnée ci--dessous : OH O AICI3 [4] ------> A [5] DZ*a. Donner le schéma de Lewis de AICI3. Quel est son rôle dans la réaction ? DZ*b. Quel est le type de réaction mis en jeu dans la synthèse de [5] ? D2*c. Rappeler le mécanisme de la réaction d'acylation du benzène par l'anhydride éthanoïque en présence de chlorure d'aluminium. DZ*d. En déduire un mécanisme pour la réaction de formation de [5]. Opposé à la cyclopentanone [6] en présence de pyrrolidine [ 7] dans le toluéne a ref/ux, le composé [5] conduit a la molécule tricyclique [8]. Le mécanisme de cette étape n'est pas demandé. 0 [8] D3. Qu'appelle--t--on chauffer à reflux ? Comment choisir la température de chauffage ? Le composé [9] est opposé à du magnésium dans le diéthoxyéthane anhydre. Le dérivé [10] est alors obtenu : Et20 F Br +Mg --------> [10] [9] D4*a. Préciser la structure de [1 O]. Justifier la sélectivité de la réaction. D4*b. Expliquer la nécessité de travailler dans des conditions anhydres. D4*c. Représenter le montage nécessaire à cette synthèse. Une solution de [8] dans le diéthoxyéther est ajoutée goutte à goutte à [ 10]. D5*a. Ecrire la formule semi--développée du composé [11] obtenu après hydrolyse en milieu acide. 05*b. Proposer un schéma mécanistique qui rende compte de la formation de [11]. Chauffé avec de l'acide paratoluène sulfonique [ 12] en quantité catalytique, [11] conduit à [ 13]. D6*a. Expliquer le caractère acide de [12], dont la structure est donnée ci-dessous : il [12] --.----|s|---- OH o D6*b. Ecrire la formule semi--développée de [13], puis donner son mécanisme de formation. Après une étape admise, [13] est transformé en [ 14] dont la structure est donnée : F [1 4] Le cétoester [ 15] est traité par I'hydrure de sodium NaH pour donner régiosélectivement un monoanion [ 16]. Ce dernier est traité à - 78 °C avec du buty/Iithium pour donner un dianion [17]. ---------> monoanion ""'--T' dianion Ha "I) [15] Tournez la page S.V.P. D7*a. L'hydrure de sodium NaH est conservé sous la forme d'une suspension dans de l'huile. Pourquoi faut-il le conserver et l'utiliser dans des conditions anhydres et aprotiques ? Avant utilisation, la suspension est lavée par du pentane. Quel est le rôle de ce lavage ? D7*b. Montrer que les deux atomes d'hydrogène Ha et Hb du cétoester [15] sont acides. D7*c. Ecrire la réaction de formation de [16]. Expliquer la régiosélectivité de la réaction. Donner la structure de [17]. D7*d. Pourquoi ne pas utiliser directement deux équivalents de butyllithium pour former le dianion ? Le dianion [17] est opposé au composé [ 14] pour donner, après hydrolyse, le produit [ 18]. Cette réaction n'est pas stéréosélecfive et une séparation des stéréoisomères est nécessaire. La synthèse se poursuit avec le stéréoisomère [ 18] représenté ci--dessous : F [1 8] D8*a. Expliquer la réactivité du dianion et donner un schéma mécanistique qui rende compte de la formation de [18]. D8*b. Donner la configuration absolue de l'atome de carbone asymétrique. La réduction de l'hydroxycétone [ 19] a été observée avec de bons rendements et une excellente diastéréosèlecflvüé en utilisant le diéthylméthoxyborane noté DEMB comme agent diastéréodirecteur. OH o 0/ l DEMB : B ___--\/____\_/__, [20] diol syn 98 %, achiral N diol anti 2 %, chiral aBH4 [1 91 Le rotoco/e ex érimental est le suivant : A une millimole de I'hydroxycétone [ 19] dans 8 mL de THF(so/vant) sec et 2 mL de méthanol sec à - 70 °C sous atmosphère inerte, il est ajouté goutte à goutte 1,1 millimole de diéthylméthoxyborane DEMB. La solution est alors agitée pendant 15 minutes. Puis 1,1 millimo/e de tétrahydruroborate (borohydrure) de sodium NaBH., est introduite avant de laisser agiter pendant 5 heures. Ensuite 1 mL d'acide éthanol'que est ajouté. La solution ainsi obtenue après acéto/yse (l'acétonse est l'action de l'acide éthanol'que) est diluée dans l'acétate d'éthyle, puis lavée avec de l'hydrogènocarbonate (bicarbonate) de sodium. Enfin, la phase organique est séchée sur du sulfate de magnésium puis évaporée à l'évaporateur rotatif. Une purification par chromatographie sur colonne permet d'obtenir 223 mg du dio/ [20] souhaité (syn et anti). Par ailleurs, la formation des dio/s est suivie par chromatographie sur couche mince. Au début, au milieu et vers la fin de la réaction, les fronts suivants de diffusion sont observés (figure 4) sur des plaques de silice avec un éluant composé d'un mélange d'acétate d'éthyle et de méthanol dans les proportions 90/10. _ _ _ (___ Front de solvant @ 0 Figure 4 O O _ _ _ début milieu fin D9*a. Rappeler le schéma mécanistique de la réaction du tétrahydrur0borate de sodium sur un dérivé carbonylé. D9*b. Dessiner les stéréoisomères de [20] obtenus par réduction de [19]. Indiquer les relations de stéréoisomérie entre eux. D9*c. En déduire la structure du diol achiral syn [20] majoritaire et donner la configuration absolue de ses atomes de carbone asymétriques. D9*d. Proposer un autre réducteur que le tétrahydrur0borate de sodium NaBH4 utilisé pour réduire les dérivés carbonylés. Est-il utilisable pour réduire la fonction cétone de [18] ? D9*e. Rappeler le principe d'une chromatographie sur couche mince. Pourquoi y a-t--il deux taches sur la plaque du milieu ? Comment interpréter leurs positions relatives ? D9*f. Comment révéler simplement la plaque ? D9*g. Calculer le rendement de la synthèse de [20] sachant que la masse molaire moléculaire de [20] est égale à 228 g.mol". Le dérivé [ 18] est engagé dans les conditions de Q_9_ pour obtenir la bervastatine. DONNEES NUMERIQUES Données générales RTE 10 , Constante d'Avogadro : o/i£ = 6,02.1O23 mol"1 -----â"---- = 0,06 v a 298K Constante des gaz parfaits : R = 8,314 J.K'Ïmol'1 Elément Masse Rayon ou composé Formule Z molaire atomique . .mol' °m Bore 5 10,8 85 Triox de de dibore H dro-ène Carbone Ox oène Sodium Aluminium _; O 7 0 12,0 16,0 23,0 27,0 _>_ CD ...-L ---\ .--\ .--L Tournez la page S.V.P. 10 Données thermodynamiques : (supposées indépendantes de T) Enthalpie standard de formation Capacité oalorifique molaire Tem-érature de fusion K 2348 Enthalpie standard de fusion A...SH° (kJ.mol'1) 502 22.0 Tem-érature d'ébullition K 4273 2133 Enthalpie standard de vaporisation AvapH° (kJ.mol") 48...) 3222 Données électrochimiques : (à 298K) H*/ H2 Ce" / Ce3* ... Données RMN (en gras) en . .m (en gras) en . .m ... FIN DE L'EPREUVE