CCINP Chimie 1 PC 2008
| Thème de l'épreuve | Synthèse du Linderol-A |
| Principaux outils utilisés | chimie organique, thermochimie, diagrammes binaires, polymères, oxydoréduction |
| Mots clefs | Linderol, binaire eau-éthanol, complexes du cuivre, cuivre, polymérisation du polyéthylène, polyéthylène |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Rapport du jury
(télécharger le PDF)
Énoncé obtenu par reconnaissance optique des caractères
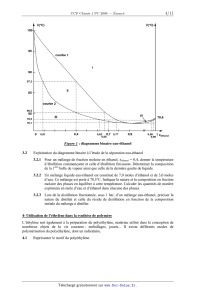
av.--:o: @ " mm.--fifi .... H...-->HOEO o.... ËmfiE - m=oE...oaä ËËÈ ......=a_z=V...-->dcoe ...::OEc--Qu ...oe=ouzau ' Les calculatrices sont autorisées N.B. Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre. Dans chaque partie, de nombreuses questions sont indépendantes. Toutes les données utiles sont rassemblées à la fin du sujet. Des représentations simplifiées des molécules pourront être utilisées pour l'écriture des mécanismes réactionnels en chimie organique. On étudie dans ce problème une voie d'accès à une molécule naturelle, le (-)-Linderol A, aux propriétés inhibitrices de la biosynthèse de mélanine. Cette molécule présente un squelette comparable à celui proposé pour l'Adunctine E. Cette dernière molécule est isolée des feuilles de Piper aduncum L. (plante de la famille des Piperaceae à laquelle appartient le poivrier) et est utilisée dans la médecine traditionnelle de plusieurs régions du monde pour ses propriétés hémostatiques et anti-bactériennes. OMe 1 11 13 12 3 HO OMe H 7 4 5 O 1' 2' O 3' H 8 OH Me Ph (-)-Linderol A R13 H 1 11 12 R5O 7 8 H MeOH 11 12 3 HO 4 5 O schématisation du cycle à 6 atomes C7-C12 du (-)-Linderol A H 13 O 7 8 H Me OH Ph Structure proposée pour l'Adunctine E La première synthèse du (±)-Linderol A a été publiée par S. Ohta de la Faculté de Pharmacie de Kyoto. Le précurseur est le 4,6-diméthoxysalicylaldéhyde 1. Seules quelques étapes de cette synthèse sont étudiées dans ce problème. 1- Stéréochimie du Linderol A 1.1 Le (-)-Linderol A est-il une molécule chirale ? Justifier votre réponse. 1.2 Combien de centres asymétriques possède le (-)-Linderol A ? Donner la configuration absolue des centres C7, C8 et C11 en justifiant votre réponse. 1/11 1.3 Etude conformationnelle On étudie la conformation de type chaise du cycle à 6 atomes, C7-C12, du (-)-Linderol A , sans tenir compte de l'influence des deux autres cycles sur cette conformation. On note les substituants des atomes C7 et C12, respectivement OR5 et -R13 (voir page 1). 1.3.1 Représenter, en perspective, la conformation de type « chaise » du cyclohexane (toutes les liaisons du cyclohexane seront clairement représentées). 1.3.2 Représenter, en perspective, la conformation de type « chaise » du cycle à 6 atomes de carbone, C7-C12, en indiquant clairement la position des principaux groupes substituants ainsi que la chaise dite « inverse » en équilibre conformationnel avec la précédente. 2- Formation de l'éthanol L'éthanol est un réactif mais aussi un solvant couramment utilisé en chimie organique comme dans la synthèse du Linderol A. Il est possible de fabriquer industriellement l'éthanol par hydratation de l'éthylène (ou éthène), issu du vapocraquage d'hydrocarbures, en présence d'un catalyseur acide (procédé Shell). Cette réaction conduit à un équilibre noté (1), de constante d'équilibre K1q : K1q H2C=CH2 (g) + H2O (g) CH3-CH2OH (g) (1) On introduit initialement, à une température fixée à 400 K et sous une pression maintenue à 1 bar, une mole d'éthylène gazeux et une mole d'eau gazeuse. On note D la fraction d'éthylène transformée à l'équilibre. 2.1 Exprimer la constante d'équilibre K1q en fonction de D. 2.2 On se place dans l'approximation d'Ellingham. On donne, à 298 K, les enthalpies molaires standard de formation ' f Hq et les entropies molaires standard Sqm : Composé ' f Hq (en kJ.mol-1) Éthylène gazeux Éthanol gazeux Eau gazeuse 52,3 -235,1 -241,8 Sqm (en J.K-1.mol-1) 220 283 189 2.2.1 Enoncer l'approximation d'Ellingham. 2.2.2 Ecrire l'équation de la réaction de formation de l'éthylène gazeux en précisant les états physiques des espèces chimiques mises en jeu. 2.2.3 Calculer, à partir des données, l'enthalpie libre standard ' r G1q de la réaction (1) à 400 K. 2.2.4 En déduire la valeur à 400 K de la constante d'équilibre K1q ainsi que celle de D. 2.3 Influence de paramètres physico-chimiques sur l'équilibre de formation de l'éthanol 2.3.1 Quelle est l'influence d'une augmentation de température sur l'équilibre (1) à pression et composition fixées ? Justifier succinctement votre réponse. 2/11 2.3.2 Quelle est l'influence d'une augmentation de pression sur l'équilibre (1) à température et composition fixées ? Justifier succinctement votre réponse. 2.3.3 Calculer l'affinité chimique du système à 400 K pour des pressions partielles initiales en éthylène et eau de 0,5 bar chacune et une pression partielle en éthanol de 10-3 bar. Conclure sur l'évolution du système. 2.4 Elévation maximale de température dans le réacteur On souhaite évaluer la variation de température maximale, 'Tmax, pouvant être observée à l'intérieur d'un réacteur. Ce réacteur est supposé adiabatique, la pression totale étant maintenue constante à 1 bar. On introduit initialement, à 400 K, dans ce réacteur, une mole d'éthylène gazeux et une mole d'eau gazeuse. La réaction de formation de l'éthanol est supposée dans cette question comme étant totale. , vaut On suppose que la capacité thermique totale à pression constante du réacteur, C(réacteur) p 500 J.K-1, la capacité thermique molaire standard à pression constante de l'éthanol, Cqp (éthanol) , étant prise égale à 65 J.K-1.mol-1. 2.4.1 Quelle fonction d'état, U, H, F, G, S, reste constante au cours de la transformation ? Justifier votre réponse. 2.4.2 Exprimer littéralement la relation entre la variation de température, 'Tmax, l'enthalpie standard de réaction à 400 K et les capacités à pression constante du réacteur et de l'éthanol. 2.4.3 Calculer la variation maximale de température 'Tmax. 3- Diagramme binaire liquide-vapeur eau-éthanol En vue d'étudier la séparation eau-éthanol par distillation fractionnée, le diagramme binaire isobare liquide-vapeur est représenté à la Figure 1 sous une pression P° = 1 bar, avec en abscisse la fraction molaire en éthanol, xéthanol, et en ordonnée la température, T, exprimée en degré Celsius : 3.1 Construction du diagramme binaire liquide-vapeur eau-éthanol 3.1.1 D'après l'allure du diagramme binaire, indiquer si la miscibilité est nulle, partielle ou totale. 3.1.2 Le mélange liquide eau-éthanol peut-il être considéré comme idéal ? Justifier. 3.1.3 Nommer les courbes (1) et (2). Pour chacune de ces deux courbes, indiquer s'il s'agit d'une relation entre la température et la fraction molaire en éthanol liquide ou celle en éthanol vapeur. 3.1.4 Indiquer le nombre et la nature des phases en présence dans les domaines I à IV. 3.1.5 Un point remarquable apparaît sur le diagramme binaire liquide-vapeur eau-éthanol pour une fraction molaire en éthanol, xéthanol = 0,9. Nommer ce point. Quelle est la propriété physique remarquable du mélange correspondant ? 3.1.6 Représenter l'allure des courbes d'analyse thermique isobare de refroidissement pour des fractions molaires en éthanol respectivement de 0 ; 0,4 ; 0,9 ? Justifier votre réponse par un calcul de variance pour cette dernière courbe d'analyse thermique. 3/11 T(°C) T(°C) 100 95 courbe 1 I 90 87,2 II 85 courbe 2 80,5 80 IV III 78,5 78,1 0 0,91 0,4 0,7 0,62 0,68 0,77 0,9 78,6 0,98 1 0,99 xéthanol Figure 1 : diagramme binaire eau-éthanol 3.2 Exploitation du diagramme binaire à l'étude de la séparation eau-éthanol 3.2.1 Pour un mélange de fraction molaire en éthanol, xéthanol = 0,4, donner la température d'ébullition commençante et celle d'ébullition finissante. Déterminer la composition de la 1ière bulle de vapeur ainsi que celle de la dernière goutte de liquide. 3.2.2 Un mélange liquide eau-éthanol est constitué de 7,0 moles d'éthanol et de 3,0 moles d'eau. Ce mélange est porté à 78,5°C. Indiquer la nature et la composition en fraction molaire des phases en équilibre à cette température. Calculer les quantités de matière exprimées en mole d'eau et d'éthanol dans chacune des phases. 3.2.3 Lors de la distillation fractionnée, sous 1 bar, d'un mélange eau-éthanol, préciser la nature du distillat et celle du résidu de distillation en fonction de la composition initiale du mélange à distiller. 4- Utilisation de l'éthylène dans la synthèse de polymère L'éthylène sert également à la préparation du polyéthylène, matériau utilisé dans la conception de nombreux objets de la vie courante : emballages, jouets... Il existe différents modes de polymérisation du polyéthylène, dont un radicalaire. 4.1 Représenter le motif du polyéthylène. 4/11 4.2 Qu'appelle-t-on polymère linéaire ? Ramifié ? 4.3 Proposer un exemple d'initiateur de radical et préciser sa représentation topologique. 4.4 On propose ci-dessous un mécanisme simplifié de la polymérisation radicalaire de l'éthylène, noté M, en présence d'un initiateur de radical, noté I2. I Mxj est un radical carboné contenant j monomères M : ki I2 I + M I-Mj + M + I-Mi I-Mj 2I ka I-M1 kp I-Mj+1 kt I-Mj+i-I pour j compris entre 1 et n-1 pour j et i compris entre 1 et n 4.4.1 Exprimer la vitesse d'amorçage va en fonction de ki et [I2]. 4.4.2 Etablir les équations résultant de l'application de l'approximation de l'état quasistationnaire au radical I M1x et I Mxj . n 4.4.3 Evaluer ¦ ª¬I M xj º¼ en supposant que le degré de polymérisation est très grand. j 1 4.4.4 Dans le cadre de l'approximation des chaînes longues, établir l'expression de la vitesse globale de disparition du monomère M ou vitesse de polymérisation. 5- Synthèse du Linderol A On étudie dans cette partie quelques étapes-clé de la synthèse d'un intermédiaire 5 ainsi que celle du Linderol A. L'intermédiaire 5 est obtenu en quatre étapes représentées ci-dessous : OCH3 OCH3 OCH3 CHO CO2CH2CH3 H CO2CH2CH3 CH3O OH CH3O 1 O O CH3O 2 O 3 OCH3 OH H CO2CH2CH3 3 O CH3O H H 5 O 4 5.1 Le malonate de diéthyle, de formule brute C7H12O4, est utilisé comme réactif principal pour la transformation 1 : 2. 5.1.1 Calculer le nombre d'insaturations du malonate de diéthyle. 5/11 Le spectre IR du malonate de diéthyle a été effectué sur pastille de KBr anhydre. Il présente, entre autre, des bandes caractéristiques vers 2950 et 1735 cm-1. 5.1.2 Attribuer les bandes de vibration correspondant à ces valeurs. Le spectre RMN 1H (200 MHz) du malonate de diéthyle réalisé dans CDCl3 est le suivant : Déplacement chimique 1,3 3,4 4,2 Multiplicité Triplet Singulet Quadruplet Intégration 3H 1H 2H 5.1.3 Attribuer les signaux de ce spectre ; justifier leur multiplicité ainsi que le nombre de massif obtenu. 5.1.4 En déduire la représentation topologique du malonate de diéthyle. 5.2 On étudie la réactivité du malonate de diéthyle sur un aldéhyde aromatique tel que le vératraldéhyde 6, issu de la vanilline 7 (arôme naturel contenu dans les gousses de vanille) de structure topologique représentée ci-dessous. O CH3O O H CH3O H CH3O HO vanilline 7 CO2Et CH3O CO2Et CH3O vératraldéhyde 8 6 5.2.1 Décrire succinctement une méthode adaptée à l'extraction de composés organiques naturels tels que ceux contenus dans les gousses de vanille. 5.2.2 Comment analyser qualitativement le mélange issu de l'extraction ? 5.3 La vanilline 7 est traitée par de l'iodométhane en présence de carbonate de potassium, K2CO3, de pKA (HCO3-/CO32-) = 10,2, pour conduire au vératraldéhyde 6. 5.3.1 Quelle est l'action du carbonate de potassium sur la vanilline 7 ? 5.3.2 Nommer la fonction chimique formée lors de la transformation de la vanilline 7 en vératraldéhyde 6. Proposer un mécanisme pour cette réaction. 5.4 L'action du malonate de diéthyle sur le vératraldéhyde 6, en présence d'éthanolate de sodium, conduit à un composé 8' de formule brute C16H22O7 non isolé, qui se transforme in situ en 8. 5.4.1 Représenter la structure topologique du composé 8' et proposer un mécanisme pour sa formation. 5.4.2 Par analogie avec la réactivité en D des fonctions carbonyles, proposer un mécanisme pour la transformation de 8' en 8. 5.4.3 Est-il possible de transformer dans les mêmes conditions que celles appliquées au vératraldéhyde 6, le 4,6-diméthoxysalicylaldéhyde 1 ? Justifier votre réponse. 6/11 5.5 Pour la transformation 2 : 3, le DMSO ou diméthylsulfoxyde de formule brute C2H6SO est traité par l'iodométhane pour donner un solide ionique 9, de formule brute C3H9SOI. 9 en suspension dans le DMF et en présence de NaH conduit à un composé moléculaire 10. 5.5.1 Ecrire une représentation de Lewis du DMSO. On rappelle que l'oxygène et le soufre sont dans la même colonne de la classification périodique. 5.5.2 Prévoir, à l'aide de la théorie VSEPR, la géométrie autour de l'atome central de soufre du DMSO. 5.5.3 Proposer une structure topologique du solide ionique 9 ainsi qu'un mécanisme pour sa formation. 5.5.4 En déduire une structure possible du composé moléculaire 10 par analogie avec la formation du réactif de Wittig. Ecrire l'équation-bilan de la transformation 9 : 10. 5.6 La transformation 3 : 4 met en jeu, entre autre, la réactivité du chlorure de phénylsélénium, PhSeCl, sur le composé 3. 5.6.1 Le composé 3 est en équilibre avec 3'. Représenter 3'. Nommer cet équilibre. 5.6.2 Justifier que 3 soit majoritaire devant 3'. 5.7 Lors de la transformation 4 : 5, le bromure d'isopropylmagnésium, (CH3)2CH-MgBr, en présence de CuI et du complexe BF3.Et2O, se comporte comme un diorganocuprate lithié réagissant sur la fonction D,E-énone du composé 4. 5.7.1 Rappeler les précautions expérimentales à prendre lors de la formation d'un organomagnésien. Ecrire les équations-bilan des réactions secondaires possibles. 5.7.2 Proposer une représentation de Lewis de BF3 et prévoir sa géométrie d'après la théorie VSEPR (on rappelle que le bore a pour numéro atomique 5, le fluor 9). 5.7.3 Justifier qu'il s'agit d'un acide de Lewis. En déduire la structure du complexe noté BF3.Et2O. 5.7.4 Proposer une structure du composé 5, obtenu après hydrolyse (la stéréochimie du composé 5 n'est pas exigée). 5.8 L'intermédiaire 5 est ensuite traité par une solution aqueuse de soude dans le méthanol et conduit à 11 après hydrolyse acide. Le chauffage prolongé de 11 dans l'acide éthanoïque permet d'obtenir le composé 12, dont la formation s'accompagne d'un dégagement gazeux. 5.8.1 Représenter la structure topologique de 11. Préciser le mécanisme mis en jeu lors du passage 5 : 11. 5.8.2 Par analogie avec la synthèse malonique, proposer une structure du composé 12, formé lors du chauffage prolongé de 11 dans l'acide éthanoïque. Quelle est la composition du gaz formé ? 5.8.3 Préciser le mécanisme mis en jeu lors du passage 11 : 12. 7/11 5.9 L'agrandissement du cycle à 5 du composé 12 en cycle en 6 du composé 13, représenté ciaprès, n'est pas détaillé. Le composé 13 est transformé en 14. L'action sur 14 de tétraoxyde d'osmium, OsO4, en présence de N-méthyl-morpholine N-oxyde conduit à 15. Ce dernier composé 15 est ensuite traité dans la propanone en présence d'une quantité catalytique d'acide para-toluène sulfonique ou APTS pour obtenir 16. OCH3 OCH3 H H 12 16 CH3O O O CH3O H 8 13 O H 14 5.9.1 Proposer un réactif permettant d'effectuer la transformation directe 13 : 14. Préciser le nom de la réaction correspondante. 5.9.2 Ecrire la formule topologique du composé 15 sans préciser sa stéréochimie. 5.9.3 Ecrire la formule topologique du composé 16. Proposer un mécanisme pour sa formation à partir de 15. Quel est l'intérêt d'utiliser la propanone en tant que solvant ? 5.10 L'action du chlorure d'éthanoyle en présence de chlorure d'aluminium, AlCl3, sur 16 conduit au composé 17. Ce dernier est ensuite transformé en 18, représenté ci-après, à la question 5.11. 5.10.1 Représenter la structure du composé 17, sans justifier la régiosélectivité de la réaction, au vu de la structure du Linderol A. 5.10.2 Ecrire le mécanisme de la réaction entre le chlorure d'éthanoyle et le benzène en présence de chlorure d'aluminium, AlCl3. Quelle quantité de chlorure d'aluminium, AlCl3, doit-on utiliser pour effectuer cette transformation ? Justifier votre réponse. 5.10.3 Qu'est-ce qu'une réaction d'hydrolyse ? Quel est l'intérêt d'effectuer cette opération à la suite de la réaction précédente ? 5.10.4 Proposer des conditions expérimentales (réactifs, catalyseur, solvant) pour effectuer la transformation 17 : 18. 5.11 La fin de la synthèse met en jeu les étapes suivantes à partir du composé 18 issu de 17 : OCH3 CH3O O O OCH3 H H CH3 OH OH CH3O O O OCH3 H H CH3 OH O-Ts CH3O O O CH3 2' 18 19 -Ts = O S O 8/11 20 CH3 H H OH Me 5.11.1 Justifier simplement la régiosélectivité observée lors de la transformation de 18 : 19 par action du chlorure de tosyle, Ts-Cl, et en présence de triéthylamine, Et3N ? Par analogie avec la réaction d'acylation d'un alcool, proposer un mécanisme pour cette réaction. 5.11.2 Indiquer la nature des réactifs permettant l'augmentation de la chaîne carbonée en C2' du composé 20 afin d'obtenir celle du Linderol A. 6- Etude du cuivre et de sa chimie en solution aqueuse Le catalyseur utilisé lors de la transformation de 4 en 5 est l'iodure cuivreux, CuI. Nous étudions dans cette question quelques aspects de la chimie du cuivre. 6.1 Ecrire la configuration électronique du cuivre, 29Cu. On rappelle que cet élément désobéit à la règle empirique de Klechkowsky. En déduire son nombre d'électrons de valence. 6.2 A quelle famille d'éléments de la classification périodique appartient le cuivre ? 6.3 Le cuivre métallique cristallise dans un réseau cubique. Le paramètre de la maille conventionnelle cubique, noté a, vaut 362 pm. La densité du cuivre est de l'ordre de 9, sa masse molaire de 63,5 g.mol-1. 6.3.1 Vérifier à partir de ces données qu'il s'agit d'un réseau de type cubique faces centrées. 6.3.2 En déduire alors une valeur du rayon métallique du cuivre ainsi que la coordinence de chaque atome de cuivre. 6.3.3 Calculer la compacité du cuivre. 6.4 Usuellement, les sels de cuivre sont éliminés d'un milieu organique par lavage avec une solution aqueuse ammoniacale. On étudie le diagramme E-pNH3 afin de déterminer sous quelle forme le cuivre se trouve dans ce type de solution. On ne considère que les espèces suivantes : 2 et Cu(NH3 ) 24(aq) Cu(s), Cu(NH3 ) 2(aq) , Cu (aq) Ce diagramme est établi pour une concentration totale en cuivre égale à 1,0 mol.L-1, à une température fixée à 298 K. E/V 0,8 A B (3) 0,4 C (2) -0,15 0 D (1) 0,09 2 4 9/11 6 8 pNH3 6.4.1 Attribuer à chacun des domaines, repérés par une lettre de A à D, une des espèces du cuivre ci-dessus considérées. Justifier votre réponse par un calcul de nombre d'oxydation. 6.4.2 Sachant que la frontière verticale entre les domaines A et B vaut pNH3=3,15, en 2 déduire la valeur de la constante de formation globale du complexe Cu(NH3 ) 4(aq) , notée E1 , liée à l'équilibre suivant : 2 Cu (aq) + 4 NH3 E1 2 Cu(NH3 ) 4(aq) Déterminer les valeurs des pentes des segments de droite (1), (2) et (3). 6.4.3 La lecture de l'ordonnée à l'origine du segment de droite (1) donne 0,15 V. En déduire la valeur de la constante de formation globale du complexe Cu(NH3 ) 2(aq) , notée E2 , liée à l'équilibre suivant : Cu (aq) + 2 NH3 E2 Cu(NH3 ) 2(aq) 6.4.4 Calculer, à 298 K, le pH d'une solution aqueuse d'ammoniac, NH3, de concentration molaire voisine de 1 mol.L-1. Justifier les approximations éventuelles. 6.4.5 Sous une pression partielle en dioxygène fixée à 0,2 bar, en déduire le potentiel du couple O2/H2O dans cette solution aqueuse d'ammoniac de concentration molaire de 1 mol.L-1. 6.4.6 En déduire, sous quelle forme se trouvent les ions du cuivre en solution aqueuse lors du traitement d'une phase organique par une solution aqueuse d'ammoniac à la concentration de 1 mol.L-1. 10/11 Données thermodynamiques à 298 K R.T.ln(10) = 0,06 V F Potentiels standard d'oxydoréduction à pH = 0 : Cu+ / Cu(s) Cu2+ / Cu(s) couple E° (en V) 0,52 0,34 O2 (g) / H2O 1,23 Produit ionique de l'eau : pKe = 14,0 ; Constante d'acidité : pKa( NH 4(aq) / NH3(aq) ) = 9,3 Constante d'Avogadro : 6,02 . 1023 mol-1 ; Constante des gaz parfaits : R = 8,31 J.K-1.mol-1 ; Données spectrales RMN 1H : gamme de déplacements chimiques : G ppm CH3-C 0,9-1,3 -CH2-CO2,0-3,0 R-COOCH3,7-4,5 -CH2OR 4,7-6,2 INFRAROUGE : nombres d'onde de vibration de quelques groupes fonctionnels Groupe fonctionnel OH CH alcane C=O cétone saturée C=O ester saturé X (cm-1) 3300-3600 2910-2970 1705-1725 1735-1750 Fin de l'énoncé 11/11