CCINP Chimie 1 PC 2003
| Thème de l'épreuve | Quatre problèmes de chimie et applications pratiques |
| Principaux outils utilisés | orbitales moléculaires, diagrammes binaires, électrochimie, chimie organique |
| Mots clefs | sarcomycine, diagramme de corrélation |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Énoncé obtenu par reconnaissance optique des caractères
A
SESSIONZOOB CONCOURS (OMMUNS POLYTECHNIO'UES PCCH108
EPREUVE SPECIFIQUE -- FILIERE PC
CHIMIE 1
Durée : 4 heures
Les calculatrices sont autorisées.
Le "Document--Réponse" distribué avec le sujet doit être joint à la copie.
Les différentes parties sont indépendantes.
Mise en garde
Toute démonstration illisible ou incompréhensible sera considérée comme fausse.
Le candidat attachera la plus grande importance à la clarté, à la précision et
à la
concision de la rédaction.
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur
d'énoncé, il le
signalera sur sa copie et devra poursuivre sa composition en expliquant les
raisons des
initiatives qu 'il a été amené à prendre.
Données
° Données atomistiques
Numéros atomiques: ' ,.
C(Z=26);N(Z=7);O(Z=8);Mg(Z=12);V(Z=23);Cr(Z=24);Cu(Z=29
Masses atomiques : _
M(Mg) = 24,3 g.mol--1 ; M(Cu) : 63,5 g.mol*'
Constante d'Avogadro : NA = 6,02....23 mol--1
Coefficients de Slater :
Groupe
Contribution des autres électrons
de l'électron niveaux niveau autres électrons du niveau 11 niveaux
étudié n--2, n--3, 1 s et p "_ supérieurs
» 1,00 0,85 0,35 0 v '-
n __
:S
[
1,00 1,00 1,00 ' 0,35
1,00 1,00 1,00 0,35
, \ RT \ -
° Donnee a prendre en compte dans les calculs : ----15-- lnlO % 0,06 V a 18 °C
PARTIE I
Synthèse d'un antibiotique
La sarcomycine est un antibiotique dont la synthèse est proposée ci-dessous.
1.- Dans une première étape, le cyclopenta-l,3-diéne réagit avec le
prop--2-ènoate de méthyle selon
une réaction de Diels--Alder pour donner le produit A. '
+ /--ocn3 __> A
1.1.-- Ecrire la structure plane du composé A sans s'intéresser ici à sa
stéréochimie.
l.2.-- Sous combien de stéréoisomères de configuration peut exister ce composé
A,
indépendamment de la façon dont il est obtenu dans cette synthèse ?
l.3.-- Préciser, sur cet exemple, la notion de réaction stéréosélective.
1.4.-- Le cyclopenta--l,3-diène est modélisé par le buta--l,3-diène dont les
orbitales moléculaires
calculées par la méthode de Hückel, sont indiquées ci-après :
E1= a+ 1,685
E2 : a + 0,68fl
E3 = & ----- 0,68,B
E4 = a-- 1,685
% == 0,37ç01 + O,60ço; + 0,60(p3 + 0,37ç04
% = 0,60ç01 + 0,37(p2 -- 0,37ç03 -- 0,60ç04
% == 0,60ç01 -- O,37(p2 -- 0,37ç03 + 0,60ç04
% : 0,37ç01 -- 0,60ç02 + O,6O(p3 -- 0,37ç04
Pour le prop-2-ènoate de méthyle, dont la numérotation est indiquée ci--dessous
et pour
lequel le méthyle est considéré comme un hétéroatome à 2 électrons, les
orbitales
moléculaires selon Hückel sont les suivantes :
E1= a+ 2,77fl
E2= a+ 1,93fl
E3 : a+1,34fl
E4= a+ 1,005
E5= a--O,44fl
E6= a-- 1,605
à 6CH3
\\ O/
/ 2 5
% = 0,19ç01 + 0,33ç02 + 0,14(p3 + 0,05(p4 + 0,74ç05 + 0,54ç06
% = 0,48ça1 + 0,45ço2 + 0,32ç03 + 0,17ç04 + 0,08ç05 _ 0,65ç06
% = 0,45(p1 + 0,15ç02 + 0,26ç03 + 0,19ç04 _ 0,63ç05 + 0,53(p6
% : 0,58ç01 + 0,00çpz -- 0,58ç03 -- 0,58ç04 + 0,00ç05 + 0,00ç06
% = 0,38ç/)1 _ 0,54ç02 .. 0,29ç03 + 0,67(p4 + 0,19ç05 _ 0,04çp6
% = 0,24çp1 __ 0,61ço2 + 0,63æ3 _ 0,39(p4 + 0,14çp5 .. 0,02ç06
1.4.1.- Pour chaque molécule mise en jeu, indiquer quelles sont les orbitales
moléculaires
la plus haute occupée HO et la plus basse vacante BV.
1.4.2.-- Quelle est l'interaction HO--BV la plus importante ? Cette interaction
sera la seule
prise en compte dans la suite.
1.4.3.-- En admettant que le diène et le diènophile se rapprochent dans des
plans
parallèles, il y a deux modes d'approche possibles selon que le groupe --COZCH3
du diènophile se place en vis-à-vis du cycle du diène ou à l'extérieur de
celui-ci.
Représenter les interactions orbitalaires principales dans les deux cas et
montrer
que l'une des deux approches est plus favorable que l'autre.
En déduire le couple d'énantiomères majoritairement obtenu et le dessiner en
s'inspirant de la représentation donnée au paragraphe 4.3 de cette partie (voir
page 4).
2.-- Le composé A, ainsi obtenu, est mis en réaction avec le chloroacétate
d'éther ClCH2COZEt
(chloroéthanoate d'éthyle). En présence d'une base forte comme le LDA
(diisopropylamidure
de lithium) une réaction d'alkylation est observée.
2.1 .-- Montrer que la molécule A possède un hydrogène mobile.
2.2.- Donner la structure du produit B obtenu par cette alkylation ainsi que le
mécanisme mis
en jeu (la stéréochimie ne sera pas envisagée).
3.-
Obtention du composé C ,
Le composé B est mis en réaction, en milieu basique, avec le prop-2-ènoate de
méthyle.
3.l.- Mettre en évidence les sites électrophiles d'une oc-énone (molécule
possédant une double
liaison carbone-carbone conjuguée avec un groupe carbonyle (C=O)).
Donner un exemple de réaction d'un organocuprate lithié sur une oc-énone.
Indiquer le
produit obtenu et le mécanisme de sa formation.
3.2.-- La molécule B posséde un hydrogène mobile. En utilisant l'analogie de la
réaction des
organocuprates lithiés sur les oc--ènones, proposer un mécanisme pour la
réaction de
l'anion résultant de la déprotonation du composé B sur le prop-2--ènoate de
méthyle.
Donner la structure du produit C ainsi obtenu.
Obtention du composé D
4.1.-- Donner un exemple de réaction d'un organomagnésien sur un ester :
préciser la nature du
produit obtenu après hydrolyse ainsi que le mécanisme de sa formation.
4.2.- Montrer que la molécule C possède plusieurs atomes d'hydrogène mobiles.
4.3.- Le composé C subit une cyclisation en milieu basique pour conduire au
composé D dont
la structure est indiquée ci--dessous :
C02Et
C02MEUR
Cette cyclisation conduit préférentiellemefit à un cycle à cinq atomes. Donner
la structure du
carbanion qui par cyclisation sur l'un des groupes ester va conduire au composé
D.
4.4.-- Par analogie avec la réactivité des esters vis-à-vis des nucléophiles,
proposer un
mécanisme pour la réaction de cyclisation.
L'ester méthylique est sélectivement saponifié ; après passage en milieu acide,
le produit subit,
par chauffage, une décarboxylation. Indiquer la structure du composé E obtenu.
La réaction de Diels--Alder est une réaction inversable.
' 6.1.- Indiquer le signe de l'entropie standard de réaction ArS° pour une
réaction de Diels-Alder.
6.2.- Cette réaction est généralement exothermique ; montrer qu'il existe une
température au--
delà de laquelle la variation d'enthalpie libre standard est positive.
6.3.- La rétro--Diels-Alder, effectuée sur le composé E, donne deux produits :
le composé F et
du cyclopenta--l,3-diène. Donner la structure du composé F.
Le produit F subit une saponification, puis après passage en milieu acide, la
sarcomycine est
obtenue. Donner la structure de la sarcomycine. Combien de carbones
asymétriques la molécule
possède--t-elle ? Par cette synthèse, cet antibiotique est-il obtenu sous forme
d'un énantiomère
pur ou sous forme d'un mélange racémique ?
PARTIE II
Diagramme d'orbitales moléculaires pour une molécule diatomique
Rappeler la configuration électronique des atomes de carbone et d'oxygène.
Calculer l'énergie d'ionisation de ces deux éléments selon le modèle de Slater
; il est rappelé
que l'énergie associée à une orbitale atomique caractérisée par le nombre
quantique 11 se met
z*2
2
ïl
sous la forme : E = --13,6.
en eV, Z * étant le numéro atomique effectif.
Construire le diagramme d'orbitales moléculaires pour la molécule 02 ; seules
seront prises en
compte les orbitales atomiques de valence.
Remarque : dans le cas de la molécule de dioxygène, les orbitales atomiques se
combinent deux
à deux avec une bonne approximation ; en particulier, il n'y a pas lieu
d'envisager d'interaction
entre l'orbitale 2s de l'un des atomes et l'une des orbitales 2p de l'autre.
Cette molécule est--elle paramagnétique ou diamagnétique '?
Calculer les indices de liaison pour la molécule 02 et pour les ions
moléculaires 05, O[ et O+ ,
sachant que l'indice de liaison, dans le cas d'une molécule homonucléaire
diatomique, peut être
N. -- N ..
antzltant Où N
[mnt
2 liant
d'électrons peuplant les orbitales moléculaires liantes et antiliantes.
Justifier les valeurs expérimentales des longueurs de liaison données ci-après :
126 --
Si les niveaux d'énergie des orbitales atomiques 2s et 2p sont trop proches, le
type de
diagramme, établi précédemment pour le dioxygène, n'est plus valable ; il faut
envisager la
construction d'un diagramme avec interaction s-p. '
Pour cela deux types de diagrammes doivent d'abord être envisagés : d'une part,
celui sans
interactions s--p construit précédemment (cas du dioxygène) et d'autre part, un
diagramme
limite où les orbitalesatomiques 2s et 2p seraient dégénérées.
tN sont respectivement les nombres
défini simplement par
antiliant
6.l.-- Démontrer que si deux orbitales atomiques 2s et 2p sont dégénérées avec
l'énergie E,
toute combinaison linéaire de ces deux orbitales atomiques est encore solution
de
l'équation de Schrôdinger avec la même énergie E.
Remarque: l'équation de Schrôdinger pour un système quelconque et une fonction
'? le
décrivant, sera simplement écrite Ê'P= E'P, où H ,opérateur hamiltonien
correspondant,
est linéaire.
6.2.-- Dans le cas hypothétique d'un atome dont les orbitales atomiques 2s et
2p seraient
dégénérées et en prenant l'axe x'0x pour l'axe de la liaison des deux atomes de
la
molécule, il est possible de remplacer, pour chaque atome, les orbitales
atomiques 2s et
2pX par :
1
"'"Jz'
- 1
!=_ __2
@ \/î(2S px)
(23+2px)
L'allure de ces nouvelles fonctions est la suivante :
ca wi ("z
Le diagramme d'orbitales moléculaires, OM, donné ci-dessous, est construit sur
la base
des fonctions 2p..., 2p21, ça], ça{ pour l'atome A1 de gauche et 2py2, 2p22, %
, çp'2 pour
l'atome A2 de droite. Un très faible recouvrement, pratiquement nul, est
envisagé entre ça{
et ço'2 : deux OM de symétrie a, pratiquement dégénérées, sont obtenues.
Préciser pour chaque orbitale moléculaire (D,-, les orbitales atomiques qui ont
servi à la
construire ainsi que sa symétrie 6 ou n. '
E
(134 et CI)5
7.- Dans le "Document--Réponse" les deux diagrammes, celui sans interaction s-p
(cas du
dioxygène entre autres) (diagramme de gauche) et celui avec interaction s--p
totale (cas étudié
ci--dessus) (diagramme de droite), sont représentés.
Il est admis qu'il y a une continuité entre ces deux diagrammes ; les niveaux
moléculaires se
correspondent de l'un à l'autre, ils sont corrélés.
Les règles de correspondance sont les suivantes : l'orbitale moléculaire (;
hante, de plus basse
énergie, du diagramme de gauche, est corrélée avec l'orbitale moléculaire 6
hante, de plus
basse énergie, du diagramme de droite. Puis l'orbitale moléculaire 6 hante
immédiatement
supérieure du diagramme de gauche est corrélée avec l'orbitale moléculaire 0'
hante
immédiatement supérieure du diagramme de droite et ainsi de suite. Il en va de
même pour les
(: antiliantes, les n liantes et les 712 antiliantes.
Compléter le schéma 1 du "Document--Réponse" en reliant par des traits les
niveaux corrélés.
8.-- Mettre alors en évidence deux points de croisement des lignes de
corrélation. En déduire qu'il y
a a priori trois types de diagramme d'orbitales moléculaires pour des molécules
A2.
Dans la réalité seuls deux cas existent ; le cas avec interaction totale
n'existe pas.
9.- La molécule de diazote appartient au type intermédiaire. Donner son
diagramme d'orbitales
moléculaires et calculer l'indice de liaison.
10.- Le diagramme d'orbitales moléculaires de la molécule de monoxyde de
carbone C0, est le
même que celui de la molécule de diazote (les niveaux des orbitales atomiques
sont différents
mais l'ordre des énergies des orbitales moléculaires est le même).
10. 1 .--Proposer un schéma de Lewis pour cette molécule en accord avec
l'indice de liaison, et en
faisant apparaître les éventuelles charges formelles. '
lO.2.--La molécule de monoxyde de carbone a des propriétés de ligand (ou
coordinat). '
Se fixe--t-elle préférentiellement par le carbone ou par l'oxygène ?
11.- Le monoxyde de carbone réagit avec les métaux de transition pour conduire
à des complexes
carbonyle. Ainsi, il est possible de préparer V(CO)6 et Cr(CO)6.
Ill--Faire le décompte des électrons de valence intervenant dans ces deux
espèces c'est--à-dire
la somme des électrons de valence de l'élément de transition et des électrons
apportés par
les molécules de monoxyde de carbone.
ll.2.-Quel est probablement le plus stable des deux complexes '? Pourquoi ?
Les activités des solutés seront assimilées au rapport
1.-
PARTIE III
Etude électrociuétique et théorique du complexe cuivre-ammoniac
C
soluté
CO
, en prenant C° = 1 mol.L".
Proposer un schéma réaliste d'une électrode de référence au calomel saturé en
KC], notée dans
la suite ECS. Faire figurer en particulier les diverses espèces majoritaires
intervenant dans le
couple redox mis en jeu. Le calomel est le chlorure de mercure(l) Hg2Clz(s).
Cette électrode sert de référence. Quelle caractéristique doit posséder une
telle électrode ?
Le potentiel électrochimique d'une espèce AZi, noté ,ÜAz,- , s'exprime par la
relation :
,ÜAZi : ,UAZf + ZÏF AZ!"
dans laquelle ,qu, est le potentiel chimique de l'espèce Ali, Zi le nombre
algébrique de
charges élémentaires (pour une espèce' non chargée, Z, =O), fiAz; le potentiel
électrique,
supposé uniforme, de la phase dans laquelle se trouve cette espèce et F la
constante de Faraday.
Le potentiel électrochimique de l'électron dans un métal M donné, noté [le...)
, est posé égal à
,ue(M) --FfiM. Dans cette expression, ,ue(M) est considéré constant quel que
soit le métal M, et
$M est le potentiel électrique, supposé uniforme, du métal dans lequel se
trouve l'électron.
Pour un système mettant en jeu des espèces, électron compris, intervenant dans
un équilibre
électrochimique, la relation Zv,fl, : O est vérifiée, vi étant le coefficient
stoechiométrique de
l'espèce i.
Soit l'équilibre électrochimique qui a lieu à une électrode métallique de
cuivre :
Cu2+ + 2 e(Cu) = Cu
dans laquelle e(Cu) représente un électron du métal Cu.
Le métal est au potentiel fiCu et la solution au potentiel fis .
Etablir l'expression donnant fiCu "fis en fonction des potentiels chimiques
standard, du
potentiel chimique de l'électron dans Cu, et de l'activité de Cu".
L'électrode de référence au calomel saturée peut être étudiée de la même façon.
4.1.-- En considérant l'équilibre électrochimique faisant intervenir les
espèces majoritaires,
établir la relation donnant fiHg -- fiSOEOE) en fonction des potentiels
chimiques standard,
du potentiel chimique de l'électron et de l'activité des, ions chlorure ;
fiSOECS) est le
potentiel électrique de la solution contenue à l'intérieur de l'électrode.
4.2.- Montrer que dans le cas d'une solution saturée en KCl, cette différence
de potentiel est
constante.
5.- Soit le montage suivant :
Fil de cuivre
_oltmètre
ECS __, H ___. ECS
î î
Solution de Cu2+ Solution de Cu2+
notée SG notée SD
Un voltmètre permet de mesurer la différence de potentiel entre le mercure de
l'ECS de droite
et le mercure de l'ECS de gauche fiHgD -- ÇÎHgG .
Cette différence de potentiel peut se mettre sous la forme suivante :
fiHgD '" fiS(ECS)D + $S(ECS),, "" $S,, + fis,, "' fiCu + @@ " ÔSG + fiSG _
fiS(ECS)G + $S(ECS)G " fiHgG -
Exprimer cette différence en fonction des concentrations des ions Cu2+ dans les
compartiments
de gauche et de droite. Les potentiels de jonction liquide fiSOECS) -- fis ,
dans laquelle $S(ECS)
est le potentiel électrique de la solution interne à l'ECS et fis le potentiel
électrique de la
solution dans laquelle elle plonge, seront négligés.
Le compartiment de droite contient 20 mL d'une solution de Cu2+ à 1,010"3
mol.L"1 et 20 mL
d'ammoniac à 4 mol.L"1 ; le compartiment de gauche contient 20 mL d'une
solution de Cu2+ à
1,010"3 mol.L"1 et 20 mL d'une solution d'ammoniac à 2 mol.L"Ï La différence de
potentiel,
mesurée à 18 °C, vaut alors : 3,61. 10"2 V.
Cette variation de différence de potentiel est interprétée par la formation
d'un complexe très
stable de formule Cu(NH3 )? . En justifiant les approximations effectuées, en
déduire la valeur de x.
Le même montage est repris. Le compartiment de droite contient 20 mL d'une
solution de Cu2+
à 1,010"3 mol.L"1 et 20 mL d'une solution d'ammoniac à 2 mol.L"1 ; le
compartiment de
gauche contient 20 mL d'une solution de Cu2+ à 1,010"3 mol.L"1 et 20 mL d'eau.
La valeur de
la différence de potentiel est alors de 3,59.10"1 V. En déduire la valeur de la
constante de
formation du complexe.
8.-- Pour interpréter la stoechiométrie du complexe, il est possible d'utiliser
la théorie du champ
cristallin.
8.l.-- Donner le schéma faisant apparaître la levée de dégénérescence des
orbitales 3d d'un
cation sous l'effet du champ électrique provoqué par six ligands placés selon
une
géométrie octaédrique.
8.2.- Soit A l'écart énergétique entre les niveaux, indiquer l'occupation de
ces orbitales dans le
cas d'un complexe du cuivre(ll).
9.-- Une déformation de la géométrie du complexe octaédrique est envisagée dans
laquelle les
ligands situés selon l'axe z'Oz s'éloignent et les ligands situés sur les axes
x'Ox et y'Oy se
rapprochent. Une levée supplémentaire de dégénérescence en découle :
-- soit 61 l'écart énergétique entre les orbitales dégénérées du et d yz d'une
part et dxy d'autre part,
- soit 82 l'écart énergétique entre les orbitales dz2 et dx2_y2 .
En considérant A >> 81 et A >> 62, proposer un nouveau diagramme d'énergie pour
les orbitales d
prenant en compte ces nouvelles levées de dégénérescence.
Cette déformation est--elle stabilisante ou déstabilisante '?
10.- En extrapolant ce résultat au cas où 61 et 62 deviennent suffisamment
grands pour que les
niveaux des orbitales a'z2 et dxy s'inversent, proposer une interprétation de
la stoechiométrie
observée pour le complexe cuivre-ammoniac. Quelle est la géométrie du complexe ?
PARTIE IV
Etude d'un mélange binaire
Le diagramme binaire cuivre-magnésium est étudié ci-après pour des fractions
molaires en
magnésium comprises entre 0,40 et 1,00. Les solides sont totalement
immiscibles, aucune
démixtion à l'état liquide n'est observée. '
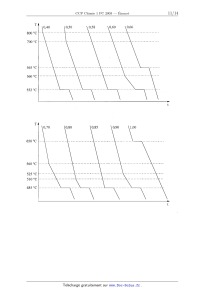
Les courbes de refroidissement de dix mélanges, initialement liquides, sont
données page 11 ; t est
la variable de temps et T la température. Pour faciliter la lecture de ces
courbes, l'échelle des
ordonnées n'est pas volontairement respectée. Un dispositif assure une
évacuation de chaleur
régulière -5--Q-- .
dt
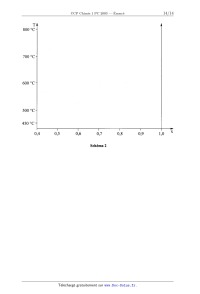
1.-- A partir des courbes de refroidissement, donner, sur le schéma 2 du
"Document-Réponse",
l'allure du diagramme binaire Cu-Mg dans le domaine de fractions molaires
comprises entre
0,4 et 1,0.
565 °C
560 °C
552 °C
TI
650 °C
560 °C
525 °C
510 °C
485 °C
Ce diagramme fait apparaître un composé défini. Quelle est sa composition ?
Indiquer sur ce diagramme la nature des phases et leur contenu dans les
différents domaines.
Un liquide a une composition initiale de fraction molaire 0,7. Indiquer la
nature des phases et la
composition de celles-ci lorsque ce mélange est refroidi à T = 485 °C.
La structure d'un autre composé défini, qui ne figure pas dans le domaine
étudié ci--dessus, a été
établie. Elle peut être décrite de la façon suivante : les atomes de magnésium
ont une structure
identique à celle des atomes de carbone dans le diamant ; chaque site de
symétrie tétraédrique
(non occupé dans le diamant) est ici occupé par un assemblage Cu; (4 atomes de
cuivre
tangents assemblés en tétraédre). Le paramètre de maille est de 702 pm.
5.1.-- Dessiner une coupe de la maille du diamant dans un plan contenant deux
arêtes parallèles
n'appartenant pas à une même face. Les atomes, dont les centres sont dans ce
plan, sont
seuls représentés. Sur ce même dessin, les sites vides de la structure diamant,
de symétrie
tétraédrique, occupés par Cu4 dans le composé défini, seront précisés.
5.2.- Déterminer la stoechiométrie de cet autre composé défini.
5.3.-- Calculer sa masse volumique.
Fin de l'énoncé
AE
DOCUMENT--REPONSE
Sans interaction s--p
Schéma 1
Avec interaction s--p totale
T A
800 °C "
700 °C "'
600 °C "'
500 °C "'
450 °C "*
0,4
0,5
0,6
0,7
Schéma 2
0,8
0,9
1,0
>