Centrale Physique et Chimie MP 2012
| Thème de l'épreuve | Du minerai aux applications: le cuivre |
| Principaux outils utilisés | mouvement des particules chargées, électrocinétique, optique ondulatoire, cristallographie, oxydoréduction, thermodynamique chimique |
| Mots clefs | conduction, grandeurs efficaces, caténaire, rayons X, cuivre |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
î, '» Physique--Chimie
°°«
--/ MP
EÜNEÜUHS EENTHHLE-SUPËLEE 4 heures Calculatrices autorisées
2012
Les données sont regroupées en fin d'énoncé. Les résultats numériques seront
donnés avec un nombre de chifires
significatifs compatible avec celui utilisé pour les données.
Du minerai auoe applications : le cuivre
Le cuivre est un des métaux les plus anciennement utilisés par l'homme (depuis
sans doute dix millénaires),
d'abord en parallèle avec des outils de pierre puis, allié à l'étain, sous
forme de bronze, par exemple dans l'Égypte
ancienne, à l'époque du sphinx et des pyramides de Gizeh. L'actualité a
récemment mis en évidence la forte
augmentation du cours commercial du cuivre : en effet, avec une production
annuelle mondiale de l'ordre de 15
a 20 millions de tonnes, les réserves de minerai connues devraient être
épuisées dans peu de temps.
Le cuivre a pris le nom de l'île de Chypre, où il fut d'abord extrait. Métal de
couleur rouge, caractérisé par
d'excellentes conductivités thermique et électrique, assez peu oxydable dans
les conditions ordinaires de son
emploi, le cuivre est aussi relativement peu toxique ; il est logiquement
utilisé pour de nombreuses applications,
pur ou sous forme d'alliage. Ce sujet illustre diverses étapes de la
fabrication et de la caractérisation d'un
élément métallique à base de cuivre, depuis l'extraction du minerai jusqu'à la
caractérisation physico--chimique
de la structure cristalline du métal fini.
Le problème comporte de nombreuses parties et questions indépendantes.
I Du minerai au métal
I.A -- Un minerai de cuivre, la chalcopyrite
La chalcopyrite est un minerai mixte de cuivre et de fer qui constitue une des
principales sources de la production
industrielle de cuivre. La formule brute décrivant sa stoechiométrie est
CuFeOESy (proportions molaires 1, r et y
respectivement en Cu, Fe, S).
I.A.1) Une analyse massique grossière du minerai montre qu'il est composé pour
un peu plus d'un tiers de
soufre et pour un peu moins d'un tiers de fer (proportions en masse, : 1/3, < 1/3, > 1/3 respectivement en
Cu, Fe, S). En déduire les valeurs approchées de r et y. Adoptant pour valeurs
exactes de r et y les plus petits
entiers voisins de ceux--ci, préciser les proportions en masse exacte de
soufre, fer et cuivre dans la chalcopyrite.
I.A.2) La structure cristalline de la chalcopyrite peut être décrite à partir
d'un réseau cubique à faces centrées
d'ions sulfure S2_. Représenter la maille correspondante et faire figurer sur
cette maille les sites tétraédriques
disponibles pour l'insertion des cations du fer et du cuivre. Quel est le
nombre de sites tétraédriques disponibles
pour chaque ion sulfure ?
I.A.3) Dans la chalcopyrite, les ions du fer et du cuivre occupent
respectivement chacun une certaine fraction
des sites tétraédriques de la structure cubique à faces centrées formée par les
ions sulfure. Quelle est cette
proportion ? Quelle est la coordinence des cations fer et cuivre dans cette
structure ?
I.A.4) Avant l'étude détaillée de la structure du cristal de chalcopyrite (par
diffraction de faisceaux de
neutrons), deux structures concurrentes ont été proposées :
-- dans la structure (A), les ions du fer sont tous au nombre d'oxydation +III ;
-- dans la structure (B), les ions du fer sont tous au nombre d'oxydation +11.
Quel est, dans chacun des deux cas, le nombre d'oxydation des ions du cuivre ?
On a en fait identifié la structure (A). Déterminer les structures
électroniques de l'état fondamental des atomes
de soufre et de cuivre. Pouvait--on prévoir simplement les nombres d'oxydation
pris par ces éléments dans la
chalcopyrite (A) ?
I.B -- Obtention du cuivre métallique
Le passage de la chalcopyrite au cuivre métallique peut être réalisé par
plusieurs procédés. L'un d'eux débute
par le grillage de la chalcopyrite, produisant des sulfures de cuivre solides
CugS et de fer FeS. Le sulfure de
cuivre est alors traité par l'oxygène gazeux, produisant directement du cuivre
métallique et de l'oxyde de soufre
802 gazeux. On notera P(X ) la pression partielle de l'espèce X.
I.B.1) Écrire l'équation--bilan de la réaction passant de Cu28 a Cu. Définir,
calculer et commenter brièvement
sa variance v.
3 avril 2012 11:27 Page 1/7 Ex:) BY--NC-SA
93/
La réaction est menée industriellement sous une pression partielle d'oxygène
P(02) = 0,2 bar. Quelle est,
votre avis, la raison de ce choix ?
I.B.2) On se place dans le cadre de l'approximation d'Ellingham. Tracer le
diagramme donnant la valeur, a
P(SOg)
P(O2)
la notion d'affinité, démontrer que la courbe d'équilibre sépare le plan (1 / T
,a) en deux domaines correspondant
à l'existence exclusive d'un des deux solides Ou28 ou Ou.
l'équilibre chimique, de $ = ln en fonction de 1 / T pour T E [300 K,1 200 K].
En utilisant, par exemple,
I.B.3) Pour quelle pression partielle de 802 peut-on, par cette réaction,
produire du cuivre métallique à
T=900K?
I.C -- Rafiînage du cuivre métallique
Le procédé de synthèse du cuivre métallique se poursuit par électroraffinage :
le cuivre Ou obtenu par la réaction
précédente, qui contient encore diverses impuretés métalliques (fer Fe, zinc
Zn, argent Ag), est disposé dans
une solution aqueuse électrolytique de sulfate de cuivre acidifiée et sert
d'électrode (El). L'autre électrode (E2)
est constituée de cuivre déjà purifié. On impose alors une différence de
potentiel U = UE1 -- U E2 (en pratique,
lUl < 0,4 V) et il apparaît un courant électrique volumique de densité ... de l'ordre de 300 A - m_2. Du fait de l'existence de la tension U, le cuivre et certains autres métaux de l'électrode (El) sont oxydés et passent en solution. D'autres métaux tombent alors progressivement au fond de la cellule d'électrolyse sous forme métallique et forment des boues solides qui sont séchées et valorisées. I.C.1) La tension U est choisie de sorte que seul le cuivre se redépose sur l'électrode (E2). Préciser le signe de U. L'électrode (El) est--elle une anode ou une cathode ? I.C.2) Quelle masse maximale de cuivre peut--on espérer récupérer par heure de fonctionnement par mètre carré de surface d'électrode ? Sur quelle électrode récupère--t--on ce cuivre ? I.C.3) À l'issue d'une telle opération, on cherche à récupérer et valoriser le fer, le zinc et l'argent qui étaient contenus dans l'électrode (El). Expliquer, pour chacun de ces trois métaux, si on le récupère sous forme mé-- tallique ou sous forme oæydée, et si on le récupère dans les boues solides de fond de cuve ou dans la solution électrolytique. II Le cuivre, conducteur de l'électricité II.A -- Modèle microscopique de la conduction électrique C'est en tant que conducteur de l'électricité que le cuivre trouve la plupart de ses applications industrielles. On veut proposer dans cette question un modèle microscopique pour la bonne conductivité électrique du cuivre cristallin. Dans le cristal de cuivre, un unique électron périphérique par atome de cuivre est délocalisé sur l'ensemble du volume du cristal; on notera n leur densité particulaire, c'est--à--dire le nombre d'électrons de conduction par unité de volume. Les autres électrons ne participent pas a la conduction électrique. n sera supposée uniforme dans tout le volume du matériau. La conduction électrique est due au déplacement des électrons de conduction (masse me, charge (1EUR = --e), sous la seule action du champ électrique imposé Ë, supposé lui--même statique et uniforme. Les électrons de conduction subissent aussi des chocs sur d'autres particules (électrons ou noyaux de cuivre), à des intervalles de temps plus ou moins réguliers. Aucune connaissance relative auoe chocs n'est nécessaire a la résolution de cette partie, à l'exception de celle--ci : après chaque choc, la direction et la norme de la vitesse d'un électron est totalement imprévisible. II.A.1) On étudie un électron qui a subi un choc à l'instant t = 0 ; sa vitesse juste après le choc est notée ii,-. Exprimer la vitesse U(t) de l'électron a l'instant t (aucun choc n'a lieu entre les instants t = 0 et t). II.A.2) On notera {g) la moyenne de la grandeur g(t), moyenne calculée sur un grand nombre d'électrons. Que vaut <Ü,) ? En déduire la relation liant < 106 S - m_1. En déduire la valeur numérique de '7', et celle de fc = 1/7'. Quels commentaires physiques la valeur numérique de fc vous suggère--t--elle ? II.A.5) À très haute fréquence (f > fc), la conductivité électrique du cuivre
n'est plus une constante mais
une fonction décroissante de la fréquence. En déduire, qualitativement, une
justification de la couleur du cuivre
métallique.
II.A.6) Les chocs des électrons de conduction sur les autres particules du
matériau sont largement dus à
l'agitation thermique des particules dans le volume du cristal. Expliquer
brièvement si la conductivité électrique
est une fonction croissante ou décroissante de la température T.
3 avril 2012 11:27 Page 2/7 Ex:) BY--NC-SA
II.B -- Caténaz're d'alimentation ferroviaire
La bonne conductivité électrique du cuivre explique son emploi dans les fils de
contact (caténaires) d'alimentation
de puissance des locomotives, mais aussi dans les câbles de signalisation des
installations ferroviaires. Du fait
de l'augmentation spectaculaire du prix du métal, ces câbles font l'objet de
vols fréquents.
Nous nous intéresserons ici à l'alimentation électrique d'une ligne TGV, en
haute tension alternative a la
fréquence f = 50 Hz. On considère une ligne parcourue par des rames Duplex
consommant une puissance
nominale moyenne 770 = 8,8 MW lorsqu'elles sont alimentées par une tension
alternative de valeur efficace
U = 25,0 kV. Le schéma électrique de la ligne est représenté figure 1 : à
intervalle régulier, des sous--stations
d'alimentation, assimilées à des générateurs idéaux de tension efficace U,
alimentent la caténaire (C), formée
d'un câble de cuivre de conductivité "You = 59,6 >< 106 S - m_1 et de section constante s. La locomotive consomme un courant d'intensité efficace constante [ , quelle que soit sa position $ sur la ligne. Le retour du courant vers les sous--stations se fait par les rails et le sol ; on en négligera la résistance électrique. On supposera enfin qu'entre deux sous--stations il y a au maximum une seule rame TGV en circulation. W : : : \ a: 0 $ EUR "@@--fi ...@ Figure 1 Caténaire d'alimentation ferroviaire /l/ \fi/K\= II.B.1) En fonctionnement normal, on mesure ] = 352 A. Calculer le facteur de puissance de la rame Duplex. Sachant que le moteur du TGV est de nature inductive, que peut--on en conclure ? Pour quelle raison les rames Duplex fonctionnent--elles dans ces conditions ? Exprimer u(t) (cf. figure 1, tension aux bornes des sous--stations) et z(t) en fonction de U, [, f et t. Ces deux relations seront supposées vérifiées dans toute la suite. II.B.2) On suppose que les valeurs du courant efficace et du facteur de puissance de la rame restent les mêmes ; montrer que la puissance moyenne consommée par la rame a l'abscisse $ est P(oe) = 790 -- æ(EUR -- oe)/T et exprimer T en fonction de "70... 3, EUR et I . Pour un fonctionnement satisfaisant de l'ensemble et éviter l'échauffement excessif de la caténaire, on impose P(oe) > 04770 pour tout a: dans
l'intervalle [0,Ê], où EUR désigne la distance entre
deux sous--stations consécutives. En déduire que s > 3min où on exprimera 3min
en fonction de "70... EUR, oz, U et
770.
Application numérique. 04 = 0,98, EUR = 50 km; calculer sm... et la masse de
cuivre associée par mètre de
caténaire. Commenter.
Pour déterminer le meilleur choix économique lors de l'installation d'une ligne
TGV, on prendra en compte
le coût total annuel (amortissement en entretien compris) d'une sous--station
(noté CSS) et le coût total annuel
unitaire (c'est--à--dire par mètre de longueur, noté Cu) de la caténaire de
cuivre, de son câble de support en bronze
et de ses poteaux de fixation. La longueur totale L de la ligne TGV est
nettement supérieure a la distance EUR
entre sous--stations.
II.B.3) Tous les poteaux de support ont les mêmes caractéristiques. Expliquez
pourquoi le coût unitaire Cu
(caténaire, support de bronze et poteaux de support) est pratiquement
proportionnel à 8. On posera dans la
suite Cu = K s...... où smin a été défini et exprimé ci--dessus.
II.B.4) Exprimer le coût total annuel de la ligne TGV, de longueur totale L
donnée. La longueur EUR est choisie
pour minimiser ce coût. Sachant que CSS / K = 8,0 m3, calculer la valeur
optimale de EUR ; conclure.
Compte tenu de la valeur importante du courant efficace ] , les caténaires sont
susceptibles de s'échauffer
fortement. La norme SNCF SAM E 903 précise que la différence maximale entre la
température extérieure et
la température, supposée uniforme, de la caténaire ne doit pas excéder 65°C.
II.B.5) Déterminer la valeur de la puissance moyenne qui peut être reçue par
unité de longueur de caténaire
en fonction de ], "You et s.
II.B.6) Le coefficient surfacique de transfert conducto--convectif au niveau de
la surface latérale est noté h
(coefficient de la loi de Newton) ; on prendra pour les applications numériques
h = 5,0 W - m_2 - K_1. Donner
l'expression littérale de la puissance thermique cédée par unité de longueur de
caténaire en fonction de h, 8 et
de la différence de température 5T = T caténaire -- T extérieur. Dans ces
conditions, la valeur de sm... déterminée à
la question II.B.2 est--elle pertinente ?
3 avril 2012 11:27 Page 3/7
III La structure du cristal de cuivre
L'analyse de la structure cristalline des métaux comme le cuivre est réalisée
par des expériences de diffraction,
soit de faisceaux de rayon X, soit de faisceaux de neutrons.
III.A -- Dijj"raction par un cristal
III.A.1) Proposer un ordre de grandeur de la longueur d'onde )\X pour un
faisceau de rayons X.
III.A.2) La longueur d'onde )... d'un faisceau de neutrons vérifie la relation
)... = h/ p, où h est la constante
de Planck et p = m...,un est la quantité de mouvement du neutron, de masse m...
de vitesse (non relativiste) un
et d'énergie cinétique E..., = %kî3T... où kg est la constante de Boltzmann.
Calculer )... et la valeur de E..., (dans
une unité appropriée) pour des neutrons thermiques (T ..., : 1 000 K).
III.A.3) Expliquer ce qui, a votre avis, justifie ce choix des valeurs de )\X
et )... pour l'étude d'un cristal de
cuivre.
III.B -- Production d'un faisceau polychromatique de rayons X
La conduite d'études de plus en plus détaillées de structures cristallines par
diffraction des rayons X a nécessité
la mise au point de sources de rayons X monochromatiques et très intenses, mais
de longueur d'onde réglable.
Une telle source est constituée par l'accélérateur de particules SOLEIL (Source
Optimisée de Lumière d'Énergie
Intermédiaire au Laboratoire). Dans cet accélérateur, des électrons (charge
--e, masse me) sont maintenus sur
une orbite quasi--circulaire de rayon R par un champ magnétostatique intense,
de norme Bo. Cette trajectoire est
régulièrement interrompue pour faire passer les électrons dans les dispositifs
d'émission des rayons X proprement
dits, qui portent le nom d'onduleurs. Dans un onduleur, un champ
électromagnétique impose aux électrons
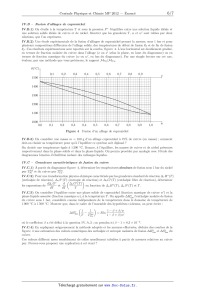
une trajectoire sinusoïdale, de courte période spatiale b (voir figure 2). Le
mouvement des électrons dans le
synchrotron et dans les onduleurs sera traité dans le cadre non relativiste.
H rayons X
| Rayons X
a | a --
trajectoire
des électrons
Onduleur
&; @
C?/@CË . , Ç'ÇÇOQ
Olre des EUR\e
Figure 2 Schéma général du synchrotron SOLEIL (à gauche) et d'un onduleur (à
droite)
III.B.1) Préciser, sur un schéma clair, le sens du champ magnétostatique RO qui
permet de maintenir, dans
le référentiel du laboratoire RZ, les électrons sur leur trajectoire
quasi--circulaire dans le synchrotron. Exprimer
l'énergie cinétique EEUR des électrons uniquement en fonction de leur vitesse
210, de 6, BD et du rayon R de la
trajectoire circulaire des électrons.
Application numérique. En admettant que la relation établie ci--dessus reste
vraie pour vo : c (vitesse de la
lumière dans le vide), calculer BO si EEUR = 2,75 GeV et R = 50 m.
Un électron entre dans l'onduleur a la vitesse 50 = u0ë'OE dans le référentiel
du laboratoire. Dans la zone Z, il
circule dans le vide et est soumis, a partir du point d'abscisse oe = 0, au
seul champ magnétostatique B1 dont
la composante utile est Ë1 - @ = B... cos (27r%). On négligera aussi toute
interaction des électrons entre eux
et l'effet des autres composantes Bla; et B1y de R1 sur le mouvement des
électrons. La trajectoire des électrons
reste plane dans le plan (Ooey).
III.B.2) Exprimer le principe fondamental de la dynamique pour un électron
Dans toute la suite, on suppose (vyl << vo. Montrer que la trajectoire de l'électron dans le référentiel du laboratoire est sinusoïdale et déterminer les caractéristiques (amplitude et période) de cette sinusoïde. 3 avril 2012 11:27 Page 4/7 Ex:) BY--NC-SA On rappelle qu'une particule chargée accélérée rayonne un champ électromagnétique proportionnel à son accé-- lération. C'est le cas de l'électron qui traverse l'onduleur. Cet électron a une vitesse vo très proche de 6. Son 2 vOEî@ÿä' 7 >> 1). Dans ces conditions, on considèrera que cet électron émet un
rayonnement :
-- exclusivement aux points où son accélération est maximale, donc où son
déplacement transversal y est
extrémal ;
-- dans la direction fi de sa vitesse a l'instant d'émission ;
-- et que les rayonnements qu'il émet en tous les maximums de sa trajectoire
(cf. figure 2 a droite) sont en
phase. Par conséquent, ces rayonnements interférent constructivement à l'infini.
Ainsi l'onde émise par l'électron et qui se propage dans l'onduleur dans la
direction il est en phase avec les
passages de l'électron aux maximums de sa trajectoire.
énergie E = 'ymec2, où 7 est le facteur relativiste 'y = est très grande par
rapport a mec (soit
III.B.3) En utilisant cette dernière propriété, exprimer la longueur d'onde À
de cette onde électromagnétique
en fonction de 19, vo, c et d'un nombre entier 19 et montrer que A,, = --1.
1
\/1 -- 0% /02
Calculer numériquement À1 pour 19 = 2 cm et E = 2,75 GeV et montrer qu'on a
ainsi réalisé une source
polychromatique de rayons X.
Exprimer À1 en fonction de b et de 'y = (on rappelle que "y >> 1).
IV Étude thermodynamique d'un alliage du cuivre
Les alliages de cuivre Cu et de nickel Ni (cupronickels), très résistants a la
corrosion, ont été utilisés depuis
très longtemps, notamment pour la production de pièces de monnaie (voir figure
3), mais aussi pour des
applications en construction navale. Cet alliage présente la particularité
d'une miscibilité complète des deux
métaux l'un dans l'autre, a l'état liquide mais aussi à l'état solide (les deux
métaux cristallisent dans le même
système cubique à faces centrées, et présentent des rayons atomiques voisins).
Figure 3 Pièces de monnaie (grecque antique et
suisse moderne) en cupronickel (75% Ou, 25% Ni)
Les masses molaires atomiques de ces deux éléments sont notées Mcu et M.... Les
potentiels chimiques des
métaux liquides purs a la température T sont notés uê*u(T ) et uËÉ(T ), ceux
des solides purs uË*U(T ) et ,uÎË(T )
La totalité de l'étude est effectuée sous la pression constante P = P0 = 1 bar
; on note R la constante molaire
des gaz parfaits.
I V.A -- Potentiels chimiques dans des solutions idéales
IV.A.1) La solution liquide de nickel et de cuivre est considérée comme une
solution idéale; on note $ la
fraction molaire de cuivre dans cette solution liquide, et 1 -- oe celle du
nickel. Exprimer le potentiel chimique
uêu(afi,T ) du cuivre liquide dans la solution en fonction de 33, T et des
données de l'énoncé.
IV.A.2) On note aussi il) la fraction massique du cuivre dans cette même
solution, w = m(Cu)/m, où m est
la masse de la solution de cuivre et de nickel et m(Cu) la masse de cuivre
qu'elle contient. Exprimer uêu(w,T )
en fonction de U), T et des données de l'énoncé ; on montrera en particulier
que :
/Édwïfi=wOEÙ--RTm(l--fi+â)
et on précisera la fonction 04g(T ) et la constante réelle $ en fonction de
Mc... M... et uê*u (T).
IV.A.3) On note enfin w' la fraction massique du cuivre dans la solution solide
idéale de cuivre et de nickel
qui cristallise en contact avec la solution liquide idéale des mêmes métaux. Le
potentiel chimique uëu(w' ,T ) du
cuivre solide dans la solution s'exprime sous la forme uëu(w' ,T ) = ozs(T ) --
RT ln (1 -- B + Â, . Justifier le
21)
lien entre aS(T) et usc*u(T).
3 avril 2012 11:27 Page 5/7
I V.B -- Fusion d'alliages de cupronickel
IV.B.1) On étudie à la température T et sous la pression P° l'équilibre entre
une solution liquide idéale et
une solution solide idéale de cuivre et de nickel. Montrer que les grandeurs T,
U) et w' sont reliées par deux
relations, que l'on exprimera.
IV.B.2) Une étude expérimentale de la fusion d'alliages de cupronickel permet
la mesure, sous 1 bar et pour
plusieurs compositions différentes de l'alliage solide, des températures de
début de fusion % et de fin de fusion
@. Ces résultats expérimentaux sont reportés sur la courbe, figure 4. L'axe
horizontal est doublement gradué,
en termes de fraction molaire du cuivre dans l'alliage ($ ou m' selon la phase,
en haut du diagramme) ou en
termes de fraction massique du cuivre (21) ou w' , en bas du diagramme). Par
une simple lecture sur cet axe,
évaluez, par une méthode que vous préciserez, le rapport MNi/MCu-
1300
1200
1100
1000
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Figure 4 Fusion d'un alliage de cupronickel
IV.B.3) On considère une masse m = 100 g d'un alliage cupronickel a 75% de
cuivre (en masse) ; comment
doit--on choisir sa température pour qu'à l'équilibre ce système soit diphasé ?
On choisit une température égale à 1 200 °C. Donner, a l'équilibre, les masses
de cuivre et de nickel présentes
respectivement dans la phase solide et dans la phase liquide. On pourra
procéder par analogie avec l'étude des
diagrammes binaires d'ébulliti0n isobare des mélanges liquides.
I V.C -- Grandeur3 caractéristiques de fusion du cuivre
IV.C.1) À partir du diagramme figure 4, déterminer les températures absolues de
fusion sous 1 bar du nickel
pur T 1ÊÏS et du cuivre pur T ËÏÎ
IV.C.2) Pour une transformation physico--chimique caractérisée par les
grandeurs standard de réaction A,H° (T)
(enthalpie de réaction), A,S°(T ) (entropie de réaction) et A,G°(T ) (enthalpie
libre de réaction), déterminer
ATG t d (%> en fonction de ATHO(T)7 ArSO(T) et T'
les ex ressi0ns de e --
p dT dT T
IV.C.3) On considère l'équilibre entre une phase solide de cupronickel
(fraction massique de cuivre w' ) et la
phase liquide associée (fraction massique w), a la température T. On appelle
AHËUS l'enthalpie molaire de fusion
du cuivre sous 1 bar, considérée comme indépendante de la température dans le
domaine de température de
1 000 °C à 1 500 °C. Montrer que, dans le cadre de l'ensemble des hypothèses
ci--dessus, on peut écrire :
O 1 1 _ 1--fi--l--fi/w
fus (Î_Ë) --R1"--1_5+5/...f
où le coefficient 0 a été défini a la question IV.A.2 ; on prendra ici fi -- 1
= 8,3 >< 10_2. IV.C.4) En expliquant soigneusement la méthode adoptée et les mesures effectuées, déduire des courbes de la figure 4 une estimation des valeurs numériques des enthalpie et entropie molaires de fusion AHÊUS et ASÊUS du cuivre. Ces valeurs diffèrent assez sensiblement de celles usuellement tabulées a partir de mesures relatives au cuivre pur. Pouvez--vous proposer une explication à cet écart ? 3 avril 2012 11:27 Page 6/7 OEzc) BY--NC-SA Données numériques 1. Propriétés des éléments et matériaux soufre, fer et cuivre. Numéro atomique ZS = 16 Soufre Masse molaire atomique Ms = 32,06 g - mol--1 Numéro atomique ZFe = 26 Fer Masse molaire atomique MFe = 55,84 g - mol--1 Masse volumique (20°C) QFe = 7,87 >< 103 kg - m--3 Numéro atomique ZCu = 29 Cuivre Masse molaire atomique Mcu = 63,55 g - mol--1 Masse volumique (20°C) 9011 = 8,96 >< 103 kg - m--3 2. Grandeurs physiques et constantes universelles. Masse d'un électron mEUR = 9,10 >< 10_31 kg Masse d'un neutron mn = 1,67 >< 10_27 kg Charge élémentaire @ = 1,60 >< 10_19 C 1 eV = 1,60 >< 10-19 J Constante d'Avogadro NA = 6,02 >< 1023 mol--1 Constante de Planck h = 6,63 >< 10_34 J - s Célérité de la lumière dans le vide 6 = 3,00 >< 108 m - s--1 Perméabilité magnétique du vide 110 = 4 >< 7r >< 10_7 H - m--1 Constante molaire des gaz parfaits R = 8,31 J - K_1 - mol--1 Constante de Boltzmann /<:B = R/NA = 1,38 >< 10_23 J - K_1 Accélération de la pesanteur g = 9,80 m - s--2 3. Données thermodynamiques : enthalpies de formation, entropies molaires standard à 298 K. Espèce chimique État AHÏË(kJ - mol--1) S°(J - K_1 - mol--1) Cu solide +33 Cu28 solide --80 +121 02 gaz +205 802 gaz --297 +248 4. Données électrochimiques : potentiels standard à 298 K. Couple redox ' E° ... Couple rédox ' E° Cu2+/Cusohde 0,34 v Zn2+/Znsohde --0,76 v Ag+/Agsolide 0:80 V FG2_l_/Fesolide _0744 V oooF1Nooo 3 avril 2012 11:27 Page 7/7 Ex:) BY--NC-SA