Mines Chimie MP 2005
| Thème de l'épreuve | Étude du dihydrogène |
| Principaux outils utilisés | thermochimie, cristallographie, oxydoréduction |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)



Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
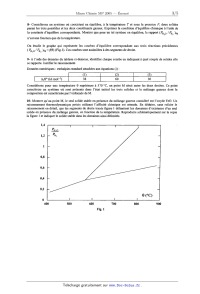
ECOLE NATIONALE DES PONTS ET CHAUSSEES. ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT--ETIENNE, DES MINES DE NANCY, DES TELECOMMUNICATIONS DE BRETAGNE. ECOLE POLYTECHNIQUE (Filière TSI). CONCOURS D'ADMISSION 2005 EPREUVE DE CHIMIE Filière : MP Durée de l'épreuve: 1 heure 30 minutes L'usage d'ordinateur ou de calculatrice est interdit Sujet mis à la disposition des concours: Cycle International, ENST IM TPE-EIVP. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie . CHIMIE 2005--Filière MP Cet énoncé comporte 5 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur - sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre.. DEBUT DE L'ENONCE . ' - _ . . LE DIHYDROGENE Depuis le début de la révolution industrielle, la diversification des sources d'énergie est une caractéristique , fondamentale de l'évolution du système énergétique : bois, charbon, pétrole et gaz, nucléaire, éolien, solaire, etc. Un développement durable est à présent souhaité : une nouvelle forme d'énergie, le système dihydrogène - piles à combustible représente l'avenir proche de l'évolution des sources d 'énergie. Nous nous pr0posons dans ce problème de suivre le cheminement du dihydrogène, de sa production en passant par son application majoritaire actuelle, en synthèse industrielle, pour finir par son avenir proche de combustible pour pile. Note : dans tout le problème, les gaz sont considérés comme parfaits et forment des mélanges parfaits. Le potentiel chimique des corps purs en phase condensée est indépendant de la pression. 1. Production du dihydrogène Le dihydrogène peut être obtenu par électrolyse de l'eau, mais sa production la plus importante en tonnage est issue du vaporéformage du méthane. Cette transformation, réalisée à 800°C sous une pression de 35 bar, peut être décrite par l'équation de réaction suivante : CH4+2HZO=COZ+4HZ Dans les conditions opératoires, tous les constituants sont sous forme gazeuse. On donne les enthalpies standard de formation suivantes à 298 K : A H° (kJ.mol_l) 1- Pourquoi l'enthalpie standard de formation du dihydrogène est-elle nulle ? 2- Calculer à T = 298 K la valeur de l'enthalpie standard attachée à l'équation de vaporéformage. Quelle approximation faut--il faire pour considérer que sa valeur ne dépend pas de la température ? 3-- Quel est le signe de l'entropie standard attachée à l'équation de vaporéformage ? Justifier qualitativement la réponse. En déduire, dans le cadre de l'approximation indiquée à la question 2, qu'il existe une température minimale au-delà de laquelle un mélange constitué des quatre constituants précédents, chacun étant à une pression partielle égale à la pression standard, évolue dans le sens de la disparition du méthane. Remarque : la valeur de cette température minimale est de l'ordre de 63 0°C. Pour évaluer les besoins énergétiques associés au vaporéformage, on pose les hypothèses suivantes : - la transformation est effectuée dans une enceinte fermée parfaitement adiabatique, à pression constante P = 35 bar, le méthane et la vapeur d'eau étant introduits en proportions stoechiométriques, - on suppose que la transformation est totale et que l'effet thermique dû à celle-ci se traduit uniquement par une baisse de la température des produits. Pour simplifier les calculs, les capacités thermiques molaires isobares Cpm(C02) et Cpm(H2) sont prises constantes dans l'intervalle de température considéré. On prendra : Cpm(cog) = 45 J.mol'hK"' et CP...(H2) = 27 J.mol"' .K--1. 4- Calculer la valeur approximative de la température finale du système dans le cadre de ces hypothèses. Commenter. 5- Quelle est l' influence d'une hausse de pression sur l'avancement de la transformation pour un système initialement en équilibre ? On justifiera rigoureusement par un calcul d'affinité. - Pour isoler le dihydrogène, il faut éliminer le dioxyde de carbone du mélange gazeux. Une des solutions adoptées est d'absorber C02(g) par une solution aqueuse basique. La base employée est l'ion carbonate CO32'(.aq)i On donne : pK A(COg/HCO3') = 6,3 pK A(HCO3*/ CO3Z') = 10,3 'à T = 298 K. 6- Ecrire l'équation de la réaction entre le dioxyde de carbone et les ions carbonate en solution aqueuse. Justifier que cette réaction soit totale dans les conditions usuelles. Dans quel domaine de pH se trouve le système en fin de réaction si les réactifs ont été introduits initialement en proportions stoechiométfiques ? 7- Ecrire les formules de Lewis de C02, HCO3' et CO32". Indiquer le nombre d'oxydation du carbone pour chacune de ces espèces. Il. Utilisations industrielles du dihydrogêne II-1 Réduction d'oxydes de fer La réduction des oxydes de fer par le dihydrogène, opération mise en oeuvre industriellement pour l'obtention de petites quantités de métal très pur, est schématisée par les trois équations suivantes, 6 étant la température exprimée en degrés Celsius : 9 < 570°C (1) % 'Fe304 + Hz = % Fe + 1120 9 > 570°C (2) Fe304 + Hg = 3 FeO + H20 et (3) FeO +H2 : Fe+H20 Le fer et ses composés sont sous forme solide et sont totalement non miscibles deux à deux dans les domaines de température considérés. Soient PH?0 et PHz les pressions partielles respectives de l'eau et du dihydrogène. 8- Considérons un système où coexistent en équilibre, à la température T et sous la pression P, deux solides parmi les trois possibles et les deux constituants gazeux. Exprimer la condition d'équilibre chimique à l'aide de la constante d'équilibre correspondante. Montrer que pour un tel système en équilibre, le rapport (PH?0 / PH, )éq n'est une fonction que de la température. On étudie le graphe qui représente les courbes d'équilibre correspondant aux trois réactions précédentes (PHZO /PH° )éq = f(6) (Fig.l). Ces courbes sont assimilées à des segments de droite. 9- A l'aide des données du tableau ci-dessous, identifier chaque courbe en indiquant à quel c0uple de solides elle se rapporte. Justifier le raisonnement. Données numériques : enthalpies standard attachées aux équations (i) : \ mm...--» "... Considérons pour une température 6 supérieure à 570 °C, un point M situé entre les deux droites. Ce point caractérise un système où sont présents dans l'état initial les trois solides et le mélange gazeux dont la composition est caractérisée par l'ordonnée de M. 10-- Montrer qu'au point M, le seul solide stable en présence du mélange gazeux considéré est l'oxyde FeO. Un raisonnement thermodynamique précis utilisant l'affinité chimique est attendu. En déduire, sans refaire le raisonnement en détail, que'les segments de droite tracés figure 1 délimitent les domaines d'existence d'un seul solide en présence du mélange gazeux, en fonction de la température. Reproduire schématiquement sur la copie la figure 1 et indiquer le solide stable dans les domaines ainsi délimités. 400 500 600 700 800 900 Fig. 1 II--2 Aspects cinétigues de la synthèse de l'ammoniac Le dihydrogène produit industriellement est principalement utilisé pour la synthèse de l'ammoniac, schématisée par l'équation de réaction suivante : N2(g) + 3 H2(g) = 2 NH3(g> On utilise un catalyseur solide à base de fer pour réaliser cette transformation. Le mécanisme de cette transformation est très complexe, mais peut être schématisé par les étapes suivantes (l'espèce notée A représente un site d'adsorption vacant à la surface du catalyseur, l'espèce notée B représente une molécule de diazote adsorbée sur un site du catalyseur et l'espèce notée C un atome d'azote adsorbé sur un site du catalyseur) : (l) A + N2 : équilibre établi à tout instant de constante K1 k2 (2) A + B <___' 2 C étapes cinétiquement déterminantes de constantes de vitesse k2 et k_2 --z (3) 2 C + 3 Hz "="--"=-- 2 A + 2 NH3 équilibre établi à tout instant de constante K3 Remarque : En réalité, la troisième étape est la succession d 'au moins cinq étapes bimoléculaires correspondant à des équilibres établis à tout instant. Le traitement de ce système complexe donne le même résultat que si l'on considère uniquement que C, H _7, A et [ 'ammoniac sont en équilibre selon l'équation (3). On note GA le taux de sites vacants,'BB le taux de sites occupés-par l'espèce B et GC le taux de sites occupés par nombre de sites occu és ar l' es èce X ----------------------£---£------£-------- avec X = B ou C). nombre total de sites d' adsorption du catalyseur Pour simplifier, nous admettrons que dans les équations cinétiques, ce sont les taux de sites ex qui interviennent à la place des concentrations pour les espèces A, B et C, et que dans les équations thermodynamiques, les activités de ces espèces sont égales à ces mêmes taux de sites. < l'espèce C (6X-- -- 11- Donner l' expression de la vitesse v de la transformation, définie comme la vitesse globale de 1' étape (2), en fonction de BA, 63 et GC 12-- Ecrire les conditions d'équilibre relatives aux équations ( l) et (3). En déduire l'expression de la vitessede la transformation en fonction des pressions partielles en N2, Hz et NH3 ainsi que de SA. La réaction possède--t--elle un ordre global ? des ordres partiels ? 13- Expliquer pourquoi l'étape (3) ne peut correspondre à deux actes élémentaires opposés. III. Dihydrogène et piles à combustible La rentabilité économique et l'innocuité écologique de la production d'énergie à partir des piles à combustible dihydrogène doivent prendre en compte l'ensemble de la chaîne. Cinq types de piles à combustible sont à l'étude et, parmi elles, les piles à électrolyte solide (SOFC, solid oxide fuel cell) présentent l'avantage de permettre la production de dihydrogène par vaporéformage in situ, grâce à leur température de fonctionnement élevée. III--1 Structure de l'électrolyte solide L'électrolyte solide des piles SOFC est de la zircone ZrO2 stabilisée avec de l'oxyde d'yttrium Y203. La zircone peut être assimilée en première approximation à un cristal ionique formé de cations Zr4+ et d'anions 02" assimilés à des sphères dures de rayons respectifs r+ et r_. 14-- Les cations Zr4+ sont distribués aux noeuds d'un réseau cubique faces centrées (cfc). Représenter la maille conventionnelle d'une telle structure en indiquant la position des ions Zr4+_ Indiquer le nombre d'ions Zr4+ contenus dans cette maille. 15-- Où se situent les sites tétraédriques de cette maille '? Exprimer l'habitabilité de ces sites, définie comme le rayon maximal de la particule sphérique pouvant s'y insérer sans déformation, en fonction de a, le paramètre de maille et de r+. 16-- Les anions 02" occupent les sites tétraédriques de la maille cfc formée par les cations. Déterminer le nombre d'anions 02" contenus dans cette maille. Donner la coordinence d'un anion par rapport aux cations, et d'un cation par rapport aux anions. 17- Exprimer la masse volumique de la zircone en fonction du paramètre de maille a, de la masse molaire du zirconium et de la masse molaire de l'oxygène. III-2 Fonctionnement schématique d'une pile à combustible SOFC Une pile à combustible est constituée d'une anode alimentée en combustible et d'une cathode alimentée en comburant, ces deux électrodes étant séparées par un électrolyte, conducteur ionique et isolant électrique. Dans le cas d'une pile alimentée en dihydrogène et dioxygène, l'équation de réaction s'écrit : H2 + % 02 ; HzO 18- Ecrire la demi-équation de la réaction se produisant à l'anode et celle de la réaction se produisant à la cathode dans le cas où l'électrolyte est de l'eau acidifrée. ' 19- On tient compte à présent du fait que l'électrolyte est un oxyde solide et non de l'eau : les porteurs de charge étant"des anions 02", les demi--équations ne sont plus ajustées avec des ions HJ". Ecrire à nouveau ._ les demi-- équations d'oxydoréduction. ' ' 20-- F aire un schéma légendé de la pile. 21-- Quels peuvent être les avantages et les inconvénients d'une telle pile à combustible ? FIN DE L'ENONCE