CCINP Chimie MP 2001
| Thème de l'épreuve | Chimie et photographie argentique |
| Principaux outils utilisés | oxydoréduction, diagrammes binaires, thermochimie, cristallographie |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
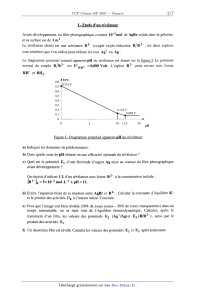
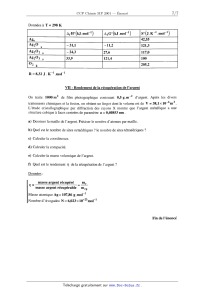
SESSION 2001 MP009 A CONCOURS (0MMIINS POlYTECHNIOUES ÉPREUVE SPÉCIFIQUE - FILIÈRE MP CHIMIE DURÉE : 2 heures Les calculatrices programmables et alphanumériques sont autorisées, sous réserve des conditions définies dans la circulaire n 0-99 186 du 16. 11. 99. Une feuille de papier millimètré devra être distribuée avec le sujet Chimie et photographie argentique La photographie, depuis son invention, a fait appel à des procédés chimiques. L'utilisation de sels d'argent (bromure AgBr en particulier) a été largement développée. Un film photographique comporte une couche de gélatine constituant un support pour AgBr solide (cristal ionique Ag+Br'). L'exposition à la lumière se traduit par une réduction d'une part infime d'ions Ag+ en argent métallique Ag° (germes). On obtient une image qui ne peut être observée (image latente). Lors du développement, le rôle du révélateur est de réduire un très grand nombre d'ions Ag+ au voisinage des germes uniquement (zones noires). Le rôle du fixateur est d'éliminer à l'aide d'une solution aqueuse par formation de complexes, les ions Ag+ qui n'ont pas été atteints par la lumière ou par le révélateur (formation de zones transparentes). On obtient ainsi une image négative où les zones exposées à la lumière sont noires et les autres transparentes (exemple : radiographie médicale). Par simplification, on considère ici que la couche de gélatine laisse libre accès aux réactifs et que de ce fait, les réactions se produisent comme si l'on était en phase aqueuse. Les activités des solutés sont assimilées aux concentrations. Seules sont à considérer les réactions proposées ou dont les données sont fournies. Les différentes parties ci--dessous : 1. Etude d'un révélateur, 11. Etude de fixateurs, 111. Préparation d'une solution de fixateur, IV. Lavage, séchage, V. Récupération de l'argent, VI. Fusion del' argent récupéré, VII. Rendement de la récupération de l'argent, sont indépendantes. L'ordre de présentation des sept parties respecte la chronologie des étapes rencontrée dans un laboratoire photographique. Cet ordre ne représente pas un niveau de difficulté croissant tout au long de l'épreuve. Les candidats sont vivement invités à prendre rapidement connaissance de l'ensemble de l'épreuve avant d'aborder les diflérentes parties dans l'ordre qu'ils souhaitent. Tournez la page S.V.P. I -- Etude d'un révélateur Avant développement, un film photographique contient 10"2 mol de AgBr solide dans la gélatine, et sa surface est de 1 m2. Le révélateur choisi est une substance R2-- (couple oxydo--réducteur R/R2" , les deux espèces sont solubles) que l'on utilise pour réduire les ions Ag+ en Ag. Le diagramme potentiel normal apparent--pH du révélateur est donné sur la figure 1. Le potentiel normal du couple R/ R 2" est E° RH" et RH2. =0,080 Volt. L'espèce R2-- peut exister sous forme R/R2" Figure 1 - Diagramme potentiel apparent--pH du révélateur a) Indiquer les domaines de prédominance. b) Dans quelle zone de pH obtient--on une efficacité optimale du révélateur ? c) Quel est le potentiel El d'une électrode d'argent Ag mise au contact du film photographique avant développement ? On choisit d'utiliser 1 L d'un révélateur sous forme R2" àla concentration initiale : [RZ--L, : 5><10--2 mol.L"l à pH = 12. (1) Ecrire l'équation-bilan de la réaction entre AgBr et R2". Calculer la constante d'équilibre K° et le produit des activités H0 à l'instant initial. Conclure. EUR) Pour que l'image soit bien révélée (50% de zones noires -- 50% de zones transparentes) dans un temps raisonnable, on se tient loin de l'équilibre thermodynamique. Calculer, après le traitement d'un film, les valeurs des potentiels E2 (AgÜAg)et E3 (R/R2--), ainsi que le produit des activités [11 . l') Un deuxième film est révélé. Calculer les valeurs des potentiels E2 et E3 après traitement. g) Pour des raisons cinétiques, le révélateur n'est plus utilisé lorsque E2 --E:, S 0,100V . Démontrer qu'un litre de révélateur peut traiter au maximum 8 films. Données : Ks AgBr : 10--12 E°Ag.,Ag = 0,800 V ln10 . RT ----------É---- : 0,059 V à 25°C Il - Etude de fixateurs Pour complexer les ions Ag+ , on envisage la formation de complexes avec plusieurs ligands, notés L : ammoniac NH3, thiosulfate 820%", cyanure CN _. - \ , \ \ . --3 --1 - On cons1dere que l argent 8. complexer est a une concentration de 10 mol .L en solution aqueuse. On ne considère que les complexes de type Ag+L2. a) Tracer les domaines de prédominance de l'argent sous ses différentes formes pour chaque ligand en fonction de pL : --log[L]. b) Quel ligand choisir pour disposer du meilleur fixateur '? c) En fait, on utilise le thiosulfate 8203". Pourquoi '? Données : Constantes globales de dissociation : Ag(NH3); K°d1 : 6><10"8 Ag(SZO3)Î K°d2 = 10"12,8 Ag(CN); ' .K°d3 = 10"21 III - Préparation d'une solution de fixateur Pour fabriquer un fixateur, on utilise du thiosulfate de sodium pentahydraté Na 28203, 5 H20 que l'on dissout dans de l'eau. On constate, lors de la dissolution de ce sel, une diminution de la température. a) Ecrire la réaction de mise en solution d'une mole de Na 28203, 5 H20 . b) Calculer la quantité de chaleur mise en jeu par mole de Na 28203, 5 H20. Tournez la page S.V.P. c) Pour préparer un fixateur, on dissout 200 g de thiosulfate de sodium pentahydraté dans 1 L d'eau. Calculer la quantité de chaleur mise en jeu. Quelle doit être la température de l'eau Ge en °C, avant la dissolution, pour que la température en fin d'opération soit de 0f : 25°C. NB : on considère qu'il n'y a pas d'échange avec le milieu extérieur. (1) Un opérateur distrait n'est pas sûr de la masse m...... de thiosulfate de sodium utilisée. Avec quelle incertitude peut--il déterminer mthi0 s'il a mesuré Be et Of a i 0,5°C et obtenu 9e = 35° C, 0f : 25° C '? On supposera les autres valeurs exactes. Données : AfH°(kJ.mol_l) '-- 644,33 -- 239,66 -- 2602 -- 285,85 aq: solution aqueuse s : solide EUR : liquide Cp (H20) : 75,3 J .K"1 .moF1 dans le domaine de température 0 à 100°C. Masses atomiques (g .mol_l) : Na : 23,0 S = 32,1 0 = 16,0 H = 1,0 Masse volumique de l'eau (considérée constante entre 25 et 35°C) : 996 kg . m"3 IV - Lavage, séchage Après fixage, le film photographique est lavé longuement à l'eau pour éliminer tous les sels. Pour obtenir ensuite un séchage rapide, on emploie un mélange eau-propan-l--ol noté MEP. Le propan-l-ol est désigné par Pl. La température de début d'ébullition du MEP est 0eb =92°C. Après séchage d'une aire de 1 m2 de film, on constate que la température de début d'ébullition du MEP est 0eb : 90° C. \ On donne ci--dessous le diagramme d'ébullition du binaire MEP a pression constante P = 1,013 bar (figure II). Il donne la température en fonction de la fraction molaire en P1, X... et YP1- a) Indiquer le nom des différentes courbes (C1 à C4), des différents domaines (D1 à D4) d'existence des phases liquide et vapeur. b) Quel est le nom attribué à un mélange représenté par le point C ? Quelles sont les propriétés de ce mélange '? c) Quelle est la fraction molaire en P1 du MEP avant (XP1'AV) et après (XP1,AP)SéChag6 '? d) Soit un mélange binaire MEP de fraction molaire en P1, XP1 =0,2 que l'on chauffe de 0 = 250 C à 0 = 94° C. Décrire les phénomènes et préciser l'évolution de la fraction molaire en P1 dans chaque phase. e) On porte un mélange contenant 545,5 g de H20 et 454,5 g de P1 à 0 = 90°C. Quelle est la masse de la vapeur et celle du liquide ? f) Quelle est la composition des produits (distillat et résidu) obtenus par distillation fractionnée d'un MEP de composition XP1 : 0,2 et d'un MEP de composition XP1 : 0,6. Données : Masses molaires ou atomiques : P1 = 60,0 g. mol--1 o = 16,0 g. mol--1 H = 1,0 g. mol"1 Diagramme binaire eau-propan-l--ol établi à partir de points expérimentaux à P : 1,013bar . 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Figure 11 : Fraction molaire en propan--l--ol en liquide Xp1 en vapeur y... Tournez la page S.V.P. V - Récupération de l'argent Les films photographiques après utilisation (radiographies...) sont traités pour récupérer l'argent qu'ils contiennent. Un traitement par des enzymes puis par de l'acide nitrique détruit la gélatine. En fin de traitement, on obtient une solution aqueuse de nitrate d'argent contenant Ag+ à la concentration de 5 >< 10"3 mol.L_l. Pour récupérer l'argent sous forme métallique Ag, on fait réagir du fer à l'état métallique en excès qui peut s'oxyder en Fe 2+. On suit l'avancement de cette réaction R1 en mesurant le potentiel d'une électrode métallique d'argent plongée dans la solution. a) Ecrire l'équation-bilan de la réaction R1. b) Quel est le potentiel E de l'électrode d'argent avant réaction, à 25°C ? c) Quelle est la valeur de la constante d'équilibre K°R1 de la réaction R1 ? Commenter. (1) Quel est le potentiel E; en fin de réaction R1 ? Données : ln10 . RT EO : 0,800V E° : --0,440V ------Ë------ : 0,059 V à 25°C Ag+/Ag Fe2+/Fe VI - Fusion de l'argent récupéré L'argent récupéré est sous forme divisée. Pour obtenir un lingot, on envisage une fusion. Il s'agit de savoir s'il faut prendre des précautions lors de la montée en température (pas de contact avec de l'oxygène ou de l'air). a) Ecrire pour une mole de 02 les réactions d'oxydation de l'argent: AgzO/Ag, Ag202/Ag20, Ag203/Ag202- b) Etablir les expressions numériques de l'enthalpie libre des réactions en fonction de la température selon les approximations d'Ellingham. c) Tracer le diagramme d'Ellingham dans le domaine de température de 0 à 600 K (graduations 1 cm pour 50 K et 1 cm pour 20 kJ). Préciser les domaines d'existence de chaque espèce. Commenter. d) Calculer la température d'équilibre pour Ag 20 / Ag dans de l'oxygène pur à P = 1 bar . e) Calculer la température d'équilibre pour Ag20/ Ag dans de l'air à P = 1 bar (1/5 oxygène, 4/5 azote). f) Conclure. Données à T = 298 K R = 8,32 J . K"1 .mol"1 VII - Rendement de la récupération de l'argent On traite 1000 m2 de film photographique contenant 0,5 g.m_2 d'argent. Après les divers . . . . . . --6 3 traitements chimiques et la fus1on, on obtient un lmgot dont le volume est de V = 38,1 >< 10 m . L'étude cristallographique par diffraction des rayons X montre que l'argent métallique a une structure cubique à faces centrées de paramètre a : 0,40853 nm . a) Dessiner la maille de l'argent. Préciser le nombre d'atomes par maille. b) Quel est le nombre de sites octaédriques '? le nombre de sites tétraédriques ? c) Calculer la coordinence. (1) Calculer la compacité. e) Calculer la masse volumique de l'argent. f) Quel est le rendement n de la récupération de l'argent ? Données : masse argent récupéré m _--------------_-- masse argent récupérable m !' TP Masse atomique Ag= 107,86 g.mol'1 Nombre d'Avogadro N = 6,023 >< 10+23mor1 Fin de l'énoncé