Mines Chimie PC 2023
| Thème de l'épreuve | Utilisation du vanadium dans un système de stockage de l'énergie. Synthèse de la (+)-artémisinine. |
| Principaux outils utilisés | solutions aqueuses, oxydoréduction, diagrammes E-pH, courbes courant-potentiel, thermodynamique, chimie organique, orbitales moléculaires, chimie de coordination |
| Mots clefs | vanadium, batteries à flux rédox, redox flow batteries, artémisinine |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)










Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
A2023 --- CHIMIE PC
Cm
Concours commun
Mines-Ponts
ÉCOLE DES PONTS PARISTECH,
ISAE-SUPAERO, ENSTA PARIS,
TÉLÉCOM PARIS, MINES PARIS,
MINES SAINT-ÉTIENNE, MINES NANCY,
IMT ATLANTIQUE, ENSAE PARIS,
CHIMIE PARISTECH - PSL.
Concours Mines-Télécom,
Concours Centrale-Supélec (Cycle International).
CONCOURS 2023
ÉPREUVE DE CHIMIE
Durée de l'épreuve : 4 heures
L'usage de la calculatrice ou de tout dispositif électronique est interdit.
Les candidats sont priés de mentionner de façon apparente
sur la première page de la copie :
CHIMIE - PC
L'énoncé de cette épreuve comporte 13 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énontcé, il le
signale sur sa copie et poursuit sa composition en expliquant les raisons des
initiatives qu'il est
amené à prendre.
Les sujets sont la propriété du GIP CCMP. Ils sont publiés sous les termes de
la licence
Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de
Modification 3.0 France.
Tout autre usage est soumis à une autorisation préalable du Concours commun
Mines Ponts.
Ce problème comporte deux parties indépendantes intitulées « Utilisation du
vanadium dans un système de
stockage de l'énergie » et « Synthèse de la (+)-artémisinine ».
Les données utiles à la résolution du problème sont fournies à la fin de
l'énoncé (page 15).
Utilisation du vanadium dans un système de stockage de l'énergie
Le vanadium, élément métallique de numéro atomique Z = 23, est
traditionnellement utilisé dans des alliages
métalliques à hautes performances. Depuis les travaux pionniers de Maria
Skyllas-Kazacos dans les années 1980 ,!
d'intenses recherches ont été menées pour mettre à profit les propriétés
d'oxydo-réduction de cet élément pour des
applications dans l'énergie, qui commencent à déboucher sur des systèmes
commerciaux. Cette partie va mettre
en lumière ces propriétés et introduire le principe des Batteries à Flux Rédox
(RFBB pour l'acronyme anglo-saxon),
nouvelle méthode de stockage de l'énergie.
Thermodynamique électrochimique du vanadium en solution aqueuse
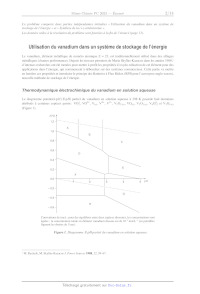
Le diagramme potentiel-p A (E-p A) partiel du vanadium en solution aqueuse à
298 K possède huit domaines
attribués à certaines espèces parmi : VO, VO*, V VV, V°*, V,0; (s) > VO); V,0;
(s) > V,05 et V0, (s)
(Figure 1).
E(V) À
1,2 -
1,0 --
0,8 --
0,6 --
0,4 --
0,2 --
0,0 | | | | >
=
_
=
_--
_--
__--
__--
_--
__--
_--
_
--_--
__--
__--
_--
___--
_
22
_--
--_--
__--
__--
_--
__--
__--
__--
__--
-- 0,4 -
-- 0,6 -
Conventions de tracé : pour des équilibres entre deux espèces dissoutes, les
concentrations sont
égales ; la concentration totale en élément vanadium dissous est de 10? mol-L'!
(en pointillés
figurent les droites de l'eau).
Figure 1. Diagramme E-bpH partiel du vanadium en solution aqueuse.
TM. Rychcik, M. Skyllas-Kazacos J. Power Sources 1988, 22, 59-67.
Page 1/13
Q1- Identifier les nombres d'oxydation des espèces du vanadium considérées.
Q2- Attribuer chaque zone du diagramme à une espèce, en justifiant pourquoi
deux d'entre elles
n'apparaissent pas dans le diagramme (voir annexe page 13).
Q3- Calculer l'équation de la frontière entre les zones D et G (voir annexe
page 13).
En augmentant le p Æ d'une solution, initialement très acide (p 7 = 0), de
l'espèce prépondérante en A (Figure 1)
un début de précipitation est observé à p/= 1,28.
Q4- Écrire une équation-bilan possible pour la dissolution de ce précipité
quand le pA diminue et calculer
la constante d'équilibre de la réaction associée (on considèrera que la
concentration totale en élément vanadium
dissous est de 10? mol-L-").
Q5- Calculer le potentiel standard du couple V,0: 4/VO**
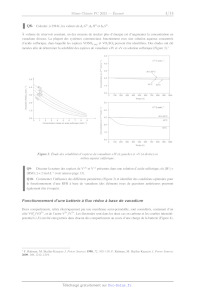
La variété des nombres d'oxydation du vanadium rend possible des applications
dans des systèmes de batteries, et
en particulier des batteries à flux rédox (RFB). Le principe est le suivant :
deux réservoirs contiennent des solutions
où des espèces appartenant à deux couples rédox distincts sont présentes
(Figure 2). Le transfert électronique se
fait par l'intermédiaire d'électrodes, généralement en carbone, et une membrane
semi-splitéable fait la connexion
électrique entre les deux compartiments, en étant splitéable à des ions comme
H*. Dans le cas du vanadium, les
deux compartiments sont occupés par les couples V*"/V#V et V#il/V#l en milieu
fortement acide.
Convertisseur
Alternatif/continu
mn
O
C
O
QA
nn
©
O©O
O
TD
O
=
O
©
Li
=
|
i
LE © :
D:
= © S 2; = ©
oO > a Ci oO >
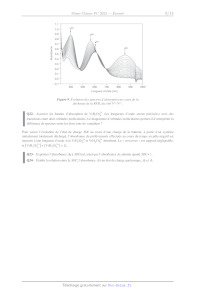
O à O <;,:O O à 0) O o O :5= 0) O D © D oev:oe D D © G D O D" LLI Q: V+Vn/#IV LL c: \/+#n7#l D Pompe Pompe Figure 2. Schéma de principe d'une batterie à flux rédox. Q6- Écrire l'équation-bilan de la réaction d'oxydo-réduction se produisant dans la batterie, en supposant que les espèces prédominantes sont les mêmes que précédemment (Figure 1, on se placera dans le sens producteur d'énergie). D'après le diagramme £-p} (Figure 1) à quelle réaction parasite pourrait-on s'attendre ? En fait, cette réaction parasite ne se produit que marginalement, pour des raisons cinétiques. Q7- Exprimer la différence de potentiel entre les deux compartiments en fonction des potentiels standard, du pet des concentrations des différentes espèces du vanadium. Préciser les facteurs susceptibles d'améliorer les performances de la pile. Des mesures à différentes températures montrent un coefficient de température de la pile ( --) de l'ordre de 1mV-K. Page 2/13 _ } 0 0 0 , , T 2 7T Tr ° | Q8- Calculer, à 298 K, les valeurs de A,.G°,A,H° et A,S À volume de réservoir constant, un des moyens de stocker plus d'énergie est d'augmenter la concentration en vanadium dissous. La plupart des systèmes commerciaux fonctionnent avec une solution aqueuse concentrée d'acide sulfurique, dans laquelle les espèces VOSO; 3 et VO,SO, peuvent être identifiées. Des études ont été menées afin de déterminer la solubilité des espèces de vanadium +IV et +V en solution sulfurique (Figure 3).2 5,0 V+V 2 molL"1 4,0 - 3,0 -- 20 à 30°C 5,0 -- 2,0 TTTZZIZZ-E------------ 1,0 + 40°C 50°C Concentration en V+Y (mol:L-1) 0 100 200 300 400 500 600 700 800 900 1000 Temps (h) 5,0 Solubilité VOSO, (mol-L-1) V+V 3 mol-L"1 4,0 - 20 à 30°C 3,0 0,0 gs 0 1 2 3 4 5 6 7 8 9 Concentration initiale en acide sulfurique (mol-L-) 0 - 50°C 1,0 - Concentration en V*YV (mol-L"1) 0,0 | | | | | | 0 100 200 300 400 500 600 700 800 900 1000 Temps (h) Figure 3. Étude des solubilités d'espèces de vanadium +IV (à gauche) et +V (à droite) en milieu aqueux sulfurique. Q9- Discuter la nature des espèces de V*!" et V*Y présentes dans une solution d'acide sulfurique, où [H*] = [HSO:4] = 2 mol:L'! (voir annexe page 13). Q10- Commenter l'influence des différents paramètres (Figure 3) et identifier des conditions optimales pour le fonctionnement d'une RFB à base de vanadium (des éléments issus de questions antérieures pourront également être évoqués). Fonctionnement d'une batterie à flux rédox à base de vanadium Deux compartiments, reliés électriquement par une membrane semi-splitéable, sont considérés, contenant d'un côté VOS /VO'*, et de l'autre V**/V**. Les électrodes sont dans les deux cas en carbone et les courbes intensité- potentiel (i-E) ont été enregistrées dans chacun des compartiments au cours d'une charge de la batterie (Figure 4). 2 F. Rahman, M. Skyllas-Kazacos J. Power Sources 1998, 72, 105-110. F. Rahman, M. Skyllas-Kazacos J. Power Sources 2009, 789, 1212-1219. Page 3/13 D Y Figure 4. Courbes (i-E) acquises dans chacun des deux compartiments au cours d'une charge de la batterie. Q11- Schématiser et annoter le montage expérimental permettant d'obtenir de telles courbes. Q12- Recopier les courbes de la Figure 4 en indiquant les différentes réactions d'oxydo-réductions qui peuvent se dérouler. Justifier la présence ou l'absence de paliers. Identifier l'anode et la cathode en mode pile. Q13- D'après les graphes (Figure 4), que peut-on dire sur la cinétique des couples du vanadium ? Q14- Dans le cas où la batterie fonctionne en mode charge, faire apparaître un exemple de tension et de courant aux bornes du montage. Préciser les évolutions qualitatives des courbes (i-E) avec le temps (des schémas pourront utilement étayer le propos). Une des analyses usuelles pour suivre l'évolution du fonctionnement d'une batterie est la chronopotentiométrie, où le système est soumis à des cycles de charges/décharges. Durant chaque cycle, le courant est maintenu constant (il sera dans notre cas le même, en valeur absolue, entre charges et décharges). S'il est suffisamment faible, le comportement des couples rédox suit à chaque instant la relation de Nernst. Si les pertes sont négligeables, la Figure 5 donne un exemple pour une charge et une décharge. >
L
< _ temps Figure 5. Courbes chronopotentiométriques pour une charge et une décharge. Q15- En assimilant les réactions d'oxydo-réductions dans les deux compartiments à de simples transferts monoélectroniques (donc à des réactions élémentaires), exprimer les concentrations des différentes espèces en Page 4/13 fonction du courant appliqué, du temps écoulé et du volume du compartiment. On précisera si l'on est dans le cadre d'une charge ou d'une décharge. Les concentrations initiales en réactifs seront notées C (les produits sont supposés absents à l'état initial). Q16- En déduire une relation entre la tension appliquée, les potentiels standard, le courant appliqué, le temps écoulé et Co. Confirmer les tendances de la Figure 5. Suivi de l'état de charge de la batterie par spectrométrie UV-visible La présence de réactions parasites, même minoritaires, ainsi que le « crossover », c'est-à-dire la contamination progressive d'un compartiment par des espèces de l'autre pôle, rendent nécessaire la mise au point de méthodes non électrochimiques de suivi de l'état de charge SOC (State Of Charge) de la batterie : [V**] [Vo;] ) SOC mn Ua +137" 1V02] + (VO; En particulier, nous allons nous intéresser au suivi de l'état de charge SOC de la batterie par spectroscopie UV- visible. À cet effet on se propose d'étudier les propriétés spectroscopiques de V(HO)* et V(H0O)*, complexes octaédriques notés ML, (Figure 6). É L LL, AE M L D Xs7 L y Figure 6. Géométrie d'un complexe octaédrique. Le diagramme d'orbitales moléculaires et les représentations des orbitales des fragments des ligands (considérés comme 6-donneurs purs n'intervenant que par l'intermédiaire d'une orbitale de type s) sont donnés Figure 7. Les fragments sont placés à une énergie unique de -15 eV, tandis que les orbitales atomiques du vanadium impliquées sont à ---13 et -7 eV, respectivement. ns ---- |-7 eV (n-l)d -- |-13ev -- -- -- 4y yz L -- -- -- 5e] -- ®,ieli:6] Figure 7. Diagramme d'orbitales moléculaires de ML (gauche) et orbitales des fragments des 6 ligands ®;. | Q17- Donner la configuration électronique de l'ion V*. Page 5/13 Q18- Identifier les interactions entre orbitales atomiques métalliques et orbitales des fragments des ligands. Rassembler les résultats en remplissant un tableau, comme celui ci-dessous, en indiquant « oui » s'il y a interaction et en laissant la case vide s'il n'y a pas d'interaction. dyy d,, dyz d,2_y2 d,2 S ®; D; D; D, ®: Po V Z Z y Z X X " X d d Xy d,z dy d x2y2 d,2 | Q19- Préciser le diagramme énergétique du complexe V(H20)/"*. Justifier le caractère o-donneur du ligand. En réalité, réduire l'interaction métal-ligand à une interaction purement © n'est pas correct. Les deux dernières orbitales moléculaires occupées de l'eau, d'énergies proches (respectivement ---16 et ---15 eV), présentent les géométries indiquées Figure 8. Figure 8. Orbitales moléculaires les plus hautes occupées de l'eau, d'énergies --16 (gauche) et ---15 eV (droite). Q20- Dire en quoi la représentation de Lewis de l'eau est en désaccord avec ces orbitales moléculaires. Q21- En ne considérant qu'une seule interaction V-H,0 selon l'axe MZ, identifier, schéma à l'appui, les recouvrements entre les orbitales moléculaires de l'eau et les orbitales atomiques du vanadium. Dessiner le nouveau diagramme des orbitales moléculaires en précisant les modifications apportées, sachant que les ligands étaient précédemment considérés comme o-donneurs purs, n'intervenant que par l'intermédiaire d'une orbitale de type s (Figure 7). Le passage de l'état fondamental à un état excité est responsable de transitions électroniques dont la conséquence est l'absorption de radiations allant de l'ultra-violet au proche infrarouge. La Figure 9 donne l'évolution des spectres d'absorption entre 300 et 1000 nm au cours de la décharge d'une RFEB à base de vanadium.* Les flèches «V#* » et « V°** » permettent la lecture du sens d'évolution. * J. Geiser, H. Natter, R. Hempelmann, B. Morgenstern, K. Hegetschweiler Z. Phys. Chem. 2019, 233, 1683-1694. Page 6/13 1,1 1,0 -- 0,9 - 0,8 - 074 / 0,6 - UIZ 0,5 -- Y FK 0,4 À 0,3 - 0,2 - 0,1 - 0,0 - -- 0,1 Absorbance | | | | | | 400 500 600 700 800 900 1000 Longueur d'onde (nm) Figure 9. Évolution des spectres d'absorption au cours de la décharge de la RFB, du côté V**/V?*. Q22- Associer les bandes d'absorption de V(HO)* (les longueurs d'onde seront précisées) avec des transitions entre deux orbitales moléculaires. Le diagramme d'orbitales moléculaires permet-1il d'interpréter la différence de spectres entre les deux ions du vanadium ? Pour suivre l'évolution de l'état de charge SOC au cours d'une charge de la batterie, à partir d'un système initialement totalement déchargé, l'absorbance de prélèvements effectués au cours du temps au pôle négatif est mesurée à une longueur d'onde 1 où V(HO)* et V(HO)* absorbent. Le « crossover » est supposé négligeable, et [VOLO)*] + [VOLO)*] = @. Q23- Exprimer l'absorbance 40 à SOCnul, ainsi que l'absorbance 41 atteinte quand SOC = 1. Q24- Établir la relation entre le SOC, l'absorbance À à un état de charge quelconque, 4 et Ai. Page 7/13 Synthèse de la (+)-artémisinine La (+)-artémisinine (1) (Figure 10), molécule isolée de la plante Artemisia annua (utilisée depuis très longtemps dans la pharmacopée chinoise), est actuellement une des molécules les plus efficace dans la lutte contre le paludisme. Sa synthèse a fait l'objet de multiples publications, dont celle de S. Cook et C. Zhu qui va être étudiée par la suite. Figure 10. La (+)-artémisinine (1) Q25- Dénombrer les centres stéréogènes de la (+)-artémisinine (1). Q26- Déterminer les stéréodescripteurs des centres stéréogènes 6 et 12 de cette molécule. Q27- Quel est le sens du préfixe (+) devant le nom de la molécule ? Nommer et décrire en quelques lignes la technique expérimentale permettant la mesure de la grandeur physique associée à ce phénomène. Le composé de départ de la synthèse' est le composé carbonylé o.f-insaturé 2, de formule brute C6H:O, qui présente les caractéristiques spectroscopiques RMN 'H suivantes : * Signal G(ppm)* [? Multiplicité 1 200-204 2 m [* 2 238-232 2 m O7 Y 3 2,43 2 t,J =7,2 Hz 2 4 601 1 d,J = 10,1 Hz 5 7,00 1 dt,J= 10,1 et 4,2 Hz 4 Déplacement chimique. ? Intégration. ' m : multiplet, s : singulet, d : doublet, t : triplet. Q28- Proposer une structure pour le précurseur 2 et donner son nom en nomenclature systématique. Q29- Attribuer chacun des signaux aux différents protons de la molécule 2 (la multiplicité du signal RMN 'H n°5 devra être justifiée). La synthèse de la (+)-artémisinine (1) a été réalisée à partir de l'énone 2 (Schéma 1).* # C.Zhu, S. P. Cook J. Am. Chem. Soc. 2012, 134, 13577-13579. * C.C. Cosner, P. J. Cabrera, K. M. Byrd, A. M. A. Thomas, P. Helquist Oreg. Lett. 2011, 13, 2071-2073. Page 8/13 SON 1) Cu(OTf), + L* cat. OTIPS LÉ x _(CH}Zn(Tég) 1) TSNHNH, 5 (1,2 éc) y DR 2) nBuLi (4 éa) Et, AICI cat. 3) DMF (3,5 éd) 2 puis H30* MeO OTIPS D Ph PdCI, cat. O )'"'Et R pp 1 L* -- P-N O, (excès / 2( ) o ÿE: Ph MeO OTIPS © O O OTf = O-S-CF; Ts = --{ Yi: DMF= TIPS = ?-Si(iPr) 0 O NMe; Schéma I. Synthèse de la (+)-artémisinine (1) à partir de l'énone 2. La formation de 3 à partir de 2 se fait en deux étapes, menées continûment, dans le toluène anhydre (la réactivité de l'organozincique (CH;)2Zn sera considérée comme similaire à celle d'un organomagnésien). Pour en comprendre le déroulement, les caractéristiques des orbitales frontalières HO et BV de l'énone 2 ont été déterminées par la méthode de Hückel simple (Tableau 1). Tableau I. Caractéristiques des orbitales frontalières du précurseur 2: | Coefficient sur l'atome n° Orbitale l 2 3 À 5 6 3/7 X5 LL HO 0,54 --0 ,068 --0,62 --0 ,48 0,30 0.043 107 Y6 2 BV 0,37 --0,56 --0,20 0,66 --0,19 0,16 * Chaque coefficient est associé à la contribution d'une orbitale atomique d'axe perpendiculaire au plan moyen de la molécule. X et Y ont été modélisés comme des méthyles. Q30- En s'aidant des données (Tableau 1), décrire la réactivité de la molécule 2 dans le contexte de la synthèse (Schéma 1). Proposer un mécanisme réactionnel simplifié justifiant la formation du composé 3 en précisant l'intermédiaire formé à l'issue de la première étape. Q31- Préciser le rôle possible du complexe de cuivre et l'origine de la chiralité observée pour le composé 3 ? Q32- Le composé 4 a été préparé à partir de 3 via une réaction de Shapiro (Document 1). Proposer un mécanisme réactionnel pour la dernière étape de cette séquence (ajout de DMEF puis traitement par H:30*). Page 9/13 Document 1. Réaction de Shapiro $ La réaction de Shapiro, ou décomposition de tosylhydrazones, est une réaction dans laquelle une cétone ou un aldéhyde sont convertis en un alcène, via une hydrazone intermédiaire, en présence d'au moins deux équivalents d'un organolithien (la réactivité d'un organolithien sera considérée comme similaire à celle d'un organomagnésien). À R TSNEINFI2 JR nBuLi ( nBuLi (> 2 éq) KR ee KR
R
E (électrophile) : H*, R'CHO, ...
L'alcényllithium, intermédiairement formé, est ensuite traité par un
électrophile pour conduire à un alcène
fonctionnalisé.
Q33- Pourquoi l'utilisation d'un solvant protique n'est-elle pas possible dans
les deux dernières étapes de la
formation de 4 (Schéma 1) ?
La synthèse de l'acétal de cétène silylé 5 (Schéma 1), utilisé dans la
formation de 6 à partir de 4, a été réalisée à
partir de l'acide propanoïque selon la séquence suivante :
e L'acide propanoïque, traité par du chlorure de thionyle (SOC), conduit à la
formation de 8 ;
e _S est traité par du méthanol anhydre, en présence de triéthylamine, pendant
1 heure à température
ambiante pour conduire au composé 9 avec un rendement de 90 % ;
e _ 9Jesttraité par du diisopropylamidure de lithium (LDA) dans le
tétrahydrofurane à -78 °C, puis l'addition
de 1 équivalent de chlorure de tri(isopropyl}silyle (((CH3)2CH)3S1CI, TIPSCI)
permet de former le
composé 5.
5 est obtenu sous forme d'un mélange de deux stéréoisomères, en proportion 3/1
en faveur du plus stable.
Q34- Écrire l'équation-bilan de la réaction de formation de 8.
Q35- Identifier 9 et proposer un mécanisme réactionnel pour sa formation.
Q36- Proposer un mécanisme réactionnel justifiant la formation de 5 à partir de
9.
Q37- Préciser lequel des stéréoisomères de 5 est le plus stable.
Q38- Quel autre produit aurait-il pu se former ?
Afin d'expliquer la formation de l'orthoester 6, les caractéristiques des
orbitales frontalières des molécules 4 et 5
sont rassemblées dans le Tableau 2.
R. H. Shapiro, M. F. Lipton, K. J. Kolonko, R. L. Buswell, L. A. Capuano,
Tetrahedron Lett. 1975, 16, 1811-1814.
Page 10/13
Tableau 2. Caractéristiques des orbitales frontalières des molécules 4 et 5.
.. |
2, p' Orbitale Coefficient sur l'atome n
TT 1 2 3 4 5 6
:
: HO 046 0,15 049 0,56 0,34 0,30
4 BV 0,41 0,51 _0,13 _0,63 _0,04 0.21
Coefficient sur l'atome n°
. |
riPso. _ome Orbitale 1 2 3 4
2
RE HO 0.77 0.49 029 025
BV 061 0.75 019 0.19
Q39- En utilisant les données du Tableau 2, envisager les réactions
susceptibles de se produire entre les deux
molécules.
Q40- Comparer la régiosélectivité prédite dans chaque cas avec celle observée
expérimentalement, puis
conclure sur le mécanisme concerté susceptible de se produire majoritairement.
En réalité, en l'absence d'acide de Lewis, la réaction ne se fait pas. De plus,
les différents stéréoisomères formés
invalident l'hypothèse d'un mécanisme concerté.
Q41- Proposer un mécanisme réactionnel plausible, faisant intervenir l'acide de
Lewis Et AICTI, pour rendre
compte de ces observations.
La réaction permettant le passage de 6 à 7 (Schéma 1) est une réaction de type
Wacker, permettant la formation
de cétones à partir d'alcènes (Schéma 2).
[Pd(ll)]
1/2 C PT CN
[Pd(O [Pd(ll) -- |
O Ve
R° 17 À
+B V
B
HO RE
nn (1)] Pd(i] _J*
is Fr
LE
Schéma 2. Cycle catalytique simplifié de la réaction de Wacker.
Q42- Identifier les espèces A, B et C intervenant dans le cycle catalytique
(Schéma 2).
Q43- Nommer les étapes E, ILE, IV, V et VI du cycle catalytique.
Q44- Écrire l'équation-bilan de la réaction.
Q45- Un second produit minoritaire est obtenu au cours de l'étape d'oxydation
de l'orthoester 6 (Schéma 1).
Proposer une structure pour ce composé.
Page 11/13
L'artémisinine est finalement obtenue par traitement du composé 7,
préalablement purifié, d'abord par de l'oxygène
singulet formé in situ, puis par agitation en présence d'APTS (TsOH), avec un
rendement de 30 % après
recristallisation.
Q46- Sachant que le composé monocyclique 8 (Figure 11) est formé
intermédiairement lors du traitement de
7 par l'oxygène moléculaire puis par l'APTS, proposer une suite d'étapes
mécanistiques permettant d'aboutir à
la formation de 1 à partir de ce précurseur 8.
Figure 11. Intermédiaire menant à la formation de la (+)-artémisinine (1).
Fin de l'épreuve
Page 12/13
Annexes
Annexe 1. Constantes usuelles et approximation de calculs.
Constante de Faraday : F* 10° Cmol-!
Vitesse de la lumière : c* 3.108 m-s-!
Constante de Planck : A = 6,6.107?4 JS
Il sera considéré que -- X Inx = 0,06 x log x à 298 K ; 107% =3,6-10 7;
log(3,6-102) = --1 4 ; log(2) = 0,3.
Annexe 2. Potentiels standards.
| Couple | VV VAN He VO#/V Ou VO VO VO#/V# VOS/IVO® OxefHbO |
| E0 (V) | --1,13 --0,35 0,00 0,05 0,30
Annexe 3. Constantes d'équilibres.
VOSO/(a0) + Hi VO?+ + HSO,4 K; = 1003
VOSSOs + HY == VO,;* + HSO; K, = 101:
Annexe 4. RMN 'H (gamme de déplacements chimiques)."
Proton Ô (ppm)
4/ 0,8--1,3
4/-- 1,5-24
H
a 23-29
Mai T
non 2,3-3,7
H7 07 3,4-4,2
A 4,5-72
H
a 65-20
O
9,0-10,5
4
O
6-12
ans,
0,44
1,00
1.23 |
TE. Prestsch, P. Bühlmann, M. Badertscher, Structure Determination of Organic
Compounds, Springer-Verlag, Berlin,
Heidelberg, 4 edn. 2009.
Page 13/13