CONCOURS COMMUN 2008
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie
(toutes filières)
Lundi 19 mai 2008 de 8h00 à 12h00
Barème indicatif : Physique environ 2/3 - Chimie environ 1/3
Instructions générales :
x
x
x
x
Les candidats doivent vérifier que le sujet comprend 8 pages numérotées 1/8,
2/8, ...8/8
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres correspondant à l'épreuve commune de Physique-Chimie.
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou
mal présentées seront pénalisées.
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
N.B. Les problèmes de physique sont indépendants. Les diverses parties peuvent
être traitées dans l'ordre
choisi par le candidat. Il prendra toutefois soin de bien les séparer dans ses
copies et de bien numéroter les
questions. Les diverses parties de chimie sont également indépendantes.
Remarque importante :
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale
sur sa copie et poursuit sa composition en expliquant les initiatives qu'il est
amené à prendre.
L'emploi d'une calculatrice est autorisé.
Physique
A- Électrocinétique : circuits et mesures
A.1.
Modélisation linéaire d'un circuit
A.1.1)
Le circuit ci-contre est alimenté par un générateur dit « de Thévenin », dipôle
actif linéaire de résistance interne Rg et de force électromotrice e(t). Donner
le schéma équivalent ainsi que les grandeurs caractéristiques du générateur
linéaire « de Norton » équivalent entre les mêmes bornes.
A.1.2)
Dans ce circuit, l'intensité i(t) fournie par le générateur se divise entre une
inductance pure L (qui représente une bobine de résistance négligeable) et un
résistor (résistance R) ; en respectant les notations du schéma, donner trois
expressions de u(t) en régime quelconque, en fonction de i(t), i1(t) et des
données.
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Rg
e(t)
u(t) i(t)
L
i1 (t)
R
Page 1/8
A.1.3)
La tension e(f < t < 0) est égale à une valeur constante notée E ; déterminer rapidement la tension u(t = 0) ainsi que les intensités i(t = 0) et i1(t = 0). A.1.4) A t = 0, on « éteint » le générateur, qui devient équivalent à sa seule résistance interne (ce qui signifie qu'on a e(t > 0) = 0) ; établir l'équation différentielle régissant
l'évolution ultérieure de u(t),
et faire apparaître la constante de temps W du circuit.
A.1.5)
En utilisant une propriété remarquable d'une grandeur propriété à préciser,
déterminer
u(t = 0+).
A.1.6)
Déterminer complètement u(t > 0) puis donner l'allure de la représentation
graphique de u pour
t · [ 10W , 10W ].
A.2.
Générateur et oscilloscope
On s'intéresse à quelques caractéristiques de ces deux appareils essentiels.
A.2.1)
On dispose d'un voltmètre de très grande résistance interne (considérée
infinie), d'un générateur de tension (GBF) et de boîtes de résistances
réglables. La force électromotrice du générateur
étant fixée (en continu), on effectue entre ses bornes les deux mesures
suivantes :
mesure (1) : on mesure une tension U = 6 V pour une résistance de charge
infinie ;
mesure (2) : on mesure une tension de 3 V pour une charge égale à 50 :.
Déduire de ces mesures la résistance interne Rg et la force électromotrice E du
générateur étudié.
A.2.2)
On alimente désormais par ce générateur une association R-C série, en régime
sinusoïdal de
pulsation Z réglable. Quelle sera, en module, l'impédance de charge minimale du
générateur ? A
quelle condition (qualitative) pourra-t-on considérer le générateur comme idéal
?
On supposera cette condition remplie dans la suite, avec R = 4,7 k: et C = 22
nF.
A.2.3)
En l'absence d'oscilloscope branché sur le circuit, déterminer la fonction de
transfert complexe en tension H si la grandeur de sortie est la tension aux
bornes du condensateur ; quel est le filtrage ainsi réalisé ? Comment
définit-on la pulsation de coupure Zc d'un filtre de cette nature et
comment s'exprime-t-elle ici ?
Application numérique : calculer la fréquence de coupure du filtre.
A.2.4)
On utilise un oscilloscope dont les caractéristiques d'entrée sont indiquées :
« 1 M:, 25 pF » ;
dans la suite, on désigne par Ro et Co la résistance et la capacité
correspondantes. Cet appareil,
branché sur le filtre précédent, correspond ainsi au circuit suivant :
Y
e
R
C
s
Ro
Co
Déterminer simplement le gain en tension à basse fréquence, noté Ho.
A.2.5)
Exprimer l'admittance complexe Y. Quelle est la limite à basse fréquence du
déphasage de la
tension s par rapport à l'intensité i parcourant le dipôle équivalent
d'admittance Y ?
A.2.6)
Déterminer la nouvelle fonction de transfert H' = s / e sous la forme Ho /
[1+j.Z / Zo] (on pourra
s'aider du calcul de Y).
A.2.7)
Comparer Ho et la nouvelle fréquence de coupure aux valeurs précédentes
(question 2.3), et
conclure quant à l'utilisation de l'oscilloscope pour étudier le filtre RC.
·············
CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique-Chimie (toutes filières)
Page 2/8
B- Mécanique : modélisation d'un oscillateur
Soit un point matériel de masse m, en mouvement dans le champ de pesanteur g
uniforme.
Les caractères gras droits désignent des grandeurs vectorielles.
B.1.
Étude énergétique d'un oscillateur
B.1.1)
Définir l'énergie potentielle associée à une force F. Pour une force de rappel
élastique de
constante k, déterminer l'expression de l'énergie potentielle en fonction de
l'écart x à la position
d'équilibre, à une constante additive près.
B.1.2)
On considère un mouvement conservatif de m sur l'axe horizontal Oy, autour
d'une position
d'équilibre Y0, avec l'énergie potentielle Ep(y) = E0 + D.(yY0)2, où D est une
constante positive.
Établir l'équation différentielle du mouvement et en déduire qu'il s'agit
d'oscillations harmoniques
dont on précisera l'expression de la période.
B.1.3)
Application : considérons le dispositif horizontal de la figure suivante.
Les ressorts sont identiques, de raideur k et de longueur à vide L0, tandis que
les points d'attache sont
m
y
distants de 2L0.
Exprimer Ep(y) si y désigne l'écart à la position
d'équilibre, et calculer la période T0 des oscillations de m si m = 200 g et k
= 40 N/m.
B.1.4)
On envisage l'existence d'un frottement fluide d'intensité proportionnelle à la
vitesse de m par
rapport à l'axe du mouvement : F = E.m.v où E est une constante positive.
Donner la dimension ou l'unité SI de E.
B.1.5)
Établir l'équation différentielle du mouvement. Quelle est la valeur numérique
maximale de E
permettant les oscillations de m ?
B.2. Modélisation d'un dispositif expérimental
B.2.1)
On dispose d'un banc à coussin d'air rectiligne (Ox), incliné par une cale de
hauteur h d'un
angle D par rapport à l'horizontale, selon la figure ci-dessous. Sur ce banc,
un aimant est fixé à
l'origine O, et un autre aimant, de masse m, est fixé sur un palet mobile sans
frottement :
x
O
m
h
D
L
Les aimants sont orientés de telle sorte qu'ils se repoussent mutuellement. La
possibilité pour m
d'osciller autour d'une position d'équilibre résulte de la compétition entre la
répulsion électromagnétique, réduite à une force notée F, prépondérante lorsque
les aimants sont proches, et le poids,
qui devient prépondérant lorsque la distance augmente.
Faire un bilan des forces à l'équilibre sur un schéma.
B.2.2)
Sans connaissances préalables en électromagnétisme, on cherche dans la suite à
vérifier si la
force électromagnétique agissant dans cette expérience peut être modélisée par
une loi de la forme :
F(x) = k.(x0 / x)n.ex, avec k > 0 et n entier naturel. Exprimer dans cette
hypothèse la position
d'équilibre xe en fonction de xo, k, m, g, L, h et n dans le cas des petits
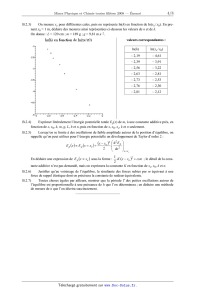
angles (h << L). NB : cette approximation sera toujours utilisée dans la suite. CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 3/8 B.2.3) On mesure xe pour différentes cales, puis on représente ln(h) en fonction de ln(xe / x0). En prenant x0 = 1 m, déduire des mesures ainsi représentées ci-dessous les valeurs de n et de k. On donne : L = 120 cm ; m = 189 g ; g = 9,81 m.s2. valeurs correspondantes : ln(h) ln(xe / x0) 2,19 4,61 2,39 3,91 2,56 3,22 2,63 2,81 2,73 2,53 2,76 2,30 2,81 2,12 B.2.4) Exprimer littéralement l'énergie potentielle totale Ep(x) de m, à une constante additive près, en fonction de x, x0, k, m, g, L, h et n, puis en fonction de x, x0, xe, k et n seulement. B.2.5) Lorsqu'on se limite à des oscillations de faible amplitude autour de la position d'équilibre, on rappelle qu'on peut utiliser pour l'énergie potentielle un développement de Taylor d'ordre 2 : Ep x | Ep x xe x xe 2 2 § d2E p .¨ ¨ dx 2 © · ¸ ¸ ¹x xe 1 .K . x xe 2 cste ; le détail de la cons2 tante additive n'est pas demandé, mais on exprimera la constante K en fonction de xe, x0, k et n. En déduire une expression de E p x | xe sous la forme : B.2.6) Justifier qu'au voisinage de l'équilibre, la résultante des forces subies par m équivaut à une force de rappel élastique dont on précisera la constante de raideur équivalente. B.2.7) Toutes choses égales par ailleurs, montrer que la période T des petites oscillations autour de l'équilibre est proportionnelle à une puissance de h que l'on déterminera ; en déduire une méthode de mesure de n que l'on décrira succinctement. ············· CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 4/8 C- Mesures thermodynamiques On rappelle que la variation d'enthalpie massique 'h d'un corps pur lors d'un changement d'état physique est aussi appelée « chaleur latente de changement d'état » et notée L. Afin d'éviter les confusions, on notera le temps t, la température absolue T et la température en degrés Celsius T ; pour les applications numériques : T = T + 273,15. C.1. Expressions du premier principe C.1.1) Rappeler l'expression du premier principe de la thermodynamique, entre deux états d'équilibre quelconques d'un système fermé globalement immobile dans le référentiel d'étude. Expliquer très simplement la différence entre « travail » et « transfert thermique ». C.1.2) On s'intéresse à des systèmes de variables d'état (P, V, T), pour lesquels le seul travail est celui des forces pressantes ; à partir de l'expression précédente, démontrer la relation entre la variation d'enthalpie du système et le transfert thermique dans le cas particulier de transformations isobares. ············· C.2. Calorimétrie adiabatique Le système étudié, constitué de n moles d'air assimilé à un gaz parfait et d'une masse m de cuivre solide, est contenu dans un cylindre schématisé ci-dessous ; on précise que : piston mobile x le piston est mobile sans frottement, les autres parois sont fixes ; x les éléments hachurés sont athermanes (i.e. imperméables aux transferts thermiques), tandis que la paroi (F) permet ces tranferts. xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxx xxx xxx xxx xxx xxx xxx xxx xxx GP P0 cuivre ext. xxx xxx xxx xxxxxxxxxxx cste xxx xxxxxxxxxxx xxx xxxxxxxxxxx xxx xxxxxxxxxxx xxx (F) xxxxxxxxxxx xxx xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx xxx xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx données : - coefficient de Laplace du gaz : J = 7 / 5 ; R = 8,314 J.mol1.K1 ; n = 1 mol ; - capacité thermique massique du cuivre : c = 385 J.kg1.K1 ; m = 269 g ; - P0 est constante ; les valeurs de J et de c sont ici indépendantes de la température ; C.2.1) Comment définit-on les capacités thermiques CV et CP d'un système thermodynamique ? Simplifier ces expressions dans le cas du gaz parfait et établir dans ce cas les expressions des capacités molaires CV,M et CP,M en fonction du coefficient J et de la constante R des gaz parfaits. C.2.2) La température extérieure étant restée très longtemps égale à T0, le fond (F) du cylindre est mis en contact avec une source (ou thermostat) à la température T1 ; on laisse le système atteindre l'équilibre. Le volume V occupé par le gaz subit une diminution relative de 5 % à partir de la valeur initiale V0. En déduire la température Celsius finale si T0 = 27 °C. C.2.3) En fonction des températures et des données, exprimer la variation d'enthalpie du système lors de la transformation décrite ci-dessus, sous la forme 'H = C'. 'T. Quelles propriétés essentielles de l'enthalpie utilise-t-on pour établir cette expression ? C.2.4) En déduire l'expression du transfert thermique Q algébriquement reçu par le système à travers (F). Faire l'application numérique et interpréter son signe. C.2.5) Exprimer et calculer la variation d'énergie interne 'U du système. Interpréter la différence entre 'U et 'H dans le cadre du premier principe. C.2.6) On rappelle des expressions usuelles de la fonction d'état entropie S : x S GP T , V n.CV , M .ln T x S phase condensée T C.ln T n.R.ln V cste ou SGP T , P n.CP , M .ln T n.R.ln P cste ; cste pour une phase condensée de capacité thermique C. En fonction des températures et de C', exprimer l'entropie créée lors de la transformation. Faire l'application numérique et conclure. ············· CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 5/8 C.3. Calorimètre à basse température Sous pression atmosphérique, la température d'équilibre liquide-gaz du diazote est Te = 77,4 K. Il est commode de conserver l'azote liquide dans un « vase de Dewar », c'est-à-dire un récipient bien isolé thermiquement (mais non parfaitement) et communiquant avec l'atmosphère : le faible apport d'énergie à travers le vase entretient une lente ébullition du liquide qui s'évapore lentement. On dispose ainsi d'une « source de froid » commode et économique. C.3.1) Afin de mesurer la chaleur latente Lv de vaporisation de l'azote sous pression constante, on place sur une balance électronique un vase Dewar ouvert contenant de l'azote liquide : la diminution de la masse mesurée M au cours du temps traduit l'évaporation de l'azote. Le mode opératoire est le suivant : phase (1) : entre t = 0 et t = t1, on alimente une résistance R plongée dans le calorimètre : tension U et intensité I constantes ; phase (2) : le chauffage est coupé à t1 = 10 minutes. La masse M mesurée en grammes est enregistrée à intervalles réguliers de t = 0 à t2 = 15 minutes (figure ci-contre : t en secondes) ; on précise qu'à tout instant il reste de l'azote liquide dans le récipient. Comment évolue la température du liquide supposé homogène (justifier) ? C.3.2) Pourquoi la masse diminue-t-elle même en l'absence de chauffage ? Pourquoi est-il difficile de l'empêcher ? C.3.3) Pour chaque phase de l'expérience, estimer la masse d'azote évaporé (m1 et m2). Calculer le rapport noté r des vitesses d'évaporation (phase1 / phase2). C.3.4) On désigne par PJ la puissance apportée par effet Joule et par P celle des autres transferts thermiques, puissances algébriquement reçues par l'azote et supposées constantes. Établir pour chaque phase de l'expérience une relation entre m1, m2, Lv, PJ, P et les dates nécessaires. C.3.5) En déduire une expression littérale de Lv indépendante de P, puis calculer sa valeur numérique si U = 8,5 V et R = 10 :. ············· CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 6/8 CHIMIE : Le fer et ses ions Les valeurs données sont à 25°C, température de travail. D- Données structurales données : NA | 6,02.1023 mol1 ; premiers éléments chimiques (par Z croissant) : H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar, K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn... D.1) La masse molaire du fer est M = 56 g.mol1 et sa masse volumique est µ | 7,9.103 kg.m3 en phase solide ; sans préjuger de la structure réelle du cristal, en déduire un ordre de grandeur de la distance entre les noyaux. D.2) Le fer est un métal de transition de numéro atomique Z = 26. Déterminer sa configuration électronique puis sa position dans la classification périodique des éléments. D.3) Par analyse du spectre d'émission, on détecte dans la couronne solaire des ions Fe13+ (ce qui témoigne d'une température de l'ordre de 106 K !) ; quel est l'élément dont l'atome est isoélectronique de cet ion exotique ? Entre cet atome et l'ion Fe13+, lequel présente le plus grand rayon (à justifier) ? D.4) Lorsqu'on compare les potentiels rédox standards des couples du type X2+ / X dans la ligne du fer, on constate que celui du manganèse est anormalement bas, ce qui signifie que Mn se transforme plus facilement en X2+ que ses voisins (...24Cr, 25Mn, 26Fe ...) ; interpréter ce fait en relation avec les structures électroniques de valence des cations obtenus. ············· E- Analyse d'une méthode de dosage données : NA | 6,02.1023 mol1 ; e | 1,6.1019 C ; R.T.ln(10) / F | 0,06 V ; E°1 (Ce4+ / Ce3+) = 1,72 V ; E°2 (Fe3+ / Fe2+) = 0,77 V. E.1) On envisage le dosage potentiométrique des ions fer(II) par des ions cérium(IV) (ions ferreux et ions cériques) : écrire la réaction de dosage. Quelle est la quantité d'électricité échangée pour un avancement de 1 mole ? E.2) Si l'on prépare un mélange initialement équimolaire en ions ferreux et cériques, quelles relations simples aura-t-on entre les concentrations à l'équilibre des ions fer(II) et cérium(IV) d'une part, fer(III) et cérium(III) d'autre part ? En déduire la valeur du potentiel d'équilibre Eéq. de cette solution, en fonction de E°1 et E°2. E.3) Exprimer (en justifiant) la constante d'équilibre de la réaction de dosage : K = f(E°1,E°2). Faire l'application numérique et conclure. E.4) On dose une solution ferreuse contenant initialement a mol d'ions E' fer(II) dans un volume V0, par une solution d'ions cérium(IV) de même concentration ; la quantité d'ions cériques apportés à un stade donné du dosage est y.a, avec y · [0,2]. Tout au long du dosage, on mesure la différence de potentiel E' entre une électrode de platine plongeant dans la solution et une électrode de référence au calomel saturée (E.C.S.). En représentant E' = f(y), on obtient une courbe dont l'allure est figurée ci-contre. On rappelle qu'à 25 °C le potentiel de l'E.C.S. par rapy port à l'électrode normale à hydrogène vaut 0,25 V. E.4.1) Schématiser le dispositif décrit en identifiant clairement les électrodes et la tension mesurée (on ne demande pas de détailler la structure de l'E.C.S.). E.4.2) Sans nouveaux calculs, donner la valeur du potentiel E' pour y = 1. En déduire la proportion d'ions ferreux résiduels (non dosés) lorsque y = 1, sous la forme [Fe2+]éq / [Fe2+]0 ; conclure. E.4.3) Comparer les concentrations à l'équilibre des espèces du cérium lorsque y = 2 ; en déduire le potentiel E' de la solution lorsque y = 2. En raisonnant de façon analogue sur les espèces du fer lorsque y = 1/2 ; en déduire le potentiel E' de la solution lorsque y = 1/2. CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 7/8 E.4.4) Compte tenu des questions précédentes, la courbe obtenue permettra-t-elle ou non un dosage précis (à justifier) ? E.5) En fait, on mesure E'(y = 1/2) | 0,42 V. Pour interpréter cet écart à la théorie, sachant qu'on travaille en milieu sulfurique et qu'on a utilisé des sulfates (ferreux et cérique), on envisage la formation d'un ion complexe Fe(SO4)+ entre le fer(III) et l'ion sulfate en excès (remarque : l'ion sulfate complexe aussi les ions fer(II), mais beaucoup plus faiblement et on négligera ce phénomène). On donne pour ce complexe : pKd = 3,85 ; d'autre part, lorsque y = 1/2, la concentration en ions sulfates est voisine de 102 mol.L1. Exprimer E'(y = 1/2) en tenant compte de la complexation du fer(III) et montrer qu'on retrouve effectivement la valeur mesurée. ············· F- Étude d'une cinétique d'oxydation données : les couples mis en jeu sont I2 / I et Fe3+ / Fe2+ (toutes espèces dissoutes dans l'eau). F.1) Écrire l'équation bilan de l'oxydation des ions iodure par les ions fer(III), en affectant les espèces du fer du coefficient stoechiométrique 1. Si la concentration d'ions iodure passe de c0 à c0 x entre 0 et t, comment définit-on par rapport à x la vitesse volumique v de la réaction ? F.2) On suppose une cinétique avec ordre, de constante de vitesse k ; on note a l'ordre partiel par rapport aux ions fer(III) et b l'ordre partiel par rapport aux ions iodure. Comment s'écrit la vitesse v ? Quelle est alors l'unité usuelle de k (au besoin en fonction de a et b) ? F.3) A la date t après le mélange d'une solution d'iodure de potassium avec une solution ferrique, on prélève à la pipette 5 mL de solution et on le dilue 10 fois avant de procéder à un dosage de la quantité d'iode formée. Justifier l'intérêt cinétique de cette dilution. F.4) Les résultats d'une série de mesures sont présentés ci-dessous, x se rapportant à la quantité d'ions iodure qui ont été oxydés dans le milieu réactionnel à la date du prélèvement. t (s) x (µmol / L) 60 13 120 25 180 36 240 46 300 55 Que représente la grandeur x(t) / t ? Pourquoi diminue-t-elle en cours de réaction ? Sur votre copie, représenter graphiquement cette grandeur en fonction de t à partir du tableau ci-dessus, avec en abscisse t · [0 , 300 s] ; en déduire une estimation de la valeur initiale (dx/dt)0. F.5) Grâce à la méthode précédente, on détermine les valeurs initiales de (dx/dt)0 pour différentes concentrations initiales des deux réactifs. Quelques résultats sont présentés ci-dessous : c0 = [I]0 en µmol / L 2 2 2 6 6 8 [Fe3+]0 en µmol / L 2 4 8 2 4 8 (dx/dt)0 en µmol.L1.s1 5,7 11,1 22,5 52 99 354 En déduire les valeurs de a et b, supposées entières. F.6) Déterminer la valeur de la constante de vitesse k définie à la question 2 ; on précisera la méthode suivie pour utiliser au mieux les données. F.7) Dans l'hypothèse d'un état initial ne contenant que les deux réactifs à la même concentration c0, établir la relation littérale donnant x(t), sous la forme : « expression en (x,c0) = expression en (k,t) ». En déduire la dépendance entre le temps de demi-réaction W et la concentration c0. ~ FIN ~ CONCOURS COMMUN SUP 2008 DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Page 8/8