CONCOURS COMMUN 2003
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve de Physique Chimie
(toutes filières)
Mercredi 21 mai 2003 de 08h00 à 12h00
Barème indicatif : Physique environ 2/3 -- Chimie environ 1/3
Instructions générales :
Les candidats doivent vérifier que le sujet comprend : 14 pages numérotées
1/14, 2/14, ...14/14
La dernière page (feuille annexe) est à découper et à joindre à la copie.
Les candidats sont invités à porter une attention particulière a la rédaction :
les copies illisibles ou
mal présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres
correspondante.
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
l'attribution de
points.
Partie A : Étude de quelques montages
Une bobine réelle est un dipôle constitué par enroulement cylindrique d'un fil
électrique. Elle est
caractérisée par son autoinductance L et sa résistance interne r.
La bobine est dite parfaite si sa résistance interne est négligeable.
A.]. Donner la relation entre le courant i qui traverse une bobine parfaite et
la tension u--L à ses
homes (on précisera à l'aide d'un schéma les conventions d'orientation adoptées
pour i et uL).
Les valeurs usuelles des inductances rencontrées s'échelonnent de quelques
henrys à quelques
millihenrys. '
A.2. On se propose d'étudier la réponse d'un circuit (RL) à une tension en
créneaux délivrée par un
générateur basse fréquence (G.B.F.).'
Le circuit représenté sur la figure 1 comporte une bobine parfaite d'inductance
L, une résistance R
et un G.B.F. délivrant une tension en créneaux u représentée sur la figure 2.
Figure 1
O "PQ T 3sz 2T 5T!2 %
Figure 2
A.2.1. On définit la constante de temps 1:, exprimée en secondes, du circuit
(RL) par une relation du
type "C = L°'.RB où oc et B sont deux constantes réelles. Par analyse
dimensionnelle rapide, déterminer
la valeur des exposants ou et B (on raisonnera à partir des caractéristiques
entre u et i).
A.2.2. Pour 0 S t < -- , établir l'equat10n d1fferent1elle regrssant les var1aüons de l 1ntens1te 1 dans le 2 circuit. L'intégrer en justifiant soigneusement la détermination de la (des) constante(s) d'intégra- tion. En déduire l'expression de uL(t). Tracer l'allure des courbes représentatives de i(t) et de uL(t) en précisant les valeurs vers lesquelles ces fonctions tendent en régime permanent, ainsi que les pentes des tangentes à l'origine. A.2.3. Déterminer complètement l'expression de i(t) et de uL(t) pour Î-- S t < T . 2 A.2.4. Le G.B.F. est réglé sur la fréquence f = 1,0 kHz, la bobine a pour inductance L= 1,0H et R= 1,0.103 Q. Comparer la période T de la tension délivrée par le G.B.F. et la constante de temps t du circuit. Tracer qualitativement l'évolution des graphes de i(t) et uL(t) sur quelques périodes. A.3. Dans le circuit de la figure 1, le G.B.F . est à présent en mode sinusoïdal. En utilisant les analogies transitoire-alternatif écrire, à partir de l'équation différentielle établie en A.2.2., la loi d'Ohm complexe liant les amplitudes complexes _l_]_ et [ respectivement de la tension aux bornes du dipôle AB et de l'intensité du courant le traversant. En déduire l'impédance complexe _Z_ du dipôle AB. A.4. On s'intéresse au quadripôle de la figure 3, constitué de deux cellules (RL) enchaînées, alimenté par une tension sinusoïdale de pulsation oe. L:: O «fifi-""' ...-"=: ..:---- L % dll---- "= \\\\ È'--s\\\* Figure3 A.4.1. En étudiant le comportement asymptotique du quadripôle aux hautes et basses fréquences, préciser la nature du filtre ainsi constitué. A.4.2. Déterminer la fonction de transfert _11 ( jx) de ce quadripôle en fonction de X = --L2 , après R avoir précisé la dimension de X. A.4.3. Tracer le diagramme de Bode asymptotique de ce filtre, en le justifiant. Tracer ensuite, sur les mêmes graphes, l'allure des courbes réelles gdB = f(log X), où gdB désigne le gain en décibel, et (p = f(log X) où (p désigne l'argument de la fonction de transfert. A.4.4. Comment modifier le montage pour obtenir un filtre dont la fonction de transfert s'écrirait comme le carré de la fonction de transfert d'un filtre (RL) ? FIN DE LA PARTIE A Partie B : Étude du mouvement de satellites Pour cette partie, vous aurez à compléter, et à rendre avec la copie, la feuille annexe se trouvant enfin de sujet La Terre possède un seul satellite naturel : la Lune. De nombreux satellites artificiels sont par ailleurs placés en orbite autour de la Terre, dans des buts variés tels que les télécommunications, la météorologie, la défense. . . Cette partie se propose d'étudier quelques caractéristiques du mouvement des satellites terrestres. Dans cette partie, on désignera par MT et RT respectivement la masse et le rayon de la Terre. On donne RT = 6370 km, MT = 5,98.1024 kg. On rappelle que la constante de gravitation universelle a pour valeur G = 6,67.10'11 N.m2.lçg'2 . B.]. Mouvement de la Lune autour de la Terre On précise que cette question ne nécessite aucune connaissance préalable d'astronomie. B.1.1. Le centre L de la Lune décrit, de manière uniforme, autour de la Terre, une orbite circulaire de centre T telle qu'en un jour le segment [TL] balaie un angle de 0,230 radian. B.1.1.a. Déterminer, en jours, la période TL de ce mouvement circulaire de la Lune autour de la Terre. B.1.l.b. Sachant que le rayon RTL de l'orbite circulaire décrite par la Lune est de 3,84.105 km, en déduire la valeur de la masse de la Terre (on justifiera la réponse). Le résultat est--il cohérent avec les données ? '- B.1.2. On sait que la Lune, dans son mouvement autour de la Terre, nous présente toujours la même face. En déduire les caractéristiques du mouvement propre de la Lune. B.1.3.a. Le schéma (1) de la feuille annexe représente les différentes phases de la Lune. On dit que la Lune est nouvelle lorsque la face qu'elle présente à la Terre n'est pas éclairée. Identifier la nouvelle Lune sur ce schéma, et préciser comment elle est alors vue depuis la Terre. B.1.3.b. Le cycle des phases de la Lune, appelé lunaison, dure TN = 29,5 jours. Pour expliquer la différence entre cette durée, et la période du mouvement circulaire de la Lune autour de la Terre, on doit prendre en compte le mouvement de la Terre autour du Soleil. Sur le schéma (II) de la feuille annexe, dessiner les positions de la Lune lors des nouvelles lunes successives à t et t + TN. Dessiner aussi la position de la lune à la date t + TL. Sachant que la Terre est en orbite circulaire de période TT = 365 jours autour du Soleil, retrouver la valeur de TN = 29,5 jours pour la lunaison. B.2. Quelques aspects de la satellisation En l'absence de précision explicite, on négligera tout frottement dû à l'atmosphère sur le satellite. B.2.1. On s'intéresse à un satellite artificiel, de masse m, en orbite circulaire de rayon R autour de la Terre. B.2.l.a. Montrer que le mouvement du satellite autour de la Terre est uniforme, et exprimer littéralement la vitesse vo. On exprimera d'abord vo en fonction de G, MT et R, puis en fonction de go, RT et R, où go désigne l'intensité du champ de pesanteur terrestre à la surface de la Terre. B.2.l.b. Le satellite SPOT (Satellite sPécialisé dans l'Observation de la Terre) est en orbite circulaire à l'altitude h =' 832 km au--dessus de la Terre. Calculer numériquement la vitesse vo de SPOT sur son orbite. B.2.2. La vitesse de libération v1 d'un satellite est la plus petite vitesse qu'il faut lui communiquer à la surface de la Terre pour qu'il aille à l'infini (en « se libérant » de l'attraction terrestre). Exprimer vl en fonction de G, MT et'RT et calculer sa valeur. B.2.3. Dans le cas d'une orbite circulaire du satellite autour de la Terre, montrer que l'énergie mécanique E... du satellite est liée à son énergie cinétique Ec par : E... = - EC. Si l'on tient à présent compte de la force de frottement de l'atmosphère sur le satellite, en déduire, en le justifiant, son effet sur la vitesse du satellite. B.2.4. Pour un satellite de masse m en mouvement (quelconque) autour de la Terre, et uniquement soumis à la force gravitationnelle terrestre, l'énergie mécanique peut s'écrire de la même façon que celle d'un point matériel en mouvement rectiligne placé dans un potentiel effectif Ugff(Ï) dont la courbe représentative est donnée sur la figure 4 : 2 E = lm(9Ï] + U 817 (r) avec r la distance du satellite au centre de la Terre. 2 dt EUR (5) (4) (3) (2) (1) Figure 4 Après avoir justifié que l'énergie mécanique E du satellite est une constante de son mouvement, préciser, pour chacune des valeurs de E (notées de (l) à (S)) représentées sur la figure 4, la nature de la trajectoire du satellite et celle de son état, lié ou de diffusion. FIN DE LA PARTIE B Partie C : Étude de quelques phénomènes irréversibles Dans cette partie, les questions C.1., C.2. et C.3. sont indépendantes. C.1. Préliminaire Définir ce qu'est une transformation réversible. Donner deux exemples de phénomènes à l'origine de l'irréversibilité d'une transformation. C.2. Illustration du principe d'entropie maximale Deux cylindres de même section S, contenant deux gaz qui peuvent être différents, sont fermés par deux pistons étanches. Ces deux pistons sont solidaires en ce sens que leurs axes restent verticaux et sont attachés aux bras d'un levier dont le point fixe est deux fois plus près du premier cylindre que du second, comme indiqué sur la figure 5. Les deux cylindres reposent sur une table qui conduit la chaleur (une table métallique) et a pour seul effet de permettre les échanges de chaleur entre les deux systèmes, c'est-à-dire entre les gaz contenus dans les deux cylindres. Le système complet formé par ces deux cylindres est isolé et n'est pas soumis à une pression extérieure. Les capacités thermiques des cylindres et de la table sont négligeables. 23 Cylindre 2 l'dl _?ÆË... W # ;: ... .. Èf? Figure 5 C.2.1. Déterminer la relation imposée par la présence du levier sur les variations de volumes dV1 et dV2 des deux cylindres. C.2.2. Écrire l'expression de la variation infinitésimale (18 du système complet formé par les deux cylindres en fonction des températures T1 et T2 des gaz contenus dans les deux cylindres, des pressions P1 et P2 qui règnent dans les deux cylindres et des seules variations dV1 (variation de volume du gaz contenu dans le cylindre 1) et dU1 (variation de l'énergie interne du gaz contenu dans le cylindre 1). C.2.3. Que vaut dS lorsque le système complet est à l'équilibre '? En déduire la relation entre les températures T1 et T2, puis celle entre les pressions P1 et P2 des gaz dans les cylindres 1 et 2 lorsque l'équilibre est atteint. C.3. Échauffement d'un solide On considère un solide de masse m = 1,0 kg, de capacité thermique massique c = 10 J .kg'l.K'l, se trouvant initialement à la température T1 = 273 K, placé dans une grande quantité d'eau (constituant un thermostat) à la température T2 = 373 K. C.3.]. Lorsque l'équilibre thermodynamique est atteint : - quelle est la température du solide ? - quelle est la température du thermostat ? C.3.2. Déterminer la variation d'entropie AS...ide du solide lors de ce processus, en fonction de m, c, T1 et T2 ; puis faites l'application numérique. C.3.3. Déterminer la variation d'entropie AS... de l'eau lors de ce processus, en fonction de m, c, T1 et T2 ; puis faites l'application numérique. C.3.4. En déduire la variation de l'entropie de l'univers ASunivm, constitué par l'ensemble {solide + thermostat}, lors de ce processus ; puis faites l'application numérique. Commentez votre résultat. C.3.5. On découpe le processus précédent en une infinité de petits processus au cours desquels on élève la température du solide de T à T + AT (avec AT << T) par contact avec une infinité de thermostats de températures infiniment proches les unes des autres. Montrer que, pour une étape intermédiaire, on peut écrire : ASUÏIÏVQÏS : mc ln 1+£ _ AT . T T + AT , , .. AT . . En developpant ce resultat au deux1eme ordre en ---- , montrer que AS...VEURrs est proportmnnelle a T T température AT entre deux thermostats successifs tend vers zéro. 2 AT , . , , . . . . . . . (-----) . En dedu1re que ce processus peut etre rendu rever31ble a la 11m1te ou la variation de On rappelle que, lorsque x << 1 : x2 Olnl+x zx------. ( ) 2 .(l+x)n z1+nx+sz. 2 FIN DE LA PARTIE C Partie D : Chimie, autour de l'élément oxygène L'oxygène est un élément d'une énorme importance, tant biologique qu'industrielle (respiration, combustions ...). C'est, par ailleurs, l'élément le plus abondant (49,5 % en masse) dans l'écorce terrestre. Cette partie s'intéresse donc à l'élément, à diverses molécules et à diverses réactions dans lesquelles il intervient. Chimie structurale D.1.1. Donner la structure électronique de l'atome 120 dans son état fondamental. D.1.2. L'oxygène existe sous la forme de trois isotopes de nombre de masse respectifs 16, 17 et 18. Après avoir rappelé la définition du terme «isotope >>, préciser la composition
du noyau de chacun
des isotopes de l'oxygène.
D.1.3. Le plus important des corps purs simples formés avec l'oxygène est le
dioxygène 02.
Proposer une formule de Lewis pour la molécule de dioxygène.
L'ozone 03 est un gaz se caractérisant par son odeur forte (ozone, du grec
azein : sentir). Proposez
une formule de Lewis pour cette molécule et préciser la géométrie de la
molécule (on précise que la
molécule d'ozone n'est pas cyclique).
D.1.4. L'eau HZO et l'eau oxygénée, ou peroxyde d'hydrogène, H202 sont deux
molécules
contenant l'élément oxygène.
Proposer une formule de Lewis pour ces deux molécules.
Une expérience amusante consiste à faire dévier de sa trajectoire un mince
filet d'eau à l'aide d'une
règle électrisée. Comment interpréter simplement cette expérience '?
Solutions agueuses
Dosage du dioxygène par la méthode de Winkler
L'eau contient en permanence du dioxygène dissous ; ce dernier y est consommé à
la fois par les
systèmes chimiques et biologiques qui s'y trouvent. Le dosage du dioxygène
dissous dans une eau
donnée permet de déterminer sa qualité : une concentration en dioxygène trop
faible est en effet
signe de pollution.
La méthode de Winkler, présentée ici, est une méthode de dosage en retour, par
iodométrie, du
dioxygène dissous en solution aqueuse.
1°"étape : On place, dans un grand cristallisoir, destiné à récupérer l'excès
de produits introduits,
un erlenmeyer de 250 mL rempli à ras bord de l'eau à analyser. On introduit
également un barreau
magnétique. ,
On ajoute 1,0 g de soude (ou hydroxyde de sodium) NaOH et 1,4 g de chlorure de
manganèse solide
MHC12(S). On bouche alors rapidement l'erlenmeyer en veillant à ne pas y
emprisonner d'air, et on
agite le mélange pendant 30 minutes environ.
D.2.1. Écrire l'équation traduisant la précipitation des ions Mn2+, provenant
du chlorure de
manganèse, et des ions hydroxyde HO', provenant de la soude, en hydroxyde de
manganèse (II). Le
produit de solubilité correspondant vaut Ks = 2. 10'13 .
Montrer que les ions hydroxyde sont en excès par rapport aux ions manganèse
(II) et calculer le pH
de début de précipitation en supposant une concentration initiale en ions
manganèse de
5,0.10'2 mol.L'l.
Cette réaction peut être considérée comme quantitative, le manganèse au degré
d'oxydation (Il) est
alors présent exclusivement sous forme de son hydroxyde.
ème :
2 etape : Le dioxygène présent dans l'eau oxyde alors Mn(OH)2(S) en Mn(OH)3(S)
selon la réaction
quantitative d'équation, notée (l) :
4 Mn(OH)2(S) + O2(aq) + 2 H20 9 4 Mn(OH)3(S) (1)
Ceci se traduit par l'apparition d'un précipité brun dans l'erlenmeyer.
D.2.2. Quel est le degré d'oxydation (ou nombre d'oxydation) de Mn dans
Mn(OH)2(S) et
Mn(OH)3(S) ?
Pourquoi a-t-on pris soin de boucher rapidement, et sans emprisonner d'air,
l'erlenmeyer après
avoir...ajouté la soude et le chlorure de manganèse (Il) ?
D.2.3. Le but de la manipulation étant le dosage du dioxygène dissous, quel
composé, de
Mn(OH)Z® et de Oz(aq), doit être en excès ?
On supposera cette condition réalisée pour le dosage de l'exercice.
3°'"°étape : On ouvre alors l'erlenmeyer, et on ajoute rapidement de l'acide
sulfurique concentré.
Ceci a pour effet de rendre la solution acide et de dissoudre les hydroxydes du
manganèse selon les
réactions quantitatives et rapides suivantes :
Mn(OH)3(S) formé + 3 I'I+ % Mn3+ + 3 H20 (2)
Mn(OH)2(S) + 2 H+ % Mn2+ + 2 H20 (3)
On admet qu'au pH où se trouve à présent la solution, le dioxygène dissous ne
peut plus oxyder le
manganèse au degré d'oxydation (Il).
D.2.4. Pourquoi l'ajout d'acide sulfurique doit--il être rapide ? Est-il
nécessaire de reboucher
l'erlenmeyer après cet ajout ?
4ème '
etape : On ajoute alors 3 g de iodure de potassium KI(S).
D.2.5. Écrire l'équation, notée (4), traduisant la réaction d'oxydoréduction se
produisant entre les
ions iodure I' et les ions manganèse (III) Mn3+. Calculer sa constante
d'équilibre. Cette réaction est-
elle quantitative '?
5èmeétape: On pipette alors exactement V0 = 50,0 mL de cette solution que l'on
dose par une
solution de thiosulfate de sodium de concentration C = 1,0.10'2 mol.L"', en
présence d'empois
d'amidon. Soit Ve le volume à l'équivalence.
D.2.6. Écrire l'équation, notée (5), traduisant cette réaction de dosage. À
quoi sert l'empois
d'amidon ajouté ?
D.2.7. En utilisant les équations redox écrites, déterminer la relation entre
la concentration initiale
en oxygène dissous dans cette eau, [O2(aq)], le volume équivalent Ve, le volume
pipetté Vo et la
concentration en thiosulfate de sodium C.
D.2.8. On obtient un volume équivalent V6 = 11,0 mL. Déterminer la
concentration en dioxygène
dissous dans cette eau. Qualifier l'eau dosée d'après le tableau présenté
ci-après.
Classement Eau Eau potable Eau Eau médiocre
d'excellente industrielle
qualité
Usages Tous usages Industrie alimentaire, Irrigation Navigation,
souhaitables abreuvage des animaux, refroidissement.
' isciculture, bai. nade.
02 dissous en >7 5à7 3à5 <3 m_.L'1 D.2.9. En considérant les équations redox écrites, trouver la relation bilan entre O2 et I'. Quel est donc le rôle des ions Mn3+ ? Données : Masses molaires (en g.mol'l) : NaOH : 40 MnCl2: 126 O2: 32 Couples redox : Mn"/ Mn2+ 12 /1' s4oô2' / s2032'. Potentiels standards d'oxydoréduction : Mn'+/ Mm2+ E1° = 1,51 v I2 / I' E2° = 1,23 V %=0,06 àT=298K Cinétique chimique Décomposition de l'ozone atmosphérique L'air atmosphérique est un mélange de gaz dont les constituants essentiels sont le diazote et le dioxygène. À ces deux constituants s'ajoutent en quantités variables, mais faibles, d'autres gaz dont l'ozone 03. Cet ozone forme une fine couche protectrice permettant de filtrer des rayonnements nocifs arrivant sur Terre. Le but de cette partie est d'étudier le mécanisme de la décomposition de l'ozone, et l'influence des chlorofluorocarbures (C.F.C.) sur cette décomposition (qui mène au problème actuel du « trou » dans la couche d'ozone). D.3.1. L'ozone est thermodynamiquement instable par rapport au dioxygène. Il peut se décomposer, en l'absence de catalyseur, suivant la réaction très lente : 2 Ûa(g) 9 3 02(g) pour laquelle on peut proposer le mécanisme suivant : k1 O3.:: 02 + °O' k...1 o,+°0°--îà--+zo, D.3.l.a. Rappeler la définition d'un intermédiaire réactionnel. Illustrez votre définition d'un exemple tiré du mécanisme précédent. D.3.l.b. Déterminer la loi de vitesse de la réaction précédente en fonction de [03], [02] et des constantes de vitesse. On appliquera pour cela le principe de Bodenstein, ou des états quasi- stationnaires. D.3.1.c. On dit que le dioxygène joue le rôle d'inhibiteur de cette réaction. Justifier cette affirmation. D.3.2. Il y a une petite vingtaine d'années, on a commencé à soupçonner les C.F.C. d'accroître cette destruction de l'ozone atmosphérique. En effet, la vitesse de décomposition de l'ozone est fortement accrue en présence de dichlore. Le mécanisme proposé est le mécanisme de réaction en chaîne suivant : C1, + 0, -À-> ClO' + (310; (l)
c10; + @, --kz--+ (310, + 0, (2)
(310, + 0, --'fâ--+ 010; + 2 o, (3)
(310; + 010; --k4--+ C1, + 3 o, (4)
(Le radical ClO' formé dans (1) se détruit sans participer à la propagation de
la chaîne).
D.3.2.a. Rappeler les différentes étapes, ainsi que leur signification, que
comporte un mécanisme de
réaction en chaîne. Identifiez-les dans le mécanisme ici proposé.
D.3.2.b. La loi de vitesse obtenue à partir de ce mécanisme peut s'écrire :
k
v = ,/Ê: k3 [0121"2[031".
Justifier alors le rôle catalytique du dichlore dans la décomposition de
l'ozone.
D.3.2.c. On définit la longueur moyenne de chaîne, notée !, par :
l _ vitesse globale de décomposition de 03 _
vitesse d' initiation
Déterminer l'expression de l en fonction de [03], [Cl2] et des ki (i = 1, 2, 3
ou 4). Quelle est
l'influence de [Clz] sur cette longueur de chaîne '?
D.3.2.d. Montrer, en utilisant la relation du 3.2.b., que la réaction globale
obéit à la loi d'Arrhénius.
En déduire l'expression de son énergie d'activation en fonction des énergies
d'activation des
différentes étapes.
FIN DE LA PARTIE D
FIN DE L'EPREUVE
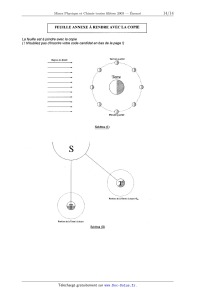
FEUILLE ANNEXE A RENDRE AVEC LA COPIE
La feuille est à joindre avec la copie
( ! N'oubliez pas d'inscrire votre code candidat en bas dela page !)
Rayo ns du Soleil Denver quartier
----------------+ ...e...
___--"_" F »- " .-- \ \
___-_--
' !
___--___-- '|* |
\ l'
.. f
,. ?
.... '. l
\ |'
\ .'
----------------F \ '__
H"--._'_ 5 F_ædææJ
.... __ ( â_-
Pnemierqüarfier
Schéma (I)
; \\ _ Positi on de la Terme à la date t+TN
Position de la Terre à la date t
Schéma (11)
Code candidat : ....