CONCOURS COMMUN 2000
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Epreuve de Physique et Chimie
(toutes filières)
Lundi 22 mai 2000 de 08h00 à 12h00
Hydrogène
CAS n°1333-74-0
Dangefl
Inflammable
Instructions générales :
Les candidats doivent vérifier que le sujet comprend 12 pages (6 recto-verso)
ainsi
qu'une page intitulée « document-réponse ».
Les candidats sont invités à porter une attention particulière à la rédaction:
les
copies illisibles ou mal présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à
barres correspondante.
Instructions spécifiques à l'épreuve de Physique et Chimie :
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
Les candidats insèreront le document--réponse dans les autres feuilles de
composition après y avoir reporté leur code d'inscription.
Epreuve de Physique et Chimie (toutes filières) Page 1/12
Hydrogène : découvert par Henry Cavendisñ en 1766,
nommé par £avoisier (du grec ñuzfôr, eau, et germain, engendrer}
Corps simp[e gazeux, trés [égeï, qui entre c&1ns [a composition oû: l'eau.
C 'est ['éfément &zp[us a50naümt dans F univers.
l-- Etude de modèles atomiques pour l'atome d'hydrogène : Thomson et Bohr
Il -- Utilisation du dihydrogène dans les ballons sondes
Ill -- Détection de l'hydrogène interstellaire
IV -- Déplacement isotopique du spectre de l'hydrogène ; hydrures
V -- Réactivité du dihydrogène avec le dioxygène : cinétique
VI -- Réactivité du dihydrogène avec le dioxygène : moteur d'Ariane V
VII -- Réactivité du dihydrogène avec le dioxygène : pile à combustible
%
Permittivité du vide : 50 = 8,8 10"12 F.m'1
Célérité de la lumière : c = 3 108 ms"1
Constante de Planck: h = 6,62 10"34 J.S
Nombre d'Avogadro : 5\@, = 6,02 1023 mol"1
Charge élémentaire : e = 1,6 10"19 C
Electron Volt: 1 eV = 1,6 10"19 J
Constante des gaz parfaits : R = 8,32 .J.K"1.mol'1
Accélération de pesanteur : g = 9,8 ms"2
Constante de Rydberg pour l'isotope 1H : RH = 109 740 cm"1
Masses :
Masses molaires (en gmol'1):
Mair = 29 MH = 2 M0 = 32
2 2
Masses atomiques :
On note mH et mD les masses respectives des noyaux de 1H et 2H (deutérium)
mH = 1,00782 u ; mD = 20141 u ; avec u unité de masse atomique
Pour l'électron, me= 5,510"4u z 9,1 10"31 kg
Données thermodynamiques à 298 K :
Enthalpie standard de formation de H20(g) : AfH° = ---241,8 k.].mol"1
Capacités thermiques isobares : H2(g): C... = 27,28 + 3,26.10"3.T
(en J.K"1 mol--1) H20(g): cp2 : 30,54 + 10,29.10--3.T
Potentiel standard de O...) / H20... : E° : 1,23 V à pH = 0
page 2/12 Epreuve de Physique et Chimie (toutes filières)
PHYSIQUE
l -- Genèse d'un modèle atomique
On eflectue une courte approcñe Historique d' un modê[e pour [' atome
d'ñycfroge'ne.
Aucune connaissance préafa5[e n'est requise ni sur ûzs modè[es, ni en
atomistique.
Un modèle globuleux pour l'hydrogène atomique (1902)
Sir ]osepñ--Joñn Tñ0mson (1856-1940), N05e[1906
Proton sphérique
uniformément chargé , _ ,
L anglais J.J.Thomson proposa de representer le noyau comme
une sphère finie de centre O, de rayon R, chargée avec une
densité uniforme de charge volumique p.
La charge totale de la sphère est celle du noyau : +e.
Soit un point M de coordonnées sphériques (r, 9, (p) et les
vecteurs unitaires des coordonnées sphériques (: _, :)
rl 91 (P
------> ---->
0M=ru
H Q...OEÆMKJMÆLM
M -a Exprimer la densité volumique de charge p du noyau en fonction de e et R.
l-1-b Donner la direction de Ë au point M en la justifiant.
l-1-c De quelles variables spatiales Ë au point M dépend-il ? Justifier.
l--1-d Déterminer Ëen fonction de p, en et O_IVÏ pour un point M à l'intérieur
de la
sphère.
l-2 Étude du mouvement d'osci/lation de l'électron
Dans ce modèle, l'électron n'est soumis qu'à la force d'attraction du noyau
dans le repère galiléen lié à ce dernier. L'électron de masse m3 est au point
M et reste à l'intérieur du noyau (r < R). cro--Ni l-2-a Démontrer que 2 + coâ.O--NÎ : ô . t Exprimer la fréquence fo de cet oscillateur harmonique en fonction uniquement de e, R, 80 et me . l-2-b La plus petite fréquence observée à l'époque dans le spectre de l'hydrogène atomique était f...... = 460 THz = 460 1012 Hz. En déduire une valeur numérique R,... majorant R. C'est l'ordre de grandeur du rayon du noyau. l_--g Critique du modèle Quelle est l'estimation actuelle du rayon du noyau d'hydrogène ? Ce modê&z a été rapidement a6ancümne' auproflt du moa@[e püme'taire de Boñr suite aux expériences de Rutñerford en 1912-1913. Epreuve de Physique et Chimie (toutes filières) page 3/12 Un modèle planétaire pour l'hydrogène atomique (1913) 3Vîe£ç Boñr (1885--1962), Noäe[1922 Si le modè[e de Bo/ir ne permet pas de décrire [' atome d'ñyc[rogéne cüz manière correcte, ce dinosaure Je fatarnistique a néanmoins [' immense mérite de donner accès aux ordres && grancflaur caractéristiques cfle [' atome et d'introduire [a quantÿficati0n oû manière très simpûz. /|\/| Le noyau ponctuel est fixe en O. L'électron est en / / M. On se place dans le référentiel du noyau (ZR) lié --)---->------>
à la base orthonormée directe (Qu... uy', ul) .
Il est supposé galiléen.
(Qu--:, @) est le repère de projection polaire.
, _,
En permanence, OM : r. u,
& Éléments cinétiques du mouvement circulaire de l'électron
L'électron décrit une trajectoire circulaire de centre O et de rayon r. Sa
masse est me. On admettra que la seule force non négligeable sur l'électron
_» EUR ------->
est la force d'interaction coulombienne noyau--électron : f : ------Î.u, .
4. ft. 8°.f'
l-4-a Déterminer la norme v de la vitesse de l'électron dans (R) en fonction de
e, 50» ret me.
l-4--b Déterminer la norme L du moment cinétique orbital par rapport à O de
l'électron dans (R) en fonction de e, 801 ret me.
-->
l-4-c Démontrer que la force f dérive d'une énergie potentielle E,J que l'on
exprimera en fonction de e, 50, et r. On prendra EP --'*ΰ-->O.
l-4-d En déduire l'énergie mécanique E de l'électron dans (R) en fonction de
e, 80, etr.
;
& Equation aux dimensions
Sir Josepñ £armor (1857--1942) ; Jean ?errin {1870-1942}, N05e[1926
La puissance P rayonnée par un électron ayant une accélération a est
e".ay.c'
6.7r.EUR° '
l-5-a Déterminer les entiers x, y et 2 par une analyse dimensionnelle.
donnée par la formule de Larmor : P :
l-5-b Jean Perrin avait proposé en 1901 ce type de modèle planétaire (l--4).
Expliquer pourquoi il semble incompatible avec la formule de Larmor.
page 4/12 Epreuve de Physique et Chimie (toutes filières)
l_--_OE3' Quant/fication des éléments cinétiques
Pour expliquer le spectre de l'hydrogène, Bohr postule la quantification des
elements cmehques de l electron. Il en resulte que L : n.h, neN*. \ h = --
2.7t
l-6-a Déduire que le rayon est quantifié en exprimant r,, en fonction de n et n,
valeur de r,) pour n = 1. Exprimer le rayon de Bohr r1, en fonction de
e, So» me et h et le calculer.
l-6-b Déduire que l'énergie mécanique est quantifiée en exprimant E,, en
fonction
de n et E1. Exprimer E en fonction de e, 80» m9 et h et la calculer.
l-6-c L'électron passe du niveau p d'énergie Ep au niveau q d'énergie Eq, p > q
.
Il y a émission d'un photon de longueur d'onde /1 et de nombre d'onde a.
On a a = % = a. me.(a1--z--âz--). Exprimer a en fonction de e, h, 30 etc.
Calculer numériquement la constante spectrographique (a. me) .
Cette syntñe'se afizs icüies (fl: 5Max ?[ancÆ (quanta) et d'OErnest Rutñerforc[
(noyau
ponctue[ ) a fait [aforce c[u moaüâ[e a[è iBoñr à son époque.
& Un problème à deux corps : le déplacement isotopique
Haro[a[C. 'Urey (1893--1981), W06e[1934
On admet la formule du l-6-c. On se place dans le référentiel barycentrique.
l-7-a Le noyau n'est pas immobile et a une masse m. En remarquant que & reste
constant, expliquer comment il suffit de corriger la formule précédente.
l-7-b L'hydrogène a deux isotopes naturels : 1H et le deutérium 2H noté D ;
Le spectre de D est décalé par rapport à celui de H de Aa : 0'D --0'H.
AO" . . ,
Trouver -- en fonction de mH, mg, et me. mD > mH (vorr donnees)
O-H
Calculer numériquement cette valeur.
Le deutérium (0,01% de ['ñycfrogéne nature0 @ été dëcouvert en 1931 par 'Urey en
oäservant dàns [e spectre de ['ñyc[rogéne [es raies dues au üÿ[acement
isotopique .
l-_8 Le magnéton de Bohr
La rotation de période T de l'électron autour du noyau crée un courant
d'intensité I:; et un moment magnétique TM:
l-8-a Exprimer ΣΠen fonction de e, (9, r et des vecteurs de projection.
l-8-b Démontrer que ÎfiZ=--y.Ï où L est le moment cinétique orbital de
l'électron par rapport à O. Exprimer le rapport gyromagnétique orbital 7 en
fonction de e et me.
l-8-c De la quantification du moment cinétique, déduire la valeur numérique du
magnéton de Bohr,uB, valeur de IML pour n = 1.
Le magnétisme é[ectronique est vérfipar de très nombreuses expériences et
uti[isé
cûtns dè n0m6reux instruments aûz afiâtection ('R'POE, R:MIN ).
Epreuve de Physique et Chimie (toutes filières) page 5/12
ll -- Un hommage à Teisserenc de Bort
Si te premier 6a[[on sonde au cfiñyofifogene est dû a Gustave [Hermitte et
Georges
Besançon (1892), c'est incontestañlèment a Fingéniosité et a la ténacité de
['atyyique
Léon Teisserenc c[e Bart (1855-1913), que nous devons [a mise au point des
tecñniques
d' investigation par 6a[[on--sonoû et [apremiére cartograpñie atmospñérique.
On note (Oz) l'axe vertical ascendant, z = 0 au niveau du sol. a: --g.fiî
Étude de la troposphère
La troposphère est la partie de l'atmosphère terrestre inférieure à 10 km.
On la considère comme un gaz parfait de pression p(z), de température T(z) et de
volume massigue v(z). Au sol, on a la pression p0 et la température To.
Elle est en équilibre thermodynamique et mécanique et obéit à la loi
polytropique
empirique p*(z).T(z) : pg".T0 avec k = 0,15. loi (1)
M Questions préliminaires
ll-1 -a Comment peut--on qualifier la transformation correspondant au cas k = 0
?
ll-1-b Définir les mots « homogène » et « isotrope ».
Caractérisent-ils la troposphère ?
"4 -c Donner l'équation d'état d'un gaz parfait liant p(z), v(z), R, M... et
T(z). @@
ll-1-d Exprimer la loi de la statique des fluides avec g, ? et v(z). loi(3)
z
l_l£ Détermination du gradient thermique
------>
ll-2-a Le gradient thermique est grad(T(z))=--äuî. Déduire 5 en fonction de
k, Mai,, 9 et R à partir des lois ((1), (2) et (B)).
Calculer numériquement ô.
ll-2-b Donner la loi de variation T(z) en fonction de T... 5 et z.
@ Évolution du volume d'une quantité de gaz constante
On considère une quantité constante de n moles de gaz parfait à l'altitude 2
qui évolue dans la troposphère. On note V(z) le volume qu'elle occupe à
l'altitude z et Vo son volume au sol.
V(z)
V
0
Déterminer la loi en fonction de 5, Z, T0 et k.
£a troposphère fut dénommée ainsi en 1902 par Léon Teisserenc ae Bart apartir de
la racine « tropos », &: cñangement Ifdëcouwit aussi [a stratospñe're.
___--___"...--
page 6/12 Epreuve de Physique et Chimie (toutes filières)
Ascension d'un ballon sonde
Le ballon sonde dégonflé et instrumenté a une masse totale m8 = 1,2 kg.
On gonfle au sol son enveloppe avec n° moles de dihydrogène. Son volume
est alors Vo.
L'enveloppe reste fermée tant que son volume V(z) < V = 10 %. max Lorsque V(z) : V..., l'enveloppe se déchire et le ballon retombe au sol. ll-4 Quels sont les avantages et les inconvénients du dihydrogène ? @ Phase ascensionne/Ie à enveloppe hermétiquement fermée _, Sur ce ballon s'exerce une force de frottement Flrottement . -----> ----->
La force totale s'exerçant sur le ballon est (F -- mB.g).uz + Ffrottement.
ll-5-a En effectuant un bilan des forces, déterminer le terme F en fonction de
no, g,
""H2 et Mair.
ll-5-b Calculer la valeur minimale nm,--,, de no pour que le ballon décolle.
ll-5-c On admet le modèle de troposphère précédent. Durant l'ascension, on peut
considérer que la pression et la température sont quasiment identiques à
l'intérieur et à l'extérieur du ballon.
Calculer h, altitude maximale atteinte en prenant T() = 293 K.
Commenter le résultat.
ll-6 Etude qualitative dans le cas d'une petite déchirure
Dans le cas d'une petite déchirure, le ballon ne retombe pas instantanément
au sol. Il se vide lentement de son gaz. On propose une simulation graphique
de sa descente.
Compléter les graphes F(t) et z(t) du document réponse fournit avec le sujet
en n'oubliant pas d'y reporter votre code candidat.
La représentation est qualitative, mais un soin particulier doit être apporté
afin de respecter les lois de la physique étudiées précédemment.
£es actue[s 5a[[0ns sont radio--sondes aüzpuis 1927. Le proä[ême de [a
récupération du matérie[ est ainsi secondaire. L'aftitude atteinte par ce type
de 6a[[0n est cû l'ordre && 25--30Æm m sont depuis une dizaine d années
remp[is dñé[ium
Epreuve de Physique et Chimie (toutes filières) page 7/12
III -- Simulation d'un élément de radiotélescope
Inauguré en 1965, &: racfioté[escope a[écimétrique oû Nançay a été créép0ur
étudier
le a[éca[age Dopp&er de [a raie 21 cm oû: [' atome d'ñyofiogéne due au coup[age
spin nucléaire--spin éléctronique. C'est un moyenprivitëgié d' étude de [a
cinématique
de [' ñydrogéne interste[[aire, et aümc des mouvements oüms Funivers.
'De 1956 à 1967, de nom5reux cñercñeurs ont travai[[é ci [a trés dë[icate mise
aupoint
de [a cñaine de réception suivante.
amplificateur
antenne: refroidi à 20 K mélangeur chaîne amplificatrice
cornet focal
de 3 m 1420 MHz signal déca|é
sur 0,5 m
Oscillateur
local
1450 MHZ
On se propose afiz reproduire simplement [e principe d'un mé[angeur en T'? en se
p[açant 6 dëcadèsp[us 6615 en fréquence.
"|_-- Dédoublement de fréquence
Aucune connaissance préalable du AD633 n'est nécessaire.
On a deux tensions : a (t) = A. JÎÏ cos (2. n.Q.t) fa =1420 Hz
e0(t) : EO.J2_.cos (2.n.fo.t+çao) f(, = 1450 Hz
mises aux entrées d'un multiplieur AD633 ; on obtient en sortie une tension :
m (t) = a (t)-eee)
Démontrer que m(t) est la superposition de deux signaux sinusoïdaux de
fréquence fet f' > f : m (t) = M. [cos (2. n.f.t + %) + cos (2. n.f'.t + %)]
Calculer numériquement fet f'.
page 8/12 Epreuve de Physique et Chimie (toutes filières)
Filtre e
|||--2
On utilise le filtre suivant : "
elf) c HÏs(0
Ill-2-a En effectuant un schéma équivalent en BF (basse fréquence), puis un
autre
en HF (haute fréquence), déterminer sans calcul le type de ce filtre.
lll-2-b Déterminer la fonction de transfert fi(x)de ce filtre en fonction de x
: oe.RC.
Ill-2-c Déterminer sa pulsation de coupure wc en fonction de R et C.
llfillîll.llJllflllfi.ll.llJll.fill.l||.llJllflllîll.ll
||..||T||.|il|iîiiTii.ii4iiâii-ul|.||;||+||.uii.ii
n.
n
0.
d
r.
0I
n
e.
n
: D. | |
.l
t
a
u-
d
a
r
g
1
gain en_dB
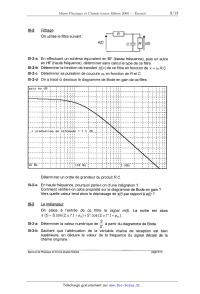
lll-2-d On a tracé ci dessous le diagramme de Bode en gain de ce filtre.
le diagramme de Bode en gain ?
e sur
'
on cette propriét
Vers quelle valeur tend alors le déphasage de s(t) par rapport à e(t) '?
--t--
Déterminer un ordre de grandeur du produit R. C.
Ill-2-e En haute fréquence, pourquoi parle--t-on d'une intégration ?
Comment vérifie
eee/é de la
'
partir du diagramme de Bode.
S
de ce filtre le signal m(t). La sortie est alors
-- à
s (t) : S.cos (2.7r.f.f +(ps)+S'.cos (2.7Ï.f'.t+Çüs,).
, en déduire la valeur de la fréquence du signal d
8!
Ill-3-b Sachant que l'atténuation de la véritable chaîne de réception est bien
e
d
6
U
.w.
r
é
m
u
% n
...... ...
% oe
: a .
rl v %
% à m .m
r 9
e e oe.n
n C .m uo
,.la m m .oee
e p r rn
m e .e.|
e n &... ...uvæ
L 0 D 80
a
3 3
|. |.
page9M2
Epreuve de Physique et Chimie (toutes filières)
CHIMIE
Àpre's une courte étude de ['ñycfroge'ne atomique, nous nous intéresserons a [a
granc&
réactivité du afiñydrogéne avec le afioxyge'ne.
IV -- Etude de l'hydrogène atomique
fil_;1 Déplacement isotopique du sgectre de l'hydrogène
On a relevé en nm les 4 longueurs d'onde les plus élevées des séries de
Balmer pour l'hydrogène ('H) et son isotope naturel, le deutérium D (ZH).
Données pour le IV- 1-b
lV-1 -a Rappeler la formule de Ritz.
lV-1-b On rappelle que la série de Balmer correspond à la désexcitation de
l'atome
vers le niveau d'énergie E2.
Déterminer à cinq chiffres significatifs la constante de Rydberg RD pour le
deutérium. On précisera obligatoirement la méthode de calcul employée.
lV-2 Niveaux énergétiques
En notant n le nombre quantique principal, préciser sans démonstration le
nombre de spin--orbitales (ou nombre maximal d'électrons) d'un niveau
d'énergie En.
lV-3 Affinité électronique de l'hydrogène
lV-3-a Définir l'affinité À de l'hydrogène en écrivant la réaction associée.
lV-3-b Sachant que la constante d'écran de la sous-couche is est 0'1s=0,30,
calculer fil en eV.
lV-3-c Les tables de données chimiques nous donnent: fll=70 kJ.mol"1>0.
Comment expliquer cette valeur très surprenante par rapport au lV-3-b ?
lV-3-d Cette affinité faible, mais positive, limite l'existence des ions
hydrures aux
éléments les plus électropositifs. A quelle famille appartiennent ces
derniers ?
V -- Synthèse de l'eau dans un réacteur
1
Le mécanisme exact de [a réaction H2 +_02 _) H20 reste encore indéterminé. On
peut
néanmoins proposer dans [e désorcfie [e mécanisme réactionne[ayprocñé suivant :
H°+02 L> oOH+OZ * (1) V1
oOH + H2 #) H20 + H- (2) vz
H- À_> Hadsorbé ( 3 ) V3
Hz _'&._> 2 H- (4 ) V4
0:+H2 #) oOH+H- (5) V5
page 10/12 Epreuve de Physique et Chimie (toutes filières)
V-1 Préliminaires
V-1 -a Identifier les trois phases du mécanisme et préciser leur nom ainsi que
les
réactions qui leurs sont associées.
V-1-b Quelles sont les charges des espèces 00H, 02 et H- ?
V-2 Vitesse de formation de l'eau
V-2-a Ecrire avec les vitesses V,- les équations traduisant l'approximation des
états
quasi stationnaires.
V-2-b Ecrire les vitesses vi des 5 réactions en fonction des k,-- et de la
concentration
des espèces (loi de Van't Hoff).
d [H20l
V-2-c Calculer v = , vitesse volumique de formation de l'eau en fonction de
k1,k3,k4,[H2] et [02].
V-2-d Pour [02] = ; , que se passe-t-il ?
diamètre 5,4 m
hauteur 30 m
masse totale 170 tonnes
oussée 100 tonnes
25 tonnes d'hydrogène
L'étage principal
130 tonnes d'oxygène
°"°teChnique (EPC) °°"tenanoe liquides stockées à
et le moteur Vulcain basse température
temps de
. 70 secondes
consommation 5
Source : CNES
Les ergols (carburant H2 et comburant 02) sont vaporisés et réchaufiés à environ
Ti = 298 K avant d'être mélangés.
Vl-1 Préliminaires
Vl-1 -a On note xo la fraction molaire initiale du comburant. Calculer xa.
Vl-1-b Ecrire l'équation bilan de la réaction de combustion entre les ergols ?
Les ergols ne sont pas en proportion stoechiométrique. Lequel est en excès ?
Vl-1 -c Donner un ordre de grandeur des enthalpies standard de formation de Hz
(9)
et 02 (g) .
Par la suite, on notera ne le nombre de moles total initial (comburant et
carburant).
Epreuve de Physique et Chimie (toutes filières) page 11/12
Æ Température de flamme : _
Etat initial : (1--x9).n0 moles de H2 et x0.nÔ moles de 02 gazeux à p°, T;.
Etat final : gaz résiduel a p°, Tf
On admet que l'air extérieur n'intervient pas lors de cette combustion.
La transformation est supposée isobare ( à la pression p°) et adiabatique.
VI-2-a Donner la composition du gaz résiduel dans l'état final. On tiendra
compte du
' fait qu'un ergol est en excès.
Vl-2-b Déterminer la variation d'enthalpie AH du système entre l'état initial
et l'état
final.
Vl--2-c Calculer la température de flamme adiabatique due à ce mélange en
précisant bien votre raisonnement.
Vl-3 Puissance :
Evaluer l'ordre de grandeur de la puissance moyenne du moteur Vulcain.
VII -- La pile à combustible
Inventée en 1839 par Sir Wi[[iam RoEert grave, e[[e prit && [' intérêt grâce ci
[a
conquête spatiafe. Depuis ks missions .Àpo[[o, une âpre compétition
techno[agique
s'est engagée car e[[e permet une propufision propre afiavançant de très [ain
[ès
moteurs tñermiques en rendement. Le tancüzm Mercedes--ford a présenté [ 'un
dernier [a Necar 4, une dose A avec de trés ñonoraô[es performances.
Oñjectif commercia[ annoncé : 2005...
VII--1 Compréhension dela pile
Vll-1-a Dessiner la pile Pt le(g) (1 bar) {Hzo... , KOH (1 moi_L--1)l02(g) (1
bar)l Pt
Préciser sur ce schéma sa polarité et le sens de déplacement des électrons.
Vll-1-b Noter sur le schéma la cathode, l'anode et leurs définitions.
Vll-1-c Quel type de conduction a--t--on dans la potasse ?
VII--2 Etude dela Qi/é
Vll-2-a Ecrire les deux demi réactions ayant lieu aux deux électrodes dans le
milieu
électrolytique contenant la potasse.
Vll-2--b Déterminer la formule de la force électromotrice de cette pile pour des
pressions en dihydrogène et dioxygène de 1 bar.
VII-2-c Pour une pile de 10 kW, calculer la charge débitée en une heure. En
déduire
la consommation en 9h"1 en dihydrogène, puis en dioxygène.
fin du stg'et
page 12/12 Epreuve de Physique et Chimie (toutes filières)
| |
0 ! ! !
AZ | | | >
| | |
| | |
h _ -------------------------- |- _____ -| ______ |_. ______
| ' | | t
| | |
0 0 - - _ . . , >
Iretour au soil
Code candidat :
Epreuve de Physique et Chimie (toutes filières)
Document réponse